만성골수성백혈병의 최신동향
Recent Advances of Management for Chronic Myeloid Leukemia
Article information
Trans Abstract
The clinical outcome for patients with chronic myeloid leukemia (CML) has improved radically in the past 15 years. Imatinib led to high rates of complete cytogenetic responses and improved survival for patients with this disease. However, approximately 25-35% of patients in chronic phase treated with imatinib developed treatment failure.
Development of next-generation Tyrosine kinase inhibitors (TKIs), such as dasatinib, nilotinib, radotinib, bosutinib, and ponatinib, has provided new therapeutic option for the patients resistant or intolerant to imatinib. Second generation (2G) TKIs were active in most clinically relevant BCR-ABL mutations, except highly resistant T315I.
Through the phase 3 international randomized studies of 2G TKIs (dasatinib, nilotinib, and bosutinib) vs. imatinib, 2G TKIs emerged as the standard treatment for CML and have successfully prolonged the duration of both the chronic phase (CP) and the disease-free state. The majority of newly diagnosed patients treated with 2G TKIs achieved a complete cytogenetic response (CCyR), and over time, most of these eventually achieved major molecular responses (MMRs) and even complete molecular responses (CMRs). More recently, both dasatinib and nilotinib were approved for frontline use, and dasatinib, nilotinib, radotinib and bosutinib were approved for second-line use in patients with CML.
Ponatinib represents the third generation of TKI, and this drug has been developed with the aim of targeting a specific BCR-ABL1 mutation (T315I), which arises in the setting of prolonged TKI therapy and leads to resistance to all commercially available TKIs. (Korean J Med 2012;83:718-723)
서 론
과거 15년 동안 만성골수성백혈병의 진단과 치료에는 많은 변화가 일어났다. 인류 최초의 표적항암제 이매티닙은 높은 완전염색체반응률(complete cytogenetic response; CCyR, 진단시 100%였던 필라델피아 암 염색체가 0%로 관찰되지 않는 반응)을 보이며 많은 환자에게 생존율의 획기적인 증가를 가져왔다[1].
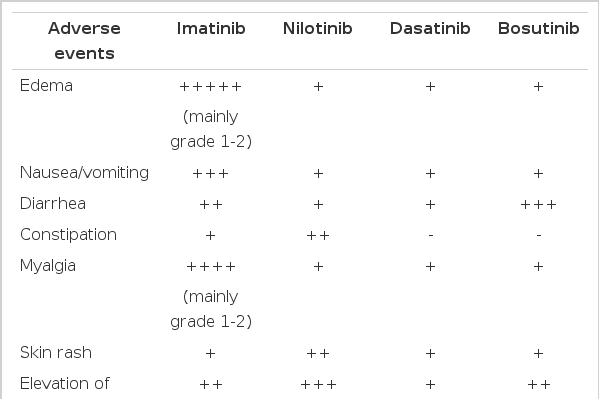
하지만 초기 만성기에 이매티닙을 사용한 환자의 약 25-35%의 환자는 치료에 실패하고 있다[2]. 이매티닙보다 BCR-ABL1 키나제에 대한 흡착력을 개선하기 위해 설계된 다사티닙, 닐로티닙, 라도티닙, 보수티닙 등의 새로운 2세대 표적항암제는 이매티닙 치료에 실패한 환자들의 치료를 위한 새로운 대안을 제시하고 있다(Table 1).
처음 진단된 환자를 대상으로 진행된 닐로티닙, 다사티닙의 3상 임상연구 결과는 이매티닙에 비하여 2세대 표적항암제가 염색체반응률, 유전자반응률이 더 우수하고 가속기, 급성기로의 진행률 또한 획기적으로 줄일 수 있어, 생존기간의 획기적인 연장을 가능하게 할 수 있을 것으로 평가되고 있다[3,4].
최근 1, 2세대 표적항암제에 반응을 보이지 않는 T315I 점돌연변이를 가진 내성세포에도 반응을 나타내는 새로운 3세대 표적항암제 포나티닙이 2상 임상연구를 마치고 3상 임상연구를 시작하고 있다. 이러한 새로운 표적항암제의 등장은 보다 예민도가 우수한 새로운 진단법의 조기 도입을 불러왔으며 이를 통하여 백혈병 세포를 측정한 후 미세한 수준으로 감소하여 일정기간 유전자가 발견되지 않는 환자에서 표적항암제의 성공적인 중단 가능성까지도 보여 주고 있다[5].
본 종설에서는 만성골수성백혈병의 치료를 획기적으로 변화시킨 BCR-ABL1 타이로신 키나제 억제 표적항암제를 이용한 최신 치료 동향과 그 결과가 향후 이 질환의 치료에 미칠 영향에 대하여 종합적으로 분석하고자 한다.
본 론
이매티닙을 이용한 치료 결과: IRIS, Hammersmith 병원, 서울성모병원 연구
염색체/유전자 반응률 및 생존율
경구 복용 이매티닙과 인터페론 주사요법을 처음 진단된 환자 1,106명을 대상으로 2000년 초부터 시작된 무작위 배정 국제 3상 임상시험 연구인 International Randomized Study of Interferon vs. STI571 (IRIS) trial 결과, 이매티닙은 82%의 6년 누적 완전염색체반응률과 93%의 무진행생존율(progression free survival; PFS), 83%의 무사건생존율(event free survival; EFS)을 보이며 기존의 표준 치료법인 인터페론 주사요법을 대신하여 1차 표준요법으로 자리매김하게 되었다[6].
한편 실제 임상적인 측면에서 모든 환자를 장기간 추적 관찰한 단일기관의 연구인 영국의 Hammersmith 병원과 한국의 서울성모병원 연구가 다기관 국제임상연구의 결과는 염색체반응률 뿐만 아니라 유전자 반응률도 함께 보고되었는데, 204명의 이매티닙 단독 투여군을 분석한 Hammersmith 병원의 연구 결과는 5년간 39%의 주요유전자반응률을 보였고 이중 90%의 환자가 반응을 지속하는 것으로 평가되었다[7]. 처음 진단된 363명의 만성기 환자를 대상으로 이매티닙 단독 투여군의 7년 누적 주요유전자반응률(major molecular response; MMR, 진단 시 100%였던 BCR-ABL1 암 유전자가 0.1% 이하로 감소하는 반응)이 60%, 완전유전자반응률(complete molecular response; CMR, BCR-ABL1 암 유전자가 0%로 감소하여 관찰되지 않는 반응)이 14%로 보고되었다. 또한 처음 치료시에 이매티닙 용량을 고용량을 사용한 환자에서 유전자 반응률의 개선을 관찰하여 표적항암제 투여 시 적절한 용량의 투여가 반응률을 증가시키고, 생존 기간을 늘리는 데 중요한 인자임을 알 수 있었다. 하지만 7년간의 추적관찰 기간 중 29% (105명)의 환자는 치료에 대한 내성(49명), 조혈모세포 이식으로의 치료 변경(23명), 이매티닙 부작용에 의한 치료 중단(15명), 이매티닙 치료 중 사망(3명), 기타의 이유(15명)로 이매티닙 치료를 중단하였고, 이 중 74.3% (78명)가 처음 이매티닙 치료를 시작한 후 첫 2년 이내에 치료가 중단되었다[2].
처음 진단된 476명의 만성기 환자를 대상으로 치료 개시 12개월에 주요유전자반응률을 표준용량의 이매티닙과 비교하는 이매티닙 고용량 임상연구(TOPS; tyrosine kinase inhibitor optimization and selectivity study)에서 12개월째의 완전염색체 반응률은 표준용량과 고용량군에서 각각 66%, 70%로 차이가 없었고, 주요유전자반응률 또한 표준용량과 고용량군에서 각각 40%, 46%로 차이가 없었다. 하지만 고용량 투여군에서 치료 3-6개월 사이의 초기에 더 높은 완전염색체반응률과 주요유전자반응률을 보였고, 일일 평균복용량이 높은 환자들에게서 더 높은 주요유전자반응률을 관찰할 수 있었으나, 연구 탈락율이 이매티닙 400 mg 표준용량군에서 15.9%, 800 mg 고용량 투여군에서 19.7%였으며 주요 치료 중단 사유는 표준용량군에서는 불충분한 치료 효과였고, 고용량군에서는 부작용 때문이어서 고용량 투여군에서의 복용 순응도 저하가 장기적인 반응률을 증가시키는 데 실패하였음을 보여주고 있다[8].
이매티닙 연구 결론
이매티닙이 그동안의 여러 단일기관, 다기관 임상연구에서 염색체 및 유전자반응률의 개선, 장기생존율의 증가를 가지고 왔지만 여전히 치료에 실패하는 환자가 1/3에서 발생하고 있고, 특히 서울성모병원의 연구 결과 대부분의 치료 실패가 치료 시작 후 첫 1-2년 이내에 일어나기 때문에 이 기간 중에 치료에 대한 순응도를 높이고 치료에 대한 정확한 반응 평가, 적절한 부작용의 조절을 통한 초기 치료 용량의 유지가 임상에서의 중요한 과제이다.
이매티닙 연구 결과 주목할 만한 점은 예민도가 뛰어난 표준화된 실시간정량적유전자증폭검사법(RQ-PCR; real time quantitative reverse transcriptase polymerase chain reaction)에서도 BCR-ABL1 유전자가 더 이상 검출되지 않는 환자가 있고 이들 환자 일부에서 재발 없이 표적항암제의 성공적인 중단이 가능하여 표적항암제만으로도 일부 환자에서 기능적인 완치가 가능할 것으로 전망되고 있다[5,9].
2세대 표적항암제의 3상 임상연구 결과
닐로티닙의 3상 임상연구 결과
2007년부터 처음 만성기로 진단된 초기 환자 846명을 1) 닐로티닙 300 mg 1일 2회 투여군, 2) 닐로티닙 400 mg 1일 2회 투여군, 3) 대조군으로 이매티닙 400 mg 1일 1회 투여군의 3군으로 무작위 배정하여 시행된 3상 임상연구 결과를(ENESTnd; Evaluating Nilotinib Efficacy and Safety in Clinical Trials-Newly Diagnosed Patients) 보면, 36개월까지의 주요유전자반응률이 이매티닙 400 mg 군, 닐로티닙 600 mg 군, 닐로티닙 800 mg 군이 각각 53%, 73%, 70%를 보였고(p< 0.0001), 4.5로그 이하의 수준까지 감소한 완전유전자반응률은 15%, 32%, 28%를 보여 전반적인 유전자반응률이 닐로티닙군에서 의미 있게 높았다. 12, 24, 36개월에 분석된 가속기/급성기의 진행된 병기로의 전환율이나 치료 실패율이 닐로티닙군에서 지속적으로 낮은 결과를 보여 이매티닙을 대체하는 표준치료제로서의 가능성을 확고하게 보여주었다. 36개월의 추적 자료 분석에서 장기 생존율은 아직 통계적으로 의미 있는 차이를 보이지 않았지만(이매티닙 400 mg 군 vs. 닐로티닙 600 mg 군 vs. 닐로티닙 800 mg 군; 94% vs. 95.1% vs. 97%), 만성골수성백혈병이 장기간에 걸쳐 서서히 진행하는 특성을 가진 질환이기 때문에 치료 기간이 경과하면서 그 차이는 서서히 벌어질 것으로 예상되고 있다[3,10,11].
다사티닙의 3상 임상연구 결과
역시 2007년부터 처음 진단된 만성기 환자 519명의 환자를 1) 다사티닙 100 mg 1일 1회 투여군, 2) 대조군으로 이매티닙 400 mg 1일 1회 투여군의 2군으로 무작위 배정하여 시행된 3상 임상연구 결과(DASISION; Dasatinib versus Imatinib Study in Treatment-Naïve CML Patients)를 보면, 36개월까지의 주요유전자반응률이 이매티닙 400 mg 군과 다사티닙 100 mg 군이 각각 55%, 68%를 보였고(p< 0.001), 4.5로그 이하의 수준까지 감소한 24개월 완전유전자반응률은 8%와 17%를 보여 전반적인 유전자반응률이 다사티닙군에서 의미있게 높았다. 36개월까지 분석된 가속기/급성기의 진행된 병기로의 전환은 이매티닙군이 16명, 다사티닙군이 11명으로 다사티닙군에서 더 낮은 결과를 보여 다사티닙 역시 이매티닙을 대체하는 표준치료제로서의 가능성을 확고하게 보여주었다.
DASISION 연구에서 36개월까지의 생존율은 아직 통계적으로 의미 있는 차이를 보이지 않았지만(이매티닙 400 mg 군 vs. 다사티닙 100 mg 군; 93.2% vs. 93.7%), 이 또한 치료기간이 경과하면서 서서히 차이가 날 것으로 예상되고 있다[4,12,13].
보수티닙의 3상 임상연구 결과
2008년부터 처음 진단된 만성기 환자 502명의 환자를 1) 보수티닙 500 mg 1일 1회 투여군, 2) 대조군으로 이매티닙 400 mg 1일 1회 투여군의 2군으로 무작위 배정하여 시행된 3상 임상연구 결과(BELA; Bosutinib versus Imatinib in Patients with Chronic Phase Chronic Myeloid Leukemia)는, 18개월까지의 주요유전자반응률이 이매티닙 400 mg 군과 보수티닙 500 mg 군이 각각 45%, 55%를 보여 보수티닙군이 높은 반응률을 보였으나 통계적으로 차이가 없었고(p= 0.084), 4.5로그 이하의 수준까지 감소한 완전유전자반응률은 각각 10%와 18%를 보여 전반적인 유전자반응률이 보수티닙군이 높았다. 18개월까지 분석된 가속기/급성기의 진행된 병기로의 전환은 이매티닙군이 5%, 보수티닙군이 2%로 보수티닙군이 적었다. BELA 연구에서도 18개월의 생존율은 아직 통계적으로 의미 있는 차이를 보이지 않았지만(이매티닙 400 mg 군 vs. 보수티닙 100 mg 군; 95% vs. 99%), 이 또한 치료 기간이 경과하면서 서서히 차이가 날 것으로 예상되고 있다[14,15].
처음 진단된 환자에서 적절한 표적항암제의 선택
지난 12년간 처음 진단된 환자의 일차 치료제로 사용되어 온 1세대 표적항암제 이매티닙은 1) 만성골수성백혈병의 장기 생존율 증가, 2) 가속기/급성기로의 진행률 감소, 3) 조혈모세포이식과 비교한 삶의 질 향상에 크게 기여하여 왔다.
이매티닙보다 우수하면서 부작용이 의미 있게 적은 결과를 보여준 최근의 2세대 표적항암제 3상 비교 임상연구 결과들은 다양한 2세대 표적항암제를 일차 치료제로 사용할 때 얻을 수 있는 여러 가지 장점을 제시하고 있으며 정확한 일차 치료제의 선택기준은 1) 진단 당시의 Sokal 지수를 비롯한 예후 예측인자를 고려하여야 한다. 고 위험군의 경우, 고용량 이매티닙이나 2세대 표적항암제를 치료 초기부터 일차 요법으로 사용한 경우에 이매티닙 표준용량 치료에 비하여 반응률이나 질환의 진행률에서 더 우수함이 관찰되었고, 2) 또한 표적항암제가의 부작용 차이를 잘 고려하여야 한다. 즉, 이매티닙은 부종, 관절통, 근육경련, 피부의 약화, 결막출혈, 구토 등의 부작용이 대부분의 환자에서 발생하는 반면에 [6], 닐로티닙의 경우 혈당의 상승, 말초동맥혈관의 폐쇄증, 황달, 간기능 이상, 리파아제 등 췌장 효소의 증가 등이 자주 관찰되고[10], 반면 다사티닙은 혈소판 감소, 흉막삼출액, 폐동맥 고혈압 등이 발생할 수 있다[16]. 또한 보수티닙의 경우 설사 및 간기능 이상이 보고되어[17], 치료제 선택에 앞서 환자의 동반 질환의 유무와 종류가 세심하게 고려되어야만 한다(Table 2).
일차 치료에 실패한 환자의 이차 치료제 선택에 있어서는 이러한 부작용 이외에도 치료 실패의 주요 원인인 BCRABL1 점 돌연변이의 종류가 중요한 고려 사항이 된다. 즉, 이매티닙은 대부분의 점 돌연변이에 내성을 보이는 반면, 닐로티닙은 248-255번까지의 P-loop 점 돌연변이에 내성을 가지며[18], 다사티닙과 보수티닙의 경우 299, 317번 점 돌연변이에 내성을 보이는 것으로 알려져 있다[19-20]. 이러한 이유로 이차 치료제의 선택에서는 2세대 표적항암제에 내성을 보이는 점 돌연변이를 기반으로 하여 적절한 치료제를 선택하는 것이 중요하다.
결 론
최근에 2상 임상연구가 완료된 국산 2세대 표적항암제 라도티닙과 1, 2세대 표적항암제에 모두 내성을 가진 T315I 점 돌연변이에 효과가 있는 포나티닙의 고무적인 임상 연구 결과는 오늘날 다양한 표적항암제의 적용을 가능하게 하여 더 많은 환자들에게 경제적인 치료 비용으로 장기 생존율의 증가, 치료 실패율의 현저한 감소를 가능하게 할 것으로 전망되고 있다. 더불어 완전유전자반응을 보이는 환자들에게 일정한 기간의 반응 유지 후에 치료를 중단할 수 있는 완치 가능성까지도 열려있다. 향후 임상 현장에서는 이러한 치료제의 병합 요법을 포함한 다양한 완치 치료 전략이 개발될 것으로 예상되어 흥분된 마음으로 향후 10년간의 연구 결과가 기대된다.