완전 관해를 얻은 결합조직형성 소원형세포종양 1예
Desmoplastic Small Round Cell Tumor Achieved Complete Remission after High-Dose Chemotherapy with Aggressive Local Treatment Modalities
Article information
Abstract
결합조직형성 소원형세포종양은 주로 소아나 젊은 연령의 남성에서 발생하는 드문 종양으로 비교적 최근에 독립된 질환으로 분류되었으며, 아직 표준화된 치료법이 없는 예후가 나쁜 암이다. 저자들은 고용량의 복합항암화학 요법 외에도 방사선치료 그리고 두 차례의 수술의 적극적인 국소 요법을 병행하여 만 23개월째 무질병 상태로 생존한 환자 1예를 경험하였으며, 처음부터 완전한 근치적 절제가 불가능한 경우라도 고용량의 항암화학 요법에 반응이 있는 경우 적극적인 국소 치료의 병행이 환자의 생존을 연장시키는 중요한 치료 전략임을 강조하고자 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
A desmoplastic small-round-cell tumor (DSRCT) is a rare, aggressive neoplasm that develops mostly in the abdominal cavity in children and young adults. We present a case of a 19-year-old male with right upper quadrant discomfort for 3 months. On abdominal computerized tomography, multiple huge and demarcated masses were found in the liver, retroperitoneal lymph nodes, and peritoneal and retroperitoneal cavities. Fine needle aspiration biopsy of the hepatic mass was performed and DSRCT was diagnosed by hematoxylin and eosin staining and immunohistochemical analysis. He was treated initially with high-dose systemic chemotherapy (alternating schedules of cyclophosphamide, vincristine, doxorubicin, ifosfamide, and etoposide), underwent two debulking surgeries and pelvic irradiation between systemic chemotherapy schedules, and achieved complete remission after the 15 months of treatment duration. We report this case to emphasize the importance of aggressive local treatment modalities as well as high-dose systemic chemotherapy for treatment of DSRCT even with initially unresectable or extensively metastatic presentation. (Korean J Med 2012;83:378-384)
서 론
결합조직형성 소원형세포암(desmoplastic small round cell tumor)은 주로 소아나 젊은 연령층에서 발생하는 드문 종양이다. 임상적으로 대부분이 복강 내에 발생하고 진단 당시에 이미 간, 폐 및 임파선에 광범위하게 전이된 형태로 발견되어 수술적 치료로 완치가 불가능한 경우가 대부분이며 복합 항암화학 요법 및 방사선 치료에도 반응이 좋지 않고 현재까지 치료방법이 확립된 것이 없는 예후가 불량한 질환이다[1]. 조직학적으로 결합조직형성의 간질 내에 단일한 형태의 미분화된 소원형 세포로 구성되어 있으며, 면역조직화학적 염색법 시행 시 상피, 신경 그리고 근육에 대한 표지자들이 모두 양성을 나타내는 것을 특징으로 한다[2].
본 저자들은 내원 3개월 전부터 시작된 우상복부 불편감을 주소로 내원한 19세 남자 환자에서 복부전산화 단층촬영을 시행하여 다발성 간내 종양을 발견하였고, 간생검으로 얻은 조직으로 H&E 및 면역조직화학적 염색을 시행하여 결합 조직형성 소원형세포암으로 진단하고 15개월간의 고용량의 항암화학 요법과 방사선 요법, 그리고 두 차례의 수술 후 완전 관해를 얻은 1예를 경험하였으며, 이미 첫 진단 시에 수술이 불가능하거나 광범위한 다발성 전이가 동반되어도 고용량의 항암화학 요법과 더불어 적극적인 국소 요법의 중요성이 생존을 향상시키고 완치의 기회를 얻을 수 있음을 강조하기 위해 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 장○○
주 소: 우상복부 불편감
현병력: 내원 3개월 전부터 시작된 우상복부 불편감을 주소로 지역 병원 방문한 19세 남자로 복부 초음파 검사에서 간내 다발성 종괴가 발견되어 정밀 검사 위해 본원으로 전원되었다.
과거력: 특이사항 없음.
가족력: 특이사항 없음.
개통별 문진: 3개월 동안 5 kg의 체중감소
이학적 소견: 내원 당시 혈압은 124/74 mmHg, 맥박수 86회/분, 체온은 36.2℃였다. 신장은 168.0 cm, 몸무게는 65.3 kg이었다. 우상복부에 손바닥 한 뼘의 크기로 간이 만져졌으며 상당한 크기의 종괴도 복부의 여러 부위에서 만져졌다. 복부 종괴는 딱딱하고 고정되어 있었으며 압통은 없었다. 그 외 특이 소견은 없었다.
검사실 소견: 말초혈액검사상 백혈구 10,100/mm3, 혈색소 14.4 g/dL, 혈소판 수 280,000/mm3이었고, 혈청 생화학검사상 BUN 8 mg/dL, creatinine 0.7 mg/dL, AST 36 IU/L, ALT 21 IU/L, alkaline phosphatase 138 IU/L, 총 빌리루빈 0.8 mg/dL, 총 단백 7.8 g/dL, 알부빈 4.2 g/dL, 총 콜레스테롤 131 mg/dL, uric acid 7.8 mg/dL의 소견을 보였다. 혈청 유산탈수효소(lactate dehydrogenase)는 612 IU/L로 증가해 있었다. HBsAg/Ab (-/-), Anti-HCV(-)였고, 종양표지자 검사에서 alpha-fetoprotein은 1.8 ng/mL (0-20), β-human chorionic gonadotropin은 1.0 mIU/mL (0-3)으로 정상이었으며, carcinoembryonic antigen도 2.0 ng/mL (0-6)으로 정상 범위 이내로 측정되었다. CA 19-9는 37.4 U/mL (0-37)로 소량 증가한 소견을 보였으며, neuron specific enolase (NSE)는 47.3 ng/mL (0-13)으로 증가한 소견을 보였다.
방사선학적 소견: 단순흉부촬영상 특이소견 없었다. 복부전산화 단층촬영상 간 내에 다발성 조영 증강을 보이는 종괴가 다수 관찰되었고 상행결장, 후복강 및 복벽을 침범하는 조영 증강을 보이는 다발성 종괴가 관찰되었다. 또한 주변의 복강 및 후복강내의 임파선 비대도 관찰되었다(Fig. 1). 흉부전산화 단층촬영은 정상 소견이었다.
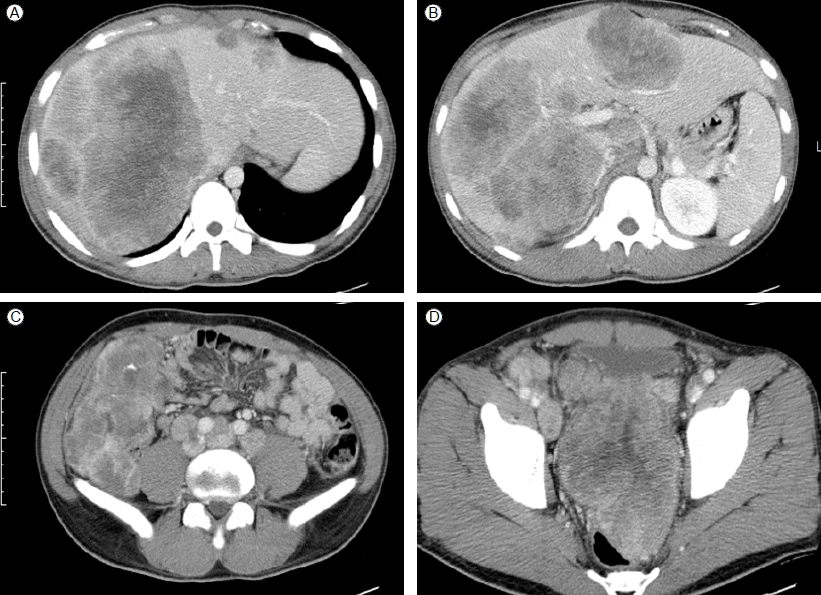
Computed tomography (CT) at initial diagnosis. Abdomen and pelvic CT scan showed heterogeneous multiple masses in the liver, retroperitoneal lymph node enlargement, and an intraabdominopelvic mass.
병리학적 소견: 진단을 위해 간종괴에 대해 가는바늘흡인 검사를 실시하였고, 광학현미경 소견상 비교적 크기가 적고 난원형의 세포들이 둥지를 보이고 있었으며 얇은 섬유조직에 의해 구획되어 있었고 면역조직화학 염색에서는 desmin, pancytokeratin, NSE, CD 99 양성을 보였다(Fig. 2). 이 환자의 경우 desmin, pancytokeratin 양성을 보여 결합조직형성 소원형세포종양으로 진단하였다.
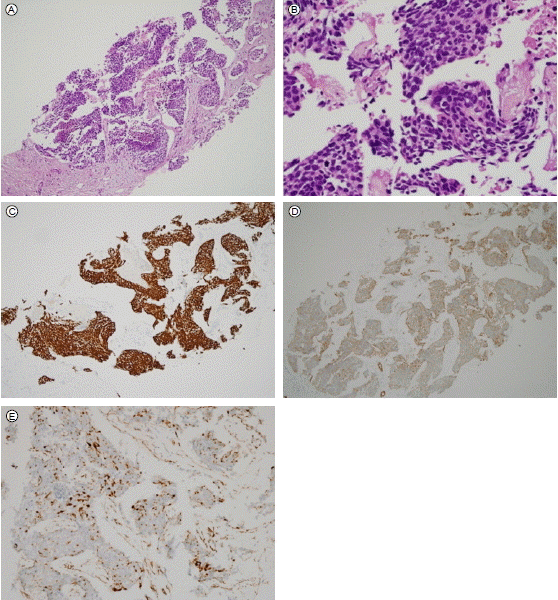
Microscopic findings of the biopsy from the hepati mass. The tumor nests were surrounded by desmoplastic stroma. Tumor cells showed oval to round nuclei with hyperchromatic, finely dispersed chromatin, inconspicuous nucleoli, and scanty cytoplasm [hematoxylin and eosin staining, × 100 (A), × 400 (B)]. The tumor cell cytoplasm was positively stained after immunohistochemical analysis using antibodies against desmin (C), cytokeratin (D), and WT1 (E).
치료 및 경과: 환자는 조직 검사 후 결합조직형성 소원형세포종양으로 진단되었으며, 진단 당시 간, 림프절, 그리고 복강 내에 종양이 광범위하게 퍼져 있어 2010년 3월 5일부터 우선 고용량의 전신 항암화학 요법으로 치료를 시작하였다. 항암화학 요법은 P6 protocol [3] (Table 1)으로 3차례의 high-dose CAV (cyclophosphamide, vincristine, doxorubicin) 투여 후에 촬영한 복부전산화 단층촬영에서 RECIST (Response Evaluation Criteria In Solid Tumor) 1.0에 의거한 partial response를 보였다. 이후 2차례의 high-dose IE (ifosfamide, etoposide)을 추가로 실시 후 추가적인 반응을 얻어 용적축소수술을 계획하였다(Fig. 3A). 2010년 7월 12일 우측 결장 반절제술, 간우엽절제술, 우측 부신절제술을 실시하였고 간의 다발성 종괴와 골반강 내의 종괴는 일부만 제거하여 수술 후에도 간과 골반강 내에 일부 종괴는 남아 있는 R2 resection이 되었다(Fig. 3B). 조직검사결과 역시 결합조직형성 소원형세포종양으로 확인되었고, 이후 high-dose CAV 1 차례와 highdose IE 1 차례를 추가로 실시하여 2010년 9월 24일 P6 protocol을 완료하였다. 계획된 P6 protocol 완료 후 doxorubicin의 축적 용량은 300 mg/m2였다. 추가적인 반응을 얻기 위하여 전신 항암화학 요법을 지속하기로 결정하였고 2010년 9월부터 2010년 11월까지 IE를 3회 추가로 시행하였으며, 추가적인 종양반응을 얻어서 2차 수술을 계획하였으나, 당시 상태에서 남아 있던 골반강 내의 종괴(Fig. 3B)를 제거하기 위해서는 골반내장적출술(pelvic extenteration)이 시행되어야 하였고, 이 경우 장루(colostomy)와 요루(urostomy) 형성이 필요하였기 때문에 환자의 향후 삶의 질을 고려하여 골반강 내 종괴를 추가적으로 줄이기 위한 국소 방사선 치료를 시행하기로 계획하였다. 2010년 12월부터 2011년 2월까지 골반강 내종괴에 대해 5,400 cGy의 방사선 치료를 시행하였으며, 방사선치료 기간 동안 용량을 줄인 IE 항암화학 요법을 2회 동시에 시행하였다. 방사선 치료 후 지연반응(delayed response)을 기대하기 위해 추가적인 전신 항암화학 요법을 시행하면서 경과관찰하기로 하였고, 2011년 3월부터 2011년 5월까지 추가적으로 high-dose CAV 요법을 2회 실시하였다(doxorubicin 축적 용량 429 mg/m2). 이후 1차 수술 후 남아 있었던 간내 종괴와 골반강 내의 종괴(Fig. 4A)는 2011년 5월 확인한 복부전산화 단층촬영(Fig. 4B)에서 모두 추가적인 반응을 보여 2011년 6월 20일 2차 수술을 시행하였으며, 2차 수술은 완치 목적의 종괴 절제를 시도하였다. 수술은 골반강 내 직장 방광부위에 종양(1.5 cm), 복강내 좌측 잘룩창자 옆 종양(8 mm), 그리고 간내 종양(3 cm)에 대해 제거수술을 실시하였다. 직장 방광부위 및 좌측잘룩창자 옆 종양 제거 경계에서 현미경적으로 악성세포가 확인되어 R1 resection이 되었다. 두 번째 수술 당시 제거 경계에 암이 남아 있던 골반강 내의 직장 방광부위에 국소적인 재발이 의심되는 소견이 있지만 아직 확실치 않으며 그 외 다른 병변의 증거는 없는 상태이다(Fig. 4C). 환자는 항암치료와 방사선 치료, 그리고 두 차례의 수술 등의 적극적인 치료로 만 23개월째 무질병 상태로 유지 중이며, 골반강 내 국소 재발 의심 병변에 대해서는 경과관찰하면서 재발의 증거가 확실해지는 시점에서 3차 수술적 치료를 고려하고 있다.
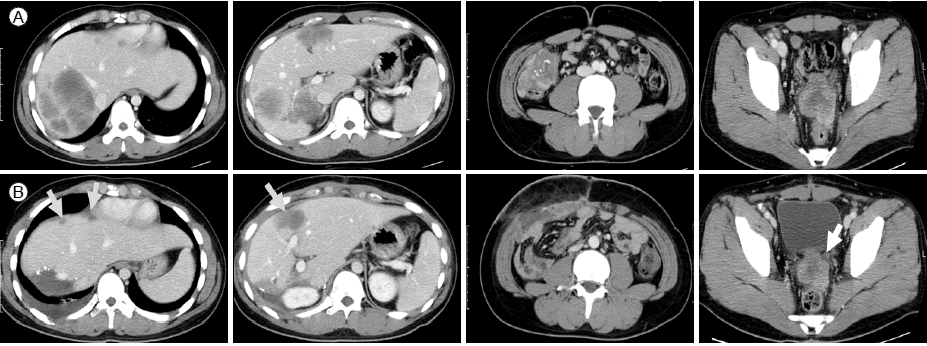
CT scans (A, performed on June 13, 2010) after 3 months of high-dose systemic chemotherapy. When compared with Figure 1, the objective response was a partial response by Response Evaluation Criteria In Solid Tumors (RECIST) 1.0. CT scans (B, performed on August 2, 2010) after an initial debulking operation. Gray arrows indicate residual lesions in the liver and pelvic cavity.
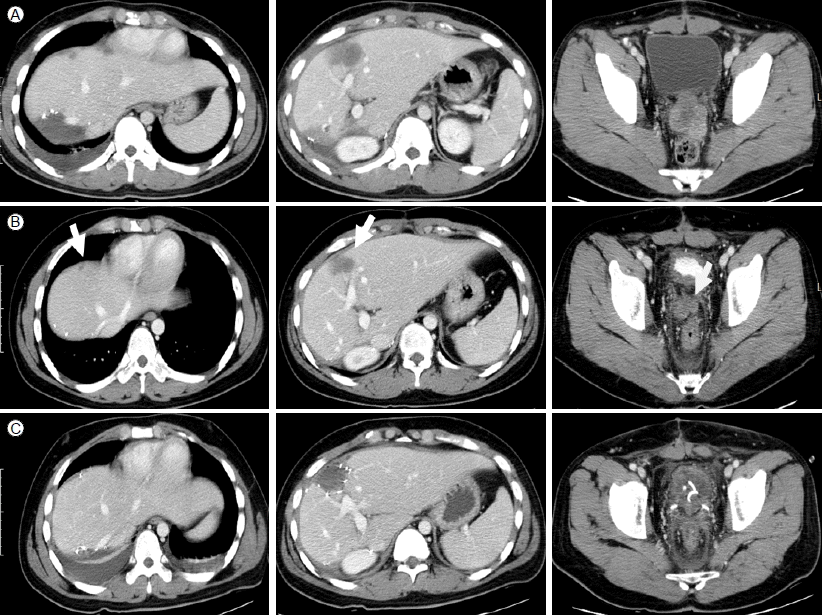
A comparison of CT scans before (A) and after (B, performed on May 5, 2011) additional high-dose chemotherapy and pelvic radiotherapy. Gray arrows indicate decreased residual tumors, and the pelvic mass, which was treated with radiotherapy, was much decreased and could be removed surgically without pelvic extenteration. CT scans (C, performed on June 27, 2011) after second surgery for curative intent. No definite viable tumor was found in the imaging study.
고 찰
1989년 Gerald와 Rosai가 8세 여아의 복강에서 발생한 특징적인 원발성 소세포 종양의 병리학적 소견을 “복강 내 결합조직형성 소원세포종양”이라는 이름으로 처음 독립적인 질환으로 보고되었고[4], 그 전에는 미분화 육종 또는 횡문근육종, 원시 신경외배엽 종양 등으로 분류되었을 것으로 여겨진다. 이후 전 세계적으로 200예 정도 보고가 되었고[1], 국내에서도 소수의 증례가 보고되었다.
1989년 이후 보고된 101명의 결합조직형성 소원형세포암 환자를 분석한 연구[5]를 살펴보면 평균 연령 21세(6-38세), 101명 중에 78명이 남자로 본 증례와 같이 젊은 남성이 대부분을 차지하였다. 또한 증상은 본 증례의 경우처럼 복부 종괴와 팽만 또는 불쾌감으로 내원하는 경우가 가장 많았고, 종괴에 의한 장폐색 또는 요로폐색 증상으로 나타나는 경우도 보고되었다. 대부분 복강내 복막에서 발생하며 비교적 경계가 뚜렷하고 큰 종괴와 주변 복막으로 관찰되는 부종괴가 흔히 나타나며 빠른 속도로 복막을 따라 전파하는 양상을 보인다. 종양이 복막으로 진행하지만 타 장기의 복막전이에 비해 다량의 악성 복수가 나타나는 빈도는 높지 않다고 알려져 있다. 다른 장기를 이차적으로 침범하기도 하며, 복강외로는 장간막, 폐, 간, 임파절, 중추신경계, 이하선, 손, 음낭, 난소, 후복막강을 침범하기도 한다.
영상진단 검사에서는 복강내 장기에서 기원한 명확한 실질 종괴가 특징이다. 대부분 복막에 위치하고 고형장기나 소화기계 주위로 침범하는 양상을 보인다. 또한 다발성의 복막내 부종괴가 나타나며 종괴가 클수록 중심부에 괴사 또는 출혈성 괴사를 보일 수 있다. 진단을 위해서는 조직학적인 확진이 필요한데, 다른 소원형 세포종양과 구분되는 특징은 조직학적으로 풍부한 섬유 혹은 섬유 점액양의 결합 조직을 형성하는 기질 내에 상피세포처럼 보이는 종양세포들이 다양한 크기와 모양의 군집을 형성하고 있는 점이다. 개개의 종양세포들은 크기가 작고 모양은 둥글거나 난원형이며 세포질의 양이 적다. 그러나 이와 같은 병리조직학적 검사만으로 다른 소원형 세포 종양과 감별이 어려워 면역조직화학검사를 시행하게 된다. 면역조직화학검사에서 결합조직형성 소원형세포종양은 간엽 조직 표지자인 desmin과 vimentin, 그리고 신경세포 표지자인 neuron specific enolase, neurofilaments, S-100단백 및 Leu 7 등의 동시 발현이 특징적이며, 이런 점은 감별에 큰 도움을 준다[2,6].
세포유적학적 이상소견인 t (11;22) (p13;q12) 전위가 결합 조직형성 소원형세포종양에서 특징적으로 존재함이 Sawyer 등[7]에 보고되었고 이후 이 세포유전학적 이상소견은 진단에 도움이 되었다. RT-PCR 방법이나 southern blot hybridization 또는 phosphoglycerated kinase를 이용한 방법으로 EWS-WT1 fusion gene의 존재를 대부분 확인할 수 있으며 이는 진단에 큰 도움이 된다[6]. 본 증례에서는 현미경 소견과 면역조직화학 검사결과가 결합조직형성 소원형세포종양과 합당하였고 WT1 면역조직화학검사결과도 양성을 확인하였다. 이에 추가적인 유전학적 검사는 실시하지 않았다.
치료방법으로는 수술적 절제, 항암화학 요법, 방사선 치료, 고용량의 복합항암화학 요법과 자가조혈모세포이식 등이 사용되지만 아직 예후는 불량한 것으로 알려져 있다. 수술적 치료는 대부분의 경우 다발성 부종괴가 산재해 있어 근치 절제는 어려워 종양의 용적축소술이 주로 이루어진다. 최근 적극적인 종양의 용적축소술은 장기간의 생존에 기여할 수 있는 중요한 치료법으로 인식된다[1,8]. 대부분의 환자에서 초기에 병변의 완전 절제가 불가능하기 때문에 다양한 복합항암화학 요법을 받게 된다. 이 중 doxorubicin, vincristine, ifosfamide, cyclophosphamide, etoposide를 이용하는 P6 protocol 방법 또는 이런 항암제를 일부 포함하는 방법이 널리 사용되고 있지만, 아직 장기생존을 기대할 수 있는 표준치료는 없다[9]. 본 증례도 P6 protocol을 이용한 복합항암화학 요법을 실시하였고 이후 장기간의 생존에 기여할 수 있는 용적 축소술을 두 차례 실시하였다. 방사선 치료는 수술이나 복합 항암화학 요법보다는 드물게 사용되는 방법이다. Goodman 등[10]이 전체 복부와 골반 내에 시행한 방사선 치료를 받은 21명을 정리한 보고에 따르면 생존중간 값은 32개월이었고 병의 재발까지 소요된 시간의 중앙값은 19개월이었다. 그런데 방사선 치료를 실시한 대부분의 환자들에서 위장관 독성증상을 보였으며 모든 환자들에서 혈액학적 급성 독성을 보여 치료 선택에 주의가 필요하다. 최근 신보조항암화학요법과 용적축소술에 이어서 수술 중 HIPEC (hyperthermic intraperitoneal chemotherapy)으로 cisplatin을 사용하는 방법이 연구 중에 있으나 이 결과는 향후 지켜봐야겠다[1].
위와 같이 결합조직형성 소원형세포암에 대한 치료방법이 여러 방면에서 시도되고 있지만, 질환이 매우 드물어서 대규모 연구가 시행되기 어려운 실정이다. 최근 이 질환의 인식의 증가와 더불어 보고가 증가하는 추세로 발병원인, 효과적인 치료 방법에 대한 진보가 있기를 기대해 본다.
