만성 실질환 환자에서 허혈성 심질환에 대한 좌심실 이완기능 장애의 영향
Influence of Left Ventricular Diastolic Dysfunction on Ischemic Heart Disease in Patients with Chronic Kidney Disease
Article information
Abstract
목적:
만성 실질환 환자에서 허혈성 심질환은 주된 사망원인으로, 이와 연관된 위험인자를 파악하고 관리하는 것은 중요하다. 허혈성 심질환과 관련된 심장의 구조적인 변화 중 특히 좌심실 이완기능 장애는 최근 발생률이 증가하고 있으며, 예후 또한 불량한 것으로 보고되고 있다. 따라서 본 연구는 만성 실질환 환자를 대상으로 심초음파를 이용하여 좌심실 이완기능 장애를 진단하고, 좌심실 이완기능 장애가 사망률 및 허혈성 심질환의 발생률에 미치는 영향에 대하여 알아보고자 하였다.
방법:
2005년 1월부터 2010년 5월까지 본원에서 심초음파를 시행한 만성 실질환 환자 중, 좌심실 구혈률이 55% 미만, 중등도 이상의 판막질환이 있는 환자와 관찰기간이 6개월 미만인 환자를 제외한 71명의 환자를 대상으로 하였다. 임상적 지표들은 의무기록 조사를 통해 수집하였고, 심초음파 검사, 혈액검사를 후향적으로 분석하였다.
결과:
ROC curve를 이용한 허혈성 심질환과 연관된 좌심실 이완기능 장애의 진단 기준값은 E/E’ = 15.55 (sensitivity: 100%, specificity: 64.7%, p= 0.005), E/A = 0.79 (sensitivity: 84.6%, specificity: 55.9%, p= 0.006)였다. 이 값을 기준으로 E/E` > 15.55, E/A > 0.79인 19명을 좌심실 이완기능 장애가 있는 환자군, Group I으로 지정하였고, 그 외 나머지 환자 52명을 Group II로 나누었다. 심초음파에서 Group I의 E/A, DT, E/E’값은 각각 1.27, 184.21, 19.08이었고 Group II에서는 0.73, 225.19, 13.58이었다(E/A, p< 0.001; DT, p= 0.017; E/E’, p< 0.001). 좌심실 이완기능 장애에 영향을 미치는 인자를 분석하였고 연령, 허혈성 심질환의 병력, 낮은 혈색소 수치, 높은 저밀도 지단백 수치가 관련이 되었다. 또한 허혈성 심질환을 야기시키는 위험인자를 분석하였을 때는 좌심실 이완기능 장애, 흡연, 높은 저밀도 지단백 수치, 높은 부갑상선 호르몬 수치가 상관관계가 있었다. 좌심실 이완기능 장애와 사망률 사이의 연관성을 살펴보면, 전체 사망률은 Group I, II에서 유의한 차이를 보이지 않았지만(p= 0.177), 허혈성 심질환을 나타내는 disease free survival로 비교하면 Group I이 Group II 보다 의미있게 생존율이 감소하였다(p= 0.001).
결론:
만성 신질환 환자에서 좌심실 수축기능이 정상이라도 E/E’ > 15.55, E/A > 0.79인 중등도 좌심실 이완기능 장애를 가진 환자는 허혈성 심질환의 발생률이 높았다.
Trans Abstract
Background/Aims:
Cardiovascular complications are commonly seen in patients with chronic kidney disease (CKD). Recently, theprevalence of left ventricular diastolic dysfunction (LVDD) has increased, and the importance of LVDD has emerged in patientswith CKD. The objectives of this study were to identify diagnostic criteria for LVDD related to ischemic heart disease (IHD) andevaluate the prognostic impact of diastolic dysfunction in patients with CKD.
Methods:
A total of 71 patients with CKD who were evaluated between January 2005 and May 2010 were included in this study.These patients were evaluated by conventional echocardiography and tissue Doppler imaging (TDI) for diastolic dysfunction.
Results:
Diagnostic cutoff values for LVDD related to IHD were E/E’ = 15.55 (sensitivity: 100%, specificity: 64.7%, p= 0.005)and E/A = 0.79 (sensitivity: 84.6%, specificity: 55.9%, p= 0.006). Group I consisted of 19 patients with an E/E’ > 15.55 and E/A >0.79. Group II consisted of the remaining patients. Factors contributing to LVDD were age, history of ischemic heart disease,anemia, and high low-density lipoprotein (LDL) level. Factors contributing to IHD were LVDD, smoking, high LDL level, andhigh parathyroid hormone (PTH) level. The disease-free survival for IHD was significantly lower in group I compared to group II (p= 0.001). However, there was no significant difference in overall survival between groups I and II (p= 0.177).
Conclusions:
Our study showed that moderate LVDD (E/E’ > 15.55 and E/A > 0.79) in patients with CKD is positively associatedwith IHD. (Korean J Med 2012;83:328-336)
서 론
허혈성 심질환은 만성 신질환 환자에서 주된 사망원인으로 잘 알려져 있다[1,2]. 2010년 대한신장학회에서 발간한 신대체 요법의 현황을 살펴보면 혈액투석 환자에서 허혈성 심질환을 포함한 심장 질환의 유병률이 17.1%이고, 심근경색 및 심정지로 인한 사망률이 31.1%로 높은 것으로 보고되고 있으므로[3], 혈액투석 환자에서 허혈성 심질환과 관련된 위험인자를 파악하고 관리하는 것은 중요하다.
만성 신질환 환자에서 허혈성 심질환으로 인한 사망률 증가와 연관된 심장의 구조적인 변화는 좌심실 비대, 좌심실 수축기능 장애 및 이완기능 장애가 있다[4,5]. 과거 좌심실 이완기 심부전 환자는 모든 심부전의 1/3의 비율로 수축기 심부전 환자에 비교하여 빈도가 낮고, 사망률이 낮은 예후가 양호한 질환으로 생각되어 왔으나, 최근 연구에 따르면 모든 심부전의 38-54%로 발생률이 증가하고 있으며, 수축기 심부전과 유사하게 예후가 불량한 것으로 보고되고 있다[6-10].
좌심실 이완기능 장애를 진단하는 방법으로는 심장내 도관을 직접적으로 삽입하여 폐모세혈관 쐐기압 또는 좌심실의 이완말기압 등을 측정하는 방법과 심초음파를 이용한 blood flow doppler와 tissue doppler image (TDI) 등이 있으나 각 문헌마다 진단 지표를 다르게 제시하고 있어 확립된 지침은 없는 상태이다[11,12]. 침습적 도관 삽입은 임상적으로 실행하는데 있어 제한이 많기 때문에 주로 심초음파를 이용한 방법을 사용한다.
본 연구는 만성 신질환 환자에서 좌심실 이완기능 장애와 허혈성 심질환의 연관성을 알아보고, 이를 예측할 수 있는 좌심실 이완기능 장애의 지표값을 알아보고자 하였다.
대상 및 방법
대상
2005년 1월부터 2010년 5월까지 본원에서 혈액투석을 시작한 18세 이상의 환자 중, 최초 혈액투석 전 심초음파를 시행한 82명의 환자를 대상으로 하였다. 이들 중 관찰기간이 6개월 미만인 환자, 심초음파에서 중등도 이상의 판막질환이나 좌심실 구혈률(left ventricular ejection fraction, LVEF)이 55% 미만인 11명의 환자를 제외시켜 최종적으로 총 71명의 환자를 본 연구에 포함시켰다. 제외된 환자 중 좌심실 수축기능 장애 환자는 9명으로 만성 신질환 환자에서 11% (9/82)의 유병률을 보였다. 평균 관찰기간은 37.5개월이었으며 의무기록, 심초음파 검사, 혈액 검사를 후향적으로 분석하였다.
방법
임상자료 수집
허혈성 심질환의 위험인자로 판단되는 임상적 지표들은 의무기록 조사를 통해 수집하였으며, 조사항목으로는 나이, 성별, 체질량 지수, 흡연력, 동반된 질환(당뇨, 고혈압, 악성 종양, 허혈성 심질환)을 포함하였다. 허혈성 심질환으로는 안정형 협심증, 불안정형 협심증, 심근 경색을 포함하였다. 안정형 협심증은 운동에 의해 악화되고 휴식 시 호전되는 허혈성 흉통으로 진단하였고 불안정형 협심증은 휴식 시에도 증상이 지속되는 허혈성 흉통으로 진단하였으며 심근 경색은 허혈성 흉통이나 전형적인 심전도 소견에 심근효소 수치의 상승으로 진단하였다[13].
심초음파 검사
경흉부 심초음파 검사를 시행하였고 M-mode에서 이완기말과 수축기말 좌심실 용적, 좌심실 구혈률, 좌심방 직경, 좌심실의 이완기말과 수축기말 내경을 구하였으며, 이완기말 심실 중격과 좌심실 후벽의 두께를 측정하였다. 좌심실 이완기능 지표는 심첨4방도에서 승모판의 첨부에서 간헐파형 도플러를 이용하여 초기 이완기 경승모판 최대 혈류속도(peak early diastolic transmitral inflow velocity, E), 후기 이완기 경승모판 최대 혈류속도(peak late diastolic transmitra linflow velocity, A) 및 이들의 비(E/A ratio)를 구하였고, 초기 이완기 최대 혈류의 감속시간(deceleration time, DT)을 구하였다. 동일한 심초음파 기기에서 TDI 기능을 작동시켜 초기 이완기 승모판륜의 최대 운동속도(early diastolic peak mitral annular velocity, E’)의 파형을 구하여 초기 이완기 승모판 최대 혈류 속도와의 비(E/E’)를 구하였다.
혈액 검사
혈색소, 혈청 크레아티닌, 혈액요소질소, 총칼슘, 인, 고밀도 지단백, 저밀도 지단백, 알부민, 부갑상선호르몬(intact parathyroid hormone, iPTH), HCO3, C-reactive protein (CRP)을 포함하였다. 또한 신장기능은 MDRD 공식에 따른 추정 사구체 여과율(estimated GFR, eGFR) [14]로 나타내었다.
통계
연속변수는 평균 ± 표준편차로, 비 연속 변수는 수(백분율 %)로 표시하였고 연속변수 평균값을 비교하기 위하여 양측검증 student t-test를 시행하였으며, 비 연속 변수를 비교하기 위해서는 Chi-square test를 시행하였다. 좌심실 이완기능 장애를 나타내는 지표값을 찾기 위해 Receiver operating characteristic (ROC) curve를 사용하였고, 좌심실 이완기능 장애에 영향을 줄 수 있는 인자를 찾기 위해 binary logistic regression을 이용하였다. 또한 허혈성 심질환의 위험인자를 규명하기 위해 COX 회귀분석을 사용하였고, 생존율 분석을 위해서 Kaplan Meier 생존곡선을 이용하였다. 모든 통계자료 분석은 SPSS 통계 프로그램 윈도우용 15.0판(Statistical Package for the Social Sciences, version 15.0)을 이용하여 수행하였고 p 값이 0.05 미만인 경우 통계학적으로 의미 있는 것으로 간주하였다.
결 과
좌심실 이완기능 장애의 지표값
허혈성 심질환 발생률, 허혈성 심질환과 연관된 사망률, 총 사망률을 예측할 수 있는 좌심실 이완기능 장애의 지표값을 찾기 위해 E/E’, E/A, DT 값을 이용하여 ROC curve를 그렸다. 허혈성 심질환의 발생률을 예측할 수 있는 E/E’, E/A의 진단기준 값(cut off value)은 각각 15.55 (sensitivity: 100%, specificity: 64.7%, p= 0.005)와 0.79 (sensitivity: 84.6%, specificity: 55.9%, p= 0.006)였으나 DT는 유의한 연관성을 보이지 않았다(p= 0.062) (Fig. 1). 허혈성 심질환과 연관된 사망률, 총 사망률은 E/E’, E/A, DT 값을 이용하여 그린 모든 ROC curve에서 통계학적 유의성이 없었다.
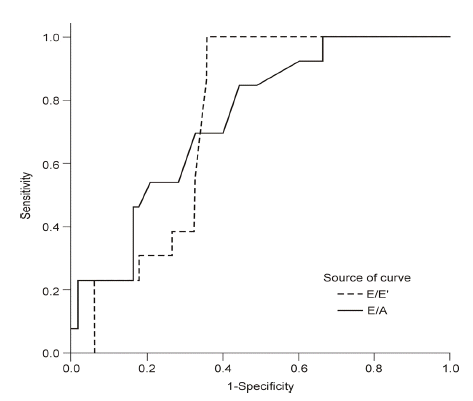
A receiver operating characteristic (ROC) curve analysis was used to identify left ventricular diastolic dysfunction (LVDD) relating to ischemic heart disease (IHD). The best cutoff value for E/E’ (dashed line) was 15.55; sensitivity and specificity rates were 100% and 64.7%, respectively. The area under the curve was 0.744 ± 0.055 (p = 0.005). For E/A (solid line), the best cutoff value was 0.79, with sensitivity and specificity rates of 84.6% and 55.9%. The area under the curve was 0.742 ± 0.066 (p = 0.006).
대상 환자들의 임상적 특성
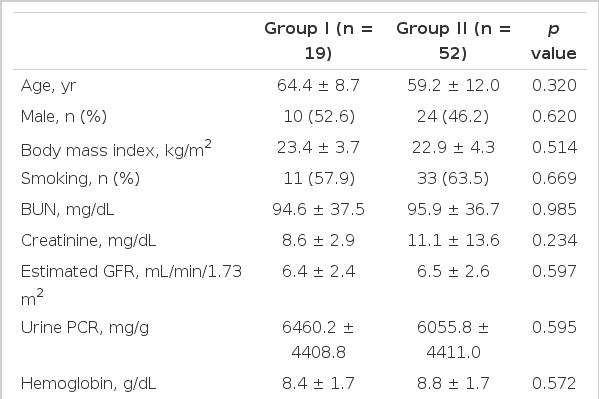
허혈성 심질환 발생률을 예측할 수 있는 E/E’, E/A의 진단기준 값(cut off value)을 기준으로 전체 71명의 환자를 분류하였다. Group I은 진단기준 값을 모두 만족하는 군으로 총 19명이었고, 그 외 나머지 환자 52명을 Group II로 나누었다. 당뇨병은 group I에서 빈도가 높았으나 그 외 나이, 성별, 고혈압, 허혈성 심질환의 병력 및 혈액 검사 결과는 두 군 간의 유의한 차이를 보이지 않았다(Table 1).
심초음파 비교
심초음파 시행 당시 두 군에서 혈압, 맥박수의 차이는 보이지 않았고, Group I에서의 E/A, DT, E/E’의 값은 각각 1.27, 184.21 msec, 19.08이었고, Group II에서는 0.73, 225.19 msec, 13.58이었다(E/A, p< 0.001; DT, p= 0.017; E/E’, p< 0.001). Group I은 좌심실 이완기 및 수축기 직경이 각각 55.82 mm, 36.01 mm였고, Group II는 49.94 mm, 30.04 mm로 Group I이 Group II에 비교하여 좌심실 직경이 컸다(LV diatolic diameter, p= 0.001; LV systolic diameter, p= 0.001). 그 외 양 군 간에 좌심방/좌심실 직경, 좌심실벽 두께 및 좌심실 구혈률의 차이는 없었다(Table 2).
좌심실 이완기능 장애에 영향을 미치는 인자
만성 신질환 환자에서 좌심실 이완기능 장애에 영향을 미치는 인자를 분석하였고, 연령, 허혈성 심질환의 병력, 낮은 혈색소 수치, 높은 저밀도 지단백 수치가 좌심실 이완기능 장애에 영향을 줄 수 있는 인자로 확인되었다(Table 3).
허혈성 심질환의 발생률
허혈성 심질환의 발생률은 Group I에서는 불안정형 협심증 3명, 심근 경색 7명으로 총 10명(52.6%)이 발생하였고, Group II는 불안정형 협심증 1명, 심근 경색 1명으로 총 2명(3.8%)이 발생하였다(p< 0.001). Group I, II 모두에서 안정형 협심증은 없었다.
허혈성 심질환을 야기시키는 위험인자
허혈성 심질환에 대한 좌심실 이완기능 장애의 독립적인 위험도를 알아보기 위해 나이, 성별, 허혈성 심질환의 위험인자로 알려진 동반 질환 및 혈액 검사 결과를 포함하여 비교위험도를 분석하였다. 좌심실 이완기능 장애가 허혈성 심질환과 양의 상관관계가 있었고(HR = 2.618, 95% CI: 1.131-6.060, p= 0.025), 그 외 흡연, 높은 저밀도 지단백(LDL) 수치, 높은 부갑상선 호르몬(iPTH) 수치도 상관관계가 있었다(Table 4).
좌심실 이완기능 장애에 따른 예후의 차이
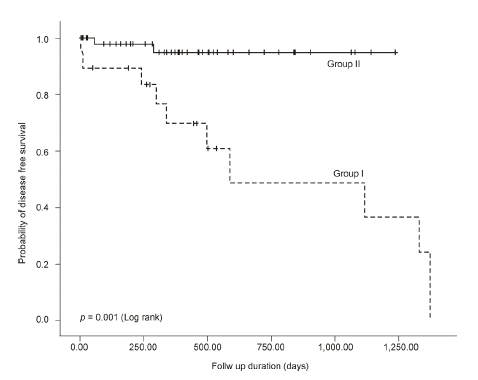
Group I에서는 심근경색으로 3명, 감염성 질환으로 1명, 악성종양으로 1명이 사망하였고, Group II에서는 심근경색으로 1명, 감염성 질환으로 3명, 뇌출혈으로 1명이 사망하였다. 좌심실 이완기능 장애와 사망률 사이의 연관성을 살펴보면, 전체 사망률은 Group I, II에서 통계학적으로 유의한 차이를 보이지 않았다(p= 0.177). 하지만 허혈성 심질환을 나타내는 disease free survival로 양 군을 비교하였을 때는 Group I이 Group II보다 의미 있게 생존율이 감소하였다(p= 0.001) (Fig. 2).
고 찰
좌심실 이완기능 장애를 측정하기 위한 방법으로 고식적인 심초음파(conventional echocardiography)를 많이 사용하였으나, 최근 TDI가 고식적인 심초음파보다 좌심실 이완기능 장애를 진단하는 데 더 정확하다는 연구가 보고되고 있다[15]. 특히 E/A, DT 등을 측정하는 고식적 방법의 경우 초기 좌심실 이완기능 장애를 진단하는 데 많은 제한점을 보이고 있다. 따라서 본 연구는 정확한 좌심실 이완기능 장애를 찾기 위하여 E/A, DT값뿐만 아니라 TDI를 이용한 E/E`값도 이용하였다. 하지만 좌심실 이완기능 장애를 나타내는 지표값은 문헌마다 다르게 보고하고 있어[11,12] 본 연구에서는 만성 신질환 환자에서 허혈성 심질환의 위험도를 예측할 수 있는 좌심실 이완기능 장애의 기준값을 직접 찾기 위하여 ROC curve를 이용하였다. 도출된 E/E’ > 15.55, E/A > 0.79의 값을 기준으로 좌심실 이완기능 장애의 유무을 분류하였을 경우 만성 실질환 환자에서 좌심실 이완기능 장애가 허혈성 심질환의 발생률과 관련성이 있다는 것을 증명하였고, 좌심실 이완기 기능장애의 유병률(23%, 19/82)이 좌심실 수축기능 장애의 유병률(11%, 9/82)보다 높았다. 좌심실 이완기능 장애의 중증도를 분류하는 문헌에 따르면 E/E’ > 15, E/A > 0.79의 값을 모두 만족하는 경우 좌심실의 유순도 저하, 좌심방압 상승이 동반된 중등도 이상의 좌심실 이완기능 장애에 해당되며[16], 이는 이미 중등도의 좌심실 이완기능 장애를 가진 만성 신질환 환자는 향후 허혈성 심질환의 위험도가 높음을 의미한다. 특히 만성 신질환 환자에서 E/E’ > 15과 허혈성 심질환이 포함된 심혈관 질환 및 전체 사망률과의 높은 연관성은 여러 문헌에서 보고하였는데[17,18], 본 연구에서는 전체 사망률과는 유의한 연관성이 없었지만 허혈성 심질환과의 연관성은 유사한 결과가 도출되었다. 또한 E/A만 기준으로 할 경우 0.75 < E/A < 1.5에서 정상이완 기능과 가정상(pseudonormal) 상태의 이완기능 장애를 구분하지 못하여 좌심실 이완기능 장애를 제대로 진단하지 못하는 경우가 생길 수 있으므로[16], 만성 신질환 환자에서 심초음파를 시행할 때 심장의 국소적 벽운동 장애 및 좌심실 수축기능 정도를 평가할 뿐 아니라 좌심실 이완기능의 평가를 위해 TDI를 함께 시행하는 것이 필요하겠다.
일반적으로 좌심실 이완기능 장애를 유발하는 주된 병태 생리에는 관상동맥 질환에 의한 심근허혈, 고혈압에 의한 지속적인 좌심실의 압력부하로 인한 좌심실의 비후, 대동맥 협착증 및 비후성 심근병증이 있다[19-21]. 또한 당뇨병 환자에서는 고혈당과 인슐린 저항성으로 인해 심근 섬유화 및 좌심실의 경직성이 증가되어 좌심실 이완기능 장애가 발생하는데, 심부전 증상이 없는 당뇨병 환자에서도 유병률이 60%까지 보고될 만큼 유병률이 높다[22,23]. 노인에서는 좌심실 경직도 증가, 좌심실 이완기간이 증가 및 이로 인한 좌심실 확장기말 압력이 증가되어 좌심실 이완기능 장애가 흔하게 나타난다[24].
만성 신질환 환자에서는 일반적으로 고혈압, 당뇨병의 유병률이 높고 대부분 고령으로 좌심실 이완기능 장애에 대한 다수의 위험인자를 가지게 되는 경우가 많다. 한 연구에 따르면, 만성 신질환 환자에서 평균혈압이 10 mmHg 증가할 때, 좌심실 이완기능 장애의 위험이 44% 증가한다는 보고가있다[25]. 만성 신질환 환자에서 나타나는 부갑상선 기능항진증도 좌심실 이완기능 장애의 병태생리와 관련이 있는 것으로 밝혀져 그 위험도는 더 증가하게 된다[26]. 만성 신질환 환자에서 이차성 부갑상선 기능 항진증으로 인한 부갑상선 호르몬의 증가는 심근세포 내의 칼슘농도를 증가시키게 되고, 이로 인하여 심근세포의 괴사가 촉진되며 섬유모세포의 증식이 유발된다. 섬유모세포의 증식은 심근 섬유화를 유발하여 좌심실 이완기능 장애가 나타난다[27]. 한 보고에서는 만성 신질환 환자에서 이차성 부갑상선 기능 항진증에 대한 약물 치료로 이완 기능장애가 호전되었다고 보고하였고[28], 일차성 부갑상선 기능 항진증 환자에서 부갑상선 절제술 후 좌심실 이완기능 장애의 호전을 보인 경우도 있다[29]. 또한 만성 신질환 환자에서 흔한 빈혈도 그에 대한 보상기전으로 심장 박동과 심박출량을 증가시키고, 심장의 확장 및 좌심실 비대를 유발하여 좌심실 이완기능 장애를 유발할 수 있는 중요한 원인인자이다. 본 연구에서는 고혈압, 당뇨병 및 이차성 부갑상선 기능 항진증과 좌심실 이완기능 장애와의 연관성은 밝히지 못하였으나 고령, 허혈성 심질환의 병력, 낮은 혈색소 수치와 높은 저밀도 지단백 수치가 좌심실 이완기능 장애와 연관이 있는 것으로 확인되었다.
만성 신질환 환자에서 허혈성 심질환의 위험인자로는 고혈압, 당뇨병, 흡연, 고지혈증, 신체적 비활동, 나트륨저류, 수분저류, 빈혈, 부갑상선 기능 항진증 등이 잘 알려져 있고, 이 중 요독증(uremia)과 관련된 위험인자는 나트륨저류, 수분저류, 빈혈, 부갑상선 기능 항진증 등이 있다[30]. 이러한 위험인자들은 허혈성 심질환의 위험인자에 앞서 좌심실 이완기능 장애와 연관이 있을 수 있기 때문에 본 연구에서는 좌심실 이완기능 자체가 허혈성 심질환에 미치는 독립적인 영향을 알아보기 위해 성별, 고령, 당뇨병, 고혈압, 허혈성 심질환의 병력 및 혈색소, 신장 기능, 부갑상선 호르몬 수치, CRP, 저밀도 지단백 수치를 보정하였고, 흡연, 좌심실 이완 기능 장애, 부갑상선 호르몬의 증가와 저밀도 지단백의 증가가 허혈성 심질환과 유의한 연관성을 가졌다.
만성 실질환 환자에서 좌심실 이완기능 장애와 예후와의 직접적인 관련성에 대한 보고는 흔하지 않으나 최근 한 보고에 따르면[17], 220명의 만성 신질환 환자를 대상으로 E/E’ > 15이 전체 사망률과 심혈관계 질환으로 인한 사망률을 예측할 수 있다고 보고하였다. 본 연구에서도 이와 유사하게 E/E’ > 15.55, E/A > 0.79인 좌심실 이완기능 장애가 있을 때 허혈성 심질환의 발생률이 높았으나, 허혈성 심질환으로 인한 사망률 및 전체적인 사망률과는 유의한 관련성을 보이지 않았다.
본 연구의 가장 큰 제한점은 혈액투석 이후의 심초음파 소견이 없어서 혈액투석에 따른 좌심실 이완기능의 변화를 분석하지 못한 점이다. 단회의 혈액투석 및 장기적인 혈액투석으로 인한 좌심실 이완기능의 변화는 문헌에 따라 다양한 결과를 보고하고 있어 혈액투석이 좌심실 이완기능에 미치는 영향은 아직까지 확립되어 있지 않았으며[5,31-35], 동정맥루의 상태, 수분저류의 정도, 혈액투석 중 발생할 수 있는 교감신경 과항진, 이온화 칼슘의 변화 및 증가된 산화스트레스 등이 좌심실 이완기능에 영향을 줄 수 있다[36]. 또한 전체 대상 환자의 수가 적었고, 좌심실 이완기능 장애의 진단 기준을 결정할 때 E/E’ > 15.55, E/A > 0.79에 대한 특이도가 각각 64.7%, 55.9%로 낮았으나, 두 가지 기준 모두를 만족하는 것으로 설정함에 따라 낮은 진단 특이도를 보완하였다.
결론적으로 만성 신질환 환자에서 좌심실 수축기능이 정상이라도 E/E’ > 15.55, E/A > 0.79인 중등도 좌심실 이완기능 장애를 가진 환자는 허혈성 심질환의 발생률이 높았고, 고령, 허혈성 심질환의 과거력, 빈혈, 높은 저밀도 지단백 수치가 좌심실 이완기능 장애와 관령성이 있었다. 따라서 임상에서 호흡곤란, 부종, 피로감과 같은 뚜렷한 심부전의 증상이 없는 만성 신질환 환자에서 심초음파를 시행할 때 심장의 국소적 벽운동 장애 및 좌심실 수축기능 정도를 평가할 뿐 아니라 TDI를 함께 시행하여 좌심실 이완기능 평가에도 관심을 두어야 할 것이며, 중등도의 좌심실 이완기능 장애를 보이는 환자들은 허혈성 심질환의 위험군으로서의 관리에 더 주의를 두어야 할 것이다.