대장암의 보조항암화학요법
Adjuvant Chemotherapy in Colon Cancer
Article information
Trans Abstract
Colorectal cancer represents a major public health problem in worldwide including Korea. According to the National Cancer Registry, colon cancer is the third most common cancer and the forth leading cause of cancer death. The surgery is a main treatment option for cure. Despite curative surgery in those presenting early, the risk of relapse is significantly high. To improve the survival, huge advances have been made in the treatment of colon cancer over the last decade. Especially, the median overall survival time for stage IV colon cancer has been reached from 6-9 months to over 20 months. Based on these results, drugs such as irinotecan, oxaliplatin and oral fluoropyrimidine have been used to evaluate the efficacy in adjuvant setting. Oxaliplatin based chemotherapy is now emerging as the standard of care in adjuvant treatment of stage III colon cancer. Targeted agents, which have shown promise in the metastatic setting, are currently being examined in the adjuvant setting, although results have been disappointing until now. Even though adjuvant treatment is recommended for ‘high risk’ stage II, the endeavor to answer for question-who should be treated by what-is needed. (Korean J Med 2012;83:297-304)
서 론
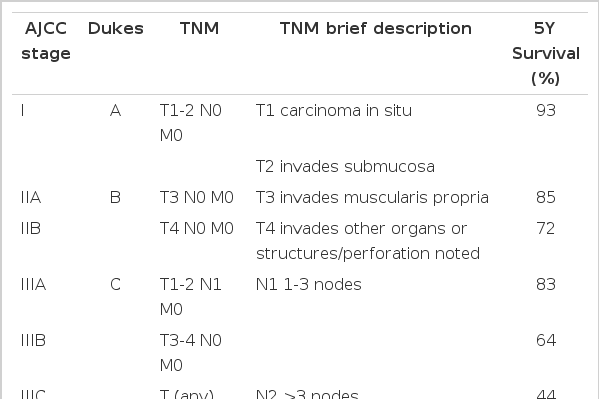
2009년 발표된 한국중앙암등록본부 자료에 다르면 대장암은 우리나라에서 발생하는 암 중 갑상선, 위암 다음으로 세 번째 흔한 암과 동시에 네 번째의 사망률을 보이고 있는 질환으로 매년 발병률이 증가되고 있다. 수술적 완전절제술이 대장암의 가장 중요한 치료로 그 역할에는 변함이 없으나 육안적으로 완전한 절제가 가능하더라고 미세 잔존 종양이 남아 있는 경우가 있어서 추가 항암요법을 수술 후에 시행하는 경우가 많다. 특히, 국소 진행형(locally advanced)으로 진단된 III기 대장암을 수술 단독으로 치료한다면 5년 생존율이 15-50%로[1]로 보고되고 있으나, 재발율을 낮추고자 하는 지속적인 노력의 결과 상당한 생존율의 향상을 가져왔다(Table 1). 1990년부터 진행된 수술 후 보조요법에 대한 대규모 임상시험 결과, 5-fluorouracil (5-FU)을 근간으로 하는 수술 후 보조항암화학요법이 III기 대장암 환자에서 수술 단독군에 비해 26%의 사망률을 감소시킨다는 보고를 시작으로 [1,2] 6개월 간의 5-FU와 leucovorin (LV) 병합요법은 수술 후 보조항암화학요법으로 표준치료가 되어 왔다. 이후 2000년도에 들어서면서 전이성 대장암에 유효성이 입증된 oxaliplatin, irinotecan 그리고 일부 표적치료제가 수술 후 보조요법으로서의 역할을 규명하고자 하는 연구 결과가 단기, 그리고 장기적인 추적관찰을 통해 보고되었다. 수술 후 보조요법의 역할은 재발률을 낮추는 것이 가장 중요하겠지만 불필요한 독성을 피하기 위해서는 적절한 환자를 선택하여 최적의 기간을 설정하여 시행하는 것이 완화적 항암화학요법과 다른 점이라 할 수 있다. 따라서 최근 보고된 결과를 바탕으로 하여 병기 및 병용 약제 따른 보조항암화학요법의 유효성을 살펴보고자 한다.
대장암 III기의 보조항암화학요법
현재까지 보고된 발표에 따르면 대장암 III기에서의 수술 후 보조항암요법의 유효성은 여러 차례 대규모 임상시험을 통해 입증되어 표준요법으로 권고되고 있으나, 병합약제에 따른 효과 및 독성이 다르므로 환자의 상태에 맞추어서 선택하는 것이 중요하다.
secBolus 5-FU/leucovorin (LV)
NSABP-C01 (National Surgical Adjuvant Breast and Bowel Project)의 10년 추적관찰 결과 수술 후 단독 요법에 비해 5-FU/LV을 투여한 경우 무병생존율(disease free survival, DFS)이 16% 감소되고 생존율(overall survival, OS)이 18% 감소됨을 보고한 이후 보조요법으로 5-FU/LV이 근간을 이루었다[3]. 이러한 결과는 유럽에서도 입증이 되어 이를 종합해보면 i) 5-FU/low dose LV (20 mg/m2)은 5-FU/high dose LV (200-500 mg/m2)과 비슷한 효과를 보이고 ii) 5-FU/LV 6개월 투여와 12개월 투여 간의 차이는 없었으며 iii) Mayo clinic 용법(5-FU 425 mg/m2 and LV 20 mg/m2 days 1-5 every 4 weeks for 6 cycles)과 Roswell Park 용법(5-FU 500 mg/m2 and LV 500 mg/m2 weekly × 6 every 8 weeks for 3 to 4 cycles)의 효과는 비슷하였음을 알 수 있었다[4-8].
Continuous infusion of 5-FU
Bolus 5-FU에 비하여 continuous 5-FU는 독성면에서 우월하면서, 전이성 대장암 환자를 대상으로 한 임상시험에서 생존율의 향상을 보여 이를 보조요법에서도 적용하였다. GERCOR, Intergroup 0153, SAFFA의 대규모 3상 임상시험이 진행되었으며, 그 결과 효과는 비슷하였으나 독성면에서 설사, 구내염, 호중구 감소증이 continuous 5-FU군에서 유의하게 낮게 발현되어 현재 continuous 정주법이 널리 사용되고있다[9-11]. 다만 지속 정주를 위해서는 항암제 주입구나 펌프로 인한 불편감이 있어 독성을 고려하고 환자 요구에 맞게 적용할 수 있겠다.
Capecitabine
Capecitabine은 체내의 종양으로 흡수되면 활성화된 5-FU로 변환되는 효과를 보이는 경구형 5-FU전구약제이다. 진행성 대장암에서 경구 capecitabine은 독성이 적으면서 5-FU/LV정맥 주사와 비슷한 효과를 보이고, 지속정주로 인한 불편감 및 독성을 감소시키는 결과가 발표된 이후 보조요법에 도입되었다[12]. X-ACT임상시험에서 III기 대장암의 보조요법으로 capecitabine이 5-FU/LV에 비해서 독성은 적으면서 무재발 생존기간이 동등함이 입증되어 현재 널리 사용 중이다(HR: 0.86; 95% CI: 0.74-0.99; p= 0.04) [13].
Oxaliplatin 병합요법
Oxaliplatin은 다음과 같은 세 가지 대규모 임상시험을 통해 현재 보조항암요법의 표준치료로 자리매김을 하게 되었다(Table 2). 유럽에서 시행된 MOSAIC (5FU/LV vs. oxaliplatin/infusional 5-FU [FOLFOX4]) 임상시험은 처음으로 oxaliplatin 추가가 기존 5-FU/LV 요법에 비해 유효함을 입증한 임상시험으로, 5년 DFS이 5-FU/LV (67%)에 비해 oxaliplatin 병용시 우월하고(73%, p= 0.003), 또한 6년 OS이 5-FU/LV에서 76%, oxaliplatin 병합 시 78% (p= 0.046)로 의미 있는 연장을 보여 현재까지 표준치료로 인정되고 있다[14]. 비슷한 시기에 미국에서 진행된 NSABP C-07에서는 bolus 5-FU/LV요법을 근간으로 하여 oxaliplatin병합한 군과의 비교를 통해 유용성을 재입증하고자 하였다. MOSAIC와는 달리 5년 생존율에서는 유의한 결과를 보이지는 못하였으나(5-FU/LV 78% vs. 5-FU/LV/Oxalipatin 80%, p= 0.08), 5년 DFS에서는 유용성이 입증되어(5-FU/LV 64% vs. 5-FU/LV/Oxalipatin 69%, p= 0.002)수술 후 보조요법으로서의 역할을 재확인하였다[15]. 이어서 5-FU의 주사방법을 좀 더 편리하게 하기 위한 노력은 보조요법에서도 진행되어 5-FU 대신 경구 capecitabine로 진행한 임상시험이 NO 16968 (FOLFOX vs. XELOX)에서 시행되었다[16]. 최근 발표된 7년 추적관찰 보고에 따르면 DFS와 OS 모두 유의한 증가를 보여[17] 이 세 임상시험을 통해 oxalipaltin의 병합요법은 III기 대장암에서 표준치료로 정립되었다. 그러나 보조항암요법 후 대두된 문제점 중의 하나는 oxaliplatin에 기인한 신경학적 독성으로 12회의 FOLFOX 치료 종결 후 3등급 이상의 신경학적 독성이 12.4% 발현되었다. 그러나 1년 추적검사 후 3등급 이상의 지속적인 신경학적 독성을 호소하는 환자는 1.1%로 감소되어 대부분이 호전되었을 것으로 판단되지만, 장기 추적결과 항암투여가 종결된 4년 후에도 증상은 경미하나 15.5%에서는 남아 있어, oxaliplatin병용요법을 한 경우 보조항암제 사용의 적절한 기간에 대한 재평가가 요구되고 있다[18]. 또한 NSABP C07에서는 나이에 따른 oxaliplatin 병용요법의 유효성에 대한 분석을 시행하였는데, 70세 이상인 환자에서는 설사, 오심 및 구토 등의 부작용이 보다 빈번히 발생하였고, 70세 미만에서는 DFS (HR = 0.76, 95% CI 0.66-0.88, p< 0.001)과 OS (HR = 0.080, 95% CI 0.68-0.95, p= 0.013)의 유효성이 입증된 반면, 70세 이상인 군에서는 의미 있는 결과를 보이지 않아, 고령 환자에서 oxaliplatin 병용요법에 대해 재고해 볼 여지를 남겼다[19].
Irinotecan 병합요법
전이성 대장암에서 irinotecan은 FOLFIRI요법으로 유효성이 입증되어 널리 사용되는 반면, 보조항암요법에서의 역할은 PETACC-3, CALGB, ACCORD 등 대규모 임상시험에서 기존 5-FU/LV에 비해 더 나은 성적을 보고하지 못할 뿐만 아니라 오히려 독성 면에서 좋지 않는 결과를 보여 irinotecan은 아직까지 임상시험 내에서만 시행될 뿐 실제 임상에서 적용은 권고되지 않고 있다[20-22] (Table 2).
Biologic agent의 추가 요법
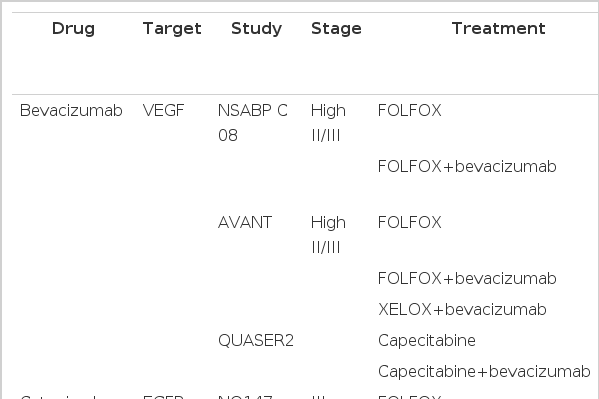
Bevacizumab
최초로 bevacizumab을 보조요법에 추가한 임상시험은 FOLFOX6를 근간으로 진행되었던 NSABP C08으로 6개월간의 FOLFOX6 단독군과 6개월 FOLFOX6에 12개월의 bevacizumab (5 mg/kg)을 병행하여 치료한 군을 비교한 대규모 임상시험이었다[23]. 그 결과 일차목표였던 3Y DFS이 bevacizumab을 병용한 경우(77.4%) FOLFOX6 단독군(75.5%)에 비해 유의한 연장을 보이지 못했다(p= 0.15). 그러나 이어서 진행된 탐색적 분석에서 치료 시작 15개월을 전후로 bevacizumab이 DFS에 미치는 영향이 다름을 알 수 있었는데, 치료 시작 후 첫 15개월 동안은 bevacizumab을 추가한 경우 의미 있는 DFS의 연장을 볼 수 있었으나(p< 0.0001) 그 이후부터는 이러한 의미가 소실됨을 알 수 있었다(p= 0.076). 즉, bevacizumab이 투여된 기간 동안에는 효과가 있지만 중단 후에는 상쇄되는 것으로, 비록 이 임상시험에서 bevacizumab의 보조요법으로써의 유효성은 평가 받지 못하였지만 기존의 단기간 보조항암요법으로 장기간의 생존율 향상을 보여주었던 세포독성 항암제와는 달리 표적치료제의 경우 보다 장기간의 투여가 고려되고, 이러한 차이가 세포독성 항암제와 다른기전에 바탕을 두고 있음을 시사하는 바로 생각된다. 이후에 시행된 AVANT study에서는 FOLFOX뿐만 아니라 XELOX에 bevacizumab을 병행하는 요법의 임상시험이 진행되었는데, 이 또한 유의한 DFS의 연장은 보이지 않았고, 오히려 항암제 단독으로 시행한 군에서 통계적 의미는 없으나 오히려 나은 DFS를 보여 현재까지 bevacizumab은 대장암 보조요법으로 인정받지는 못하였다[24] (Table 3).
Cetuximab
FOLFOX를 근간으로 하여 cetuximab을 병용한 임상시험(NO147)이 2010년에 발표되었는데, KRAS wild type을 가진 환자를 대상으로 시행하였음에도 불구하고 추적기간 15.9개월에 중간분석을 시행한 결과 FOLFOX 단독군이 통계적 유의성은 없으나 오히려 나은 3Y DFS을 보여 조기 종료되었다[25]. 이는 전이성 대장암 환자에서 cetuximab에 효과를 보였던 KRAS wild type 환자만을 선별하여 시행했음에도 불구하고 실망스러운 결과를 보여 많은 연구자들이 전이성 대장암과 수술 후 미세전이 상태에서의 표적치료제 역할의 차이에 대한 연구를 진행하고 있다.
고령 환자에서의 보조항암화학요법(70세 이상)
노령인구가 증가함에 따라 최근에는 대장암으로 진단된 환자의 중앙 나이가 72세로 대부분이 고령 환자라해도 과언이 아니다. 이러한 고령 환자를 일반적인 환자와 동일하게 치료를 진행하는 것에 문제가 없겠는가 하는 의문은 지속되었으나 실질적으로 고령 환자만을 대상으로 임상시험을 진행하는 것은 안전성이나 효율성 면에 있어서 쉽지 않는 일이다. 따라서 이에 대한 해답을 찾고자 대규모 임상시험에서 고령 환자에 대한 유효성을 평가하는 후향적 분석이 주로 진행되어 왔다. 2001년 Sargent 등[26]은 수술 단독요법과 수술 후 5-FU/LV 또는 levamisole을 수술 후 보조요법으로 사용했던 7개 임상시험의 3,000명 환자를 분석한 결과, 보조항암요법의 의미 있는 생존율 상승은 나이와 무관하게 관찰되었고, 하나의 임상시험을 제외한 나머지에서 독성 또한 70세 이상인 군에서 높지 않아 고령 환자에서 5-FU/LV의 유효성 및 안전성은 입증되어 표준요법으로서의 역할을 제시하였고, 이러한 결과는 SEER (National Cancer Institutes’s Surveillance, Epidemiology, and End Results program and Medicare) 연구에서도 재확인되었다[27]. 그러나 NSABP C07을 장기 추적한 결과 70세 미만인 군에서는 5-FU/LV요법에 비해 oxaliplatin을 추가한 경우 DFS와 OS가 의미 있는 연장을 보였지만 70세 이상인 군에서는 유효성을 보이지 않았고, NO147 또한 FOLFOX 표준요법에 cetuximab을 추가한 경우 오히려 고령환자에서 통계적으로 유의하게 DFS이 낮음을 알 수 있었다 [19,25]. 하지만 여기서 주의할 점 중의 하나는 대부분 임상시험에서의 중앙 나이는 60-65세로, 임상에서 접하는 중앙 나이와 차이가 있으며, 임상시험에 등록된 환자 중 70세 이상인 경우가 약 10-20%만 차지하고 있어 이러한 임상결과를 모든 고령 환자의 결과로 단정하기에는 무리가 있다. 최근 Sanoff 등[28]은 여러 의료기록을 토대로 75세 이상 5,489명의 환자를 대상으로 III기 대장암 환자의 보조요법에 따른 생존을 분석하였는데, 일부에서는 oxaliplatin 병합요법이 non-oxaliplatin 요법에 비해 기존의 발표와 비슷한 정도의 생존율 상승이 관찰되기도 하나, 통계적으로 유의성 또는 일치성이 명료하지 않아 여러 요인이 관련되어 있을 것으로 해석된다. 결론적으로 고령 환자 중 전신상태가 매우 좋은 경우에는 oxaliplatin 병용요법이 추천될 수 있으나, 평균 수명을 고려하여 기대되는 여명이 길지 않거나 전신상태가 충분히 좋지 않는다면 5-FU/LV 또는 경구 capecitabine을 사용하는 것이 안전할 것으로 생각된다.
대장암 II기의 보조항암화학요법
일반적으로 대장암 II기의 고위험군은 다음 중 하나라도 있는 경우를 정의한다. 즉, 수술 시 채취된 림프절이 12개 미만, poorly differentiated tumor, vascular, lymphatic 또는 perineural invasion, 진단 시 장폐색 또는 장천공이 된 경우, pT4 병기인데, 대규모 임상시험을 통해 보조항암요법의 유효성을 입증하기 위해 노력을 하고 있으나 아직 명료하지는 않다. 그러나 미국임상암학회(American Society of Clinical Oncology, ASCO) 및 National Comprehensive Cancer Network (NCCN) 가이드라인에서는 비록 크진 않지만 재발률(20-30%)에 대한 잠재적인 이득에 대한 정보를 환자와 공유한 후 보조요법을 진행할 수 있음을 설명하고 있다.
대장암 IV기의 보조항암화학요법
과거에 IV기로 진단받은 대장암 환자들은 생존율이 약 5% 정도 밖에 되지 않는 완화적 항암치료에만 의존해야 했다. 그러나 최근에는 절제 가능한 간 전이성 병변을 가진 환자를 대상으로 수술 전 항암치료(preoperative chemotherapy)후 수술 및 보조항암요법을 시행하여 수술 단독군과 비교한 결과 재발률의 유의한 감소를 보였고, 그 외에도 절제 불가능한 병변을 수술 전 항암치료를 통해 절제 가능한 병변(conversional chemotherapy)으로 변환시킨 후 수술을 진행하는 등 이러한 노력으로 5년 생존율을 50%까지 올릴 수 있게 되었다[29,30]. 또한 폐 단독으로 전이가 있어 완전 절제가 가능한 경우에도 5년 생존율이 20-50%로 보고되고 있어[31], 단일 장기에 국한된 전이성 IV기 환자의 경우 표적치료제를 포함한 적극적인 항암치료 후 수술을 시행하는 것은 완치를 기대할 수 있는 새로운 방법이 될 수 있겠다.
보조항암화학요법의 적정기간
Intergroup 0089에서 5 FU/LV의 6개월 보조요법이 12개월 보다 적은 독성과 나은 생존율 향상을 보고한 이래로 현재까지 6개월이 표준요법으로 사용되고 있다[32]. 그러나 oxalipaltin의 병용요법이 진행되면서 경미하나 일부에서 발생하는 비가역적 신경학적 독성에 대한 우려가 나오면서 보조항암화학요법의 적정기간에 대한 관심이 다시 높아지고 있다. 보다 짧은 기간의 보조항암요법에 대한 근거로는 Chau 등[9]이 시행한 무작위 임상시험에서 6개월간의 bolus 5-FU/LV (Mayo regimen)과 12주간의 지속정주 5-FU요법을 시행한 결과 5년 무재발기간(66.7% vs. 73.3%, p= 0.10) 및 5년 생존율 (71.5% vs. 75.7%, p= 0.083)에 차이가 없음을 발표하였다. 또한 본 연구에서는 수술 후 8주 이내에 보조항암요법이 시행된 경우 의미 있는 생존율 향상을 볼 수 있어, 수술 후 6-8주 이내에 보조항암요법 시행을 권고하고 있다. 또한 아직까지는 6개월의 항암투여기간을 표준으로 제시하고 있으나 현재 진행되고 있는 oxaliplatin 병용요법의 3개월과 6개월 요법의 비교 임상연구 결과가 나오게 되면 보다 구체적인 답을 얻을 수 있을 것으로 판단된다.
보조항암화학요법에서의 Biomarker
이제까지 언급한 내용을 종합하면, 보조항암요법으로 인해 대장암의 재발률을 낮춤으로써 생존율의 향상을 보인다는 것은 정설이 되었다. 그러나 모든 환자가 보조요법으로 이득을 볼 수 있는 것은 아니다. II기 대장암의 고위험군 경우라 하더라도 보조요법의 효과가 모든 임상시험에서 유의하게 나타나지는 않아 수술만으로도 완치될 수 있는 환자 중 상당한 환자들이 재발의 가능성을 조금이라도 줄여보고자 여전히 보조항암요법을 시행 받고 있다. 따라서 보조항암요법의 유효성이 입증되는 환자군을 선별해보고자 하는 노력은 오랜 시간 동안 진행되어 왔고, 그중의 하나가 biomarker에 대한 연구이다. Mismatch repair gene은 대장암에서 가장 많이 연구되고 있는 biomarker 중의 하나로 5-FU 치료 반응과 연관이 있다고 알려져 있다. Mismatch repair system은 DNA의 nucleotide mismatch나 5-FU와 같은 알킬화로 인한 손상을 인지하여 복구시키는 역할을 한다. 후향적 분석을 통해 deficient-mismatch repair (dMMR) 종양은 proficient MMR (pMMR)에 비해 나은 예후를 보이는 것으로 알려져 있다 [33,34]. 그러나 dMMR 종양의 경우 5-FU와 같은 alkylating 약제가 투여되어 종양 내 침투한다 하더라도 세포사멸로의 진행을 유도하지 못해 종양은 지속적으로 생존하게 된다. 이러한 가설 하에 여러 임상시험을 메타분석한 결과, proficient MMR (pMMR)에서는 5-FU 근간의 보조요법이 무재발 생존이나 생존율에 유효성을 보였던 반면, dMMR에서는 의미가 없다는 보고가 나왔으나, 아직 논란은 있다. 이는 대부분의 발표가 대규모의 임상시험을 기반으로 하나 후향적 분석으로 제한이 있고, 최근 표준요법으로 사용 중인 oxaliplatin 병용요법에 따른 MMR의 역할에 대해서는 소규모의 결과만 있어 실제 임상에 적용하기는 이르다[35-37]. 따라서 MOSAIC나 NO16968과 같은 oxaliplatin 병용요법의 대규모 임상시험에서의 결과가 기대되며, 그 외에도 stage II에서의 보조항암요법의 군을 모색하기 위한 gene-expressing profiling 연구가 진행되고 있다.
결 론
대장암 수술 후 재발을 줄이려고 하는 노력은 계속되고 있으며, 이러한 결과 고위험 II기 및 III기 환자들을 대상으로 5-FU와 LV 또는 capecitabine을 근간으로 한 oxaliplatin 병용요법을 6개월 시행하는 것을 보조요법의 표준치료로 권고하고 있다. IV기 대장암 환자에서 좋은 결과를 보인 irinotecan 그리고 bevacizumab, cetuximab과 같은 표적치료제는 아직 보조요법에서 유효성을 평가받지 못하여 실제 임상에서 사용되지 않고 있다. Oxaliplatin 병용요법이 기존 5-FU/LV 보조요법에 비해 더 나은 결과를 보이면서 신경학적 독성 및 고령에서의 독성 발현빈도가 높음을 고려할 때 보조요법의 기간에 대한 재평가가 이루어져야 할 것이다. 또한 조기 대장암 뿐만 아니라 IV기 대장암에서 수술적 절제 전후에 시행되는 보조항암요법은 전이 병소의 완전절제율을 향상시키고, 재발률을 감소시킬 수 있으므로 이를 바탕으로 한 활발한 다학제적 접근을 통한 적극적인 치료가 필요하다. 아직까지는 병기 중심적인 보조요법의 적응증에 의존하고 있지만 향 후 항암치료와 연관된 예측인자 및 예후인자에 대한 좋은 연구 결과가 나와 유효한 대상 환자를 선택하여 그에 맞는 효과적인 보조항암요법을 선택할 수 있는 새로운 권고안이 제시될 수 있기를 기대해본다.