C형 간염 환자의 페그인터페론과 리바비린 병합요법 중 발생한 항CCP항체 양성 류마티스 관절염 1예
A Case of Anti-Cyclic Citrullinated Peptide Antibody-Positive Rheumatoid Arthritis Following Peginterferon Alpha-2A and Ribavirin Therapy for Chronic Hepatitis C
Article information
Abstract
만성 C형 간염으로 페그인터페론과 리바비린 병합 치료 시작 16주 후 다발성 관절통이 발생하여, 류마티스관절염 진단하에 NSAID와 DMARD를 투약하여 호전된 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Combination therapy with pegylated interferon (IFN) and ribavirin is the mainstay of treatment for chronic hepatitis C. An important side effect of IFN is the induction of an autoimmune disease such as autoimmune thyroid disease or, rarely, rheumatoid arthritis. However, the introduction of pegylated formulations of IFN can minimize the risk of autoimmune induction by reducing immunogenicity. Detection of anti-cyclic citrullinated peptide (anti-CCP) antibodies can help distinguish rheumatoid arthritis from hepatitis C-related arthritis. Here, we report the first Korean case of a 48-year-old female who developed anti-CCP antibodypositive rheumatoid arthritis following peginterferon alpha-2a therapy for hepatitis C. (Korean J Med 2012;83:287-290)
서 론
만성 C형 간염의 표준 치료는 페그인터페론 알파와 리바비린의 병합요법이다. 페그인터페론은 기존의 인터페론에 수용성의 중합체인 폴리에틸렌글리콜을 결합해 혈장 내 반감기를 증가시키고 신장 배설을 감소시켜 항바이러스 효과의 지속시간을 연장한 인터페론이며[1], 면역원성을 감소시켜 자가면역반응의 발생을 최소화시킨다고 알려져 있다[2]. 이 치료의 부작용으로 독감유사증상(근육통, 오한, 기침, 피로, 발열, 두통, 비충혈, 인후통), 오심, 구토, 이외에도 불안, 불면, 우울증과 같은 정신과적 이상, 백혈구 감소증, 혈소판 감소증과 같은 혈액학적 이상 등이 비교적 흔하게 보고되어있으나, 류마티스관절염과 같은 자가면역성 질환의 발생은 매우 드물다[3].
저자들은 만성 C형 간염의 페그인터페론 2 알파 치료 중 발생한 항CCP항체 양성 류마티스관절염 1예를 보고하는 바이다.
증 례
환 자: 여자, 48세
주 소: 양측 어깨와 손과 손목의 관절통
현병력: 18년 전 C형 간염을 진단(genotype 2a)받았던 환자로 HCV RNA 정량검사에서 1.65 × 106 IU/mL로 측정되었고, 24주간 계획으로 페그인터페론 알파 2a 180 μg/주, 리바비린 800 mg/일로 병합요법을 시작하였다. 치료 14주 후 HCV RNA 정량검사에서 15 IU/mL 이하로 측정되었다. 환자는 인터페론 치료 시작 16주 후부터 양측 어깨 관절통이 있었으며, 20주째 양측 손과 손목의 관절통이 발생하여 내원하였다.
과거력: 페그인터페론과 라비비린 치료 외에 특별한 치료 과거력과 약물의 복용력은 없었다. 특별한 외상의 과거력도 없었으며, 이전 관절염의 과거력 또한 없었다.
가족력 및 사회력: 특이사항 없음.
신체검사 소견: 내원 시 혈압 120/80 mmHg, 맥박 70회/분, 호흡 25회/분, 체온 36.5℃, 의식은 명료하였다. 관절 평가에서 양측 어깨 관절의 압통, 양측 2번째와 3번째 손허리손가락 관절과 양측 손목 관절의 압통과 종창이 있었다.
검사실 소견: 내원 당시 시행한 검사 소견으로 백혈구 5,650/mm3, 혈색소 10.4 g/dL, 혈소판 279,000/mm3였고, 생화학 검사에서 혈액요소질소 9 mg/dL, 크레아티닌 0.9 mg/dL, 총 단백 6.6 mg/dL, 알부민 3.4 mg/dL, AST 37 IU/L, ALT 33 IU/L, 총 빌리루빈 0.5 mg/dL, 직접빌리루빈 0.1 mg/dL, 프로트롬빈시간 12.7초(INR 0.95)였으며, 활성화 부분트롬보플라스틴시간 38.7초이었다. C반응성 단백 10 mg/L (정상 0-5 mg/L), 적혈구 침강 속도 62 mm/hour (정상 1-15 mm/hour)였다. 면역학적 검사에서는 항핵항체 양성(1:40), 류마티스인자 102 IU/mL (정상 0-25 IU/mL), 항CCP항체 106.8 IU/mL (정상 5 IU/mL 미만), 한랭글로불린, 항 Ro항체, 항 La항체 모두 음성이었고, C3, C4, CH50 모두 정상 범위였다.
방사선 소견: 양측 손과 어깨의 X-ray상 특이소견 없었다. 뼈스캔에서 양측 손목 관절의 섭취 증가가 관찰되었다(Fig. 1). 근골격 초음파 검사에서 양측 손목 관절의 힘줄윤활막염 소견과 파워도플러에서 윤활막염의 혈관 증식 소견도 관찰되었다(Fig. 2A and 2B).
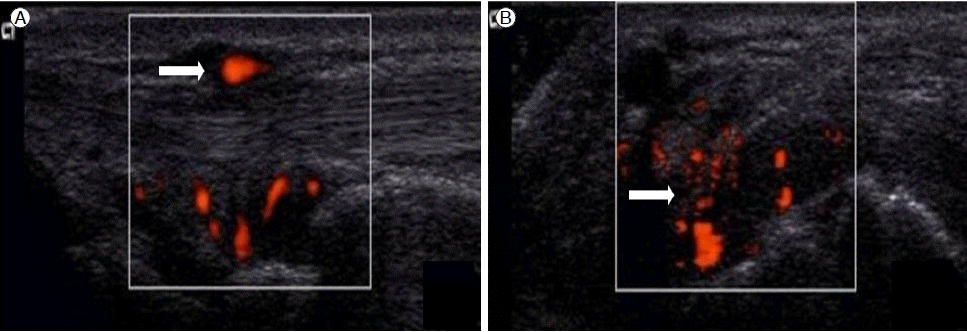
Power Doppler ultrasound imaging of the right wrist. Longitudinal (A) and transverse (B) scans over the dorsal wrist showed tenosynovitis of the extensor tendon with hyperemic blood flow.
치료 및 경과: 2010 American College of Rheumatology (ACR)/European League Against Rheumatism (EULAR) classification criteria에 따라 양측 손목 관절과 양측 2번째와 3번째 손허리 손가락 관절 침범(3점), 류마티스인자 102 IU/mL (정상 0-25 IU/mL), CCP 106.8 IU/mL (정상 5 IU/mL 미만)로 정상범위의 3배 이상(3점), ESR 혹은 CRP의 증가(1점), 총 7점으로 혈청 양성 류마티스관절염으로 진단하고, hydrochloroquine 400 mg/일과 Non-steroidal anti-inflammatory drug (NSAID)로 치료를 시작하였다. 진단 때 Disease Activity Score (DAS28) 점수가 4.9이었고, 인터페론 치료 종료 후에도 다발성 관절염이 지속되어, sulfasalazine 1,000 mg/일을 추가하였으며, 2개월 후 DAS28 점수가 2.39로 임상적 관해에 도달하여 외래에서 투약 지속하며 경과관찰 중이다.
고 찰
만성 C형 간염 환자에서 페그인터페론 치료와 연관된 관절통이 발생할 때 원인에 대한 감별진단이 필요하다. 페그인터페론에 의한 관절통의 발생률은 25-29%로[4] 증상의 지속 기간, 다른 질환 동반 여부, 침범된 관절의 위치, 전신증상의 유무, 항핵항체, 류마티스인자, 항CCP항체, 한랭글로불린 등의 혈청학적 검사를 통해 관절통의 원인을 파악해야 한다.
자기공명영상이나 도플러초음파 영상은 관절내 윤활막의 증식, 신생혈관 증식, 힘줄의 침범, 연골 손상 및 작은 골미란을 조기에 민감하게 관찰할 수 있어 류마티스관절염의 조기 진단에 도움이 된다. 뼈스캔은 염증의 활성도가 높지 않다면 뼈섭취 소견이 관찰되지 않을 수 있어 조기 진단의 특이도가 떨어지는 단점이 있다[5].
혼합한랭글로불린혈증은 만성 C형 간염과 연관이 있으며 주로 단일관절 혹은 소수관절염의 형태로 나타난다. 피부의 자색반, 림프절 종대, 간비종대, 말초신경병증, 저보체혈증 등의 소견 등이 감별에 도움이 된다[6]. 한랭글로불린혈증이 동반되지 않은 만성 C형 간염 환자에서 류마티스인자가 양성일 확률은 40% 이상이지만 항CCP항체가 양성일 확률은 매우 낮아 항CCP항체를 검사하는 것은 만성 C형 간염과 연관된 관절염과 류마티스관절염을 감별하는 데 필요하다[7].
인터페론 알파는 만성 C형 간염 환자에서 드물게 류마티스관절염을 일으키거나 악화시키는 것으로 알려져 있다. 발생기전은 명확하지 않으나 지금까지의 연구에 따르면 인터페론은 특이적인 주조직적합복합체(Major Histocompatibility Complex, MHC)를 증가시키며 MHC는 관절염 유발 펩타이드를 T세포에 제공하여 T세포를 활성화시키고 활성화된 T세포가 자가 항원과 교차반응을 하여 대식세포를 자극함으로써 관절염을 일으킨다고 알려졌으며[8], 인터페론 알파와 리바비린 병합치료가 혈청 B세포 활성인자(B cell activating factor, BAFF)를 증가시켜 활막 내에서 국소적 자가항체 반응을 유발하여 류마티스관절염을 악화시킨다는 보고가 있다[9].
페그인터페론 치료 후 발생한 류마티스관절염에 대한 보고는 현재까지 3예가 보고되었으며[3,10,11], 국내에서는 아직 보고된 바가 없다. 그중 2예는 페그인터페론 치료 중 각각 18주, 20주 후부터 다발성 관절통이 발생하였으며[3,11], 나머지 1예는 32주 후부터 증상이 발생하였다[10]. 페그인터페론 치료 중 발생한 관절통에 대해 NSAID 투약을 통한 통증 조절은 경미하거나 효과가 없었으며, 인터페론 치료 종료 후에도 관절염이 지속되었으나 hydroxychloroquine과 sulfasalazine 등의 Disease Modifying Antirheumatic Drug (DMARD)를 투약하여 호전을 보았다(Table 1).
만성 C형 간염의 항바이러스 치료 부작용과 관련하여 치료 전, 후의 추적검사 항목으로 간기능 검사, 혈액요소질소, 크레아티닌, 소변 검사, 갑상선 기능 검사, 심장 검사가 있으나, 관절염과 관련된 검사는 권장되어 있지 않다. 따라서 인터페론 치료 전 선별 검사의 목적으로 류마티스인자와 항CCP항체의 측정을 고려하는 것은 만성 C형 간염 환자에서 페그인터페론 치료로 발생한 류마티스 관절염의 감별에 도움이 될 수 있다.
