위장관기질종양으로 오인된 미분화 췌장암 1예
A Case of Anaplastic Carcinoma of the Pancreas Mimicking a Gastrointestinal Stromal Tumor
Article information
Abstract
미분화 췌장암은 매우 드문 질환이나, 치료 방법이 제한적이고 그 진행 속도가 빠르다. 또한 진단 당시 십이지장, 위, 결장 간막 등 주위 조직을 침범하는 경우가 많고 간, 폐, 림프절 등으로 원격 전이가 많다. 그중 위나 십이지장의 침범의 경우 종양 자체의 불량한 예후뿐만 아니라 종양의 급속한 성장에 의한 출혈과 천공의 위험성이 높기 때문에 조기에 정확한 진단이 중요하다. 하지만 임상 증상 및 방사선적, 내시경적 소견 등이 모호하고 비특이적이어서 그 진단이 어렵다. 그러나 앞서 기술한 몇 가지 소견, 즉, 상복부 동통, 황달, 만져지는 복부 종괴, 복부 전산화 단층 촬영상 췌장의 체부나 미부에서 주변 조직들을 침범하는 거대한 중심괴사성 종괴, 특히 종양 주변부의 조영 증강 소견, 내시경상 점막하 종양의 형태나 외부에서의 압박 소견 등이 있을 때 이를 종합적으로 판단하여 미분화 췌장암을 의심해보는 것이 필요하리라 생각된다. 본 증례에서는 내시경적, 방사선적으로 위장관기질종양으로 판단하였으나, 수술 후 조직 검사에서 최종적으로 미분화 췌장암으로 진단된 환자를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Anaplastic carcinoma of the pancreas is an extremely rare but aggressive, rapidly progressive tumor. It often presents with invasion of adjacent organs and distant metastases. Most cases are inoperable and confirmed by autopsy. A correct diagnosis of stomach invasion by anaplastic carcinoma of the pancreas is important due to the risk of bleeding, perforation by rapid tumor growth, and a poor prognosis. However, an accurate diagnosis is difficult as a result of the various clinical presentations, symptoms, and radiological findings. We herein report a case of anaplastic carcinoma of the pancreas in a 78-year-old woman who presented with stomach invasion mimicking a gastrointestinal stromal tumor. (Korean J Med 2012;83:226-231)
서 론
미분화 췌장암은 남자에 호발하며 전체 외분비 췌장암의 0.5-7% 정도를 차지하는 드문 질환이다[1]. 따라서 이에 대한 조직발생학적 및 생물학적 기원은 아직까지는 불분명하다. 미분화 췌장암은 방추세포암(spindle cell carcinoma), 다형 거대세포암(pleomorphic giant cell carcinoma), 유육성 암(sarcomatoid carcinoma) 등 여러 이름으로 불려왔으나, 1977년 Alguacil-Garcia 등[2]이 이들을 방추세포, 파골세포형 거대세포, 다형거대세포, 그리고 구형세포 등으로 분류하였고, 1996년 WHO에서 미분화 췌장암으로 정의하고, 파골세포형 거대세포암은 다른 질환군으로 분류하였다[3]. 미분화 췌장암은 발견 당시 주변 장기로의 침윤이나 원격 전이가 있는 경우가 대부분이어서 수술적 절제가 불가능하고 부검 후 진단되는 경우가 많다. 또한 다양한 성장 패턴을 보이며 매우 나쁜 예후를 보이므로 조기 감별 진단이 중요하지만, 그 임상 증상이나 방사선적 소견이 비특이적이고 모호한 경우가 많아 다른암으로 오인되는 경우가 많다. 이에 저자들은 위내시경과 방사선 검사에서 위장관기질종양이 의심되었으나 수술 후 조직 검사를 통하여 미분화 췌장암으로 진단된 증례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 김○○, 78세, 여자
주 소: 전신쇠약
현병력: 환자는 내원 5개월 전부터 전신쇠약과 식사량 감소가 있었고 1개월 전부터 증상이 악화되어 개인 병원에서 시행한 혈액검사상 빈혈(Hb 8.8 g/dL)이 발견되어 내과에 의뢰되었고, 원인 평가를 위해 시행한 위내시경 검사상 위장관 기질종양이 의심되어 정밀 검사 및 치료를 위해 입원하였다.
가족력: 특이 사항은 없었다.
과거력: 3년 전 고혈압으로 진단 받고 약물 치료 중이었다.
사회력: 흡연력이나 음주력은 없었다.
신체 검사 소견: 내원 당시의 활력 징후는 혈압은 110/60 mmHg, 맥박은 92회/분, 호흡은 20회/분, 체온은 37.6℃이었다. 의식은 명료하였고, 만성 병색을 보였으며, 결막 빈혈이 있었으나, 공막은 정상이었다. 복부 진찰에서 장음은 정상이었고 압통이나 반발통은 없었으나, 좌상복부에 단단하고 고정된 10 cm가량의 종괴가 촉지되었다.
검사실 소견: 말초 혈액검사에서 혈색소 9.0 g/dL, 적혈구 용적 26.1%, 백혈구 17,400/uL, 혈소판 638,000/uL이었다. 혈청 생화학 검사에서 혈청 총 단백 6.6 g/dL, 알부민 2.4 g/dL, AST 17 IU/L, ALT 14 IU/L, 총 빌리루빈 0.5 mg/dL, BUN 13 mg/dL, 크레아티닌 0.8 mg/dL, 칼슘 8.4 mg/dL, 알칼라인포스파타제 45 IU/L, 젖산탈수효소(LDH) 479 IU/L이었다. 혈청 CEA는 2.3 ng/mL (0-5 ng/mL)로 정상 범위였으나, 혈청 CA 19-9가 355 U/mL (0-37 U/mL)으로 상승되어 있었다.
방사선 소견: 복부 전산화 단층 촬영에서 위와 비장을 침범하고 중심부에 괴사를 동반한 12 cm 크기의 소엽성의 거대한 종괴가 관찰되었다(Fig. 1).
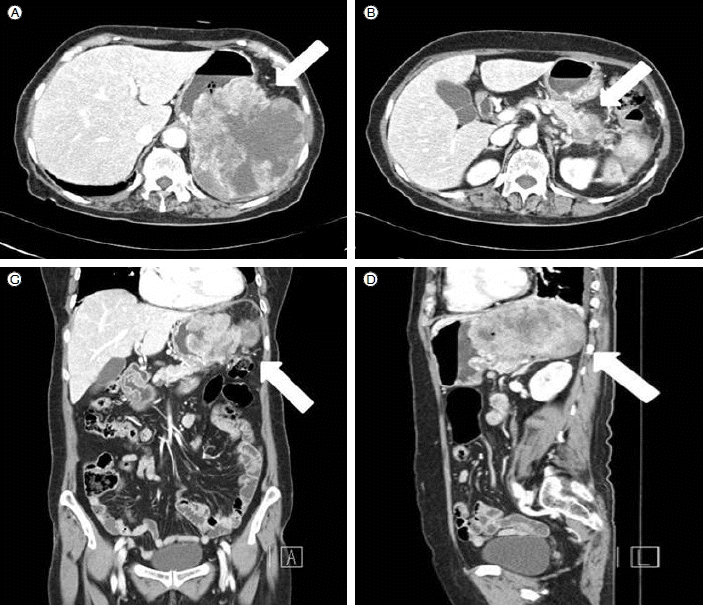
Computed tomography (CT) scan of the patient. The CT scan showed a large 12 × 12 cm heterogenous mass (white arrow) in the posterior wall of the stomach and pancreatic tail (A, B) Transverse view. (C) Coronal view. (D) Sagittal view.
위내시경 소견: 위분문부에서 5 × 5 cm 크기의 돌출하는 양상의 매끈한 점막으로 덮힌 상피하 종양이 관찰되었으며(Fig. 2), 내시경하 조직 검사에서는 염증 세포 외에 특이소견은 없었다.
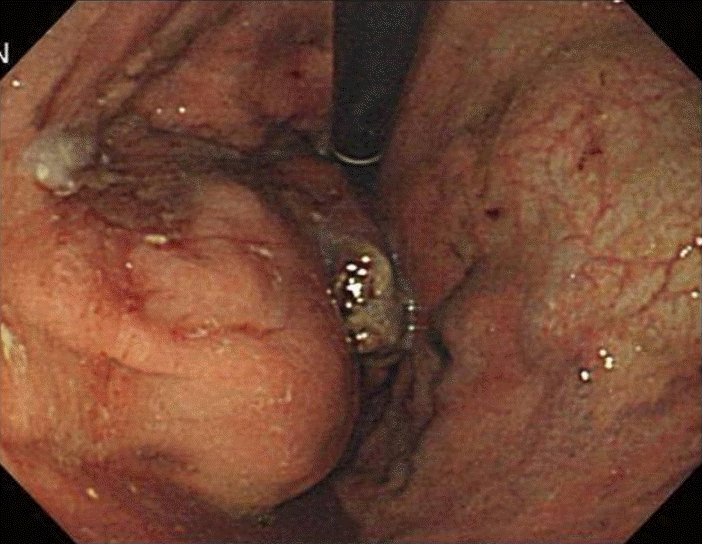
Endoscopic finding of the tumor. Endoscopy revealed a 5 × 5 cm normal-mucosa covered, fungating mass with convergence of the surrounding folds.
육안적 소견: 위의 후벽과 비장, 췌장을 침범하는 12 × 12 cm크기의 중심부 괴사가 있는 백색 종괴가 관찰되었다(Fig. 3).

Macroscopic findings of the tumor. (A, C) A bulky mass is observed extending from the pancreatic tail into the gastric posterior wall (solid arrow) and spleen (hollow arrow). (B, D) Cut surface of the specimen revealed central necrotic tissue.
조직학적 소견: 한쪽으로 치우친 불규칙한 핵과 호산구성 세포질을 동반한 다형 종양 세포들이 관찰되었고 면역조직화학염색상 CK (cytokeratin) 19와 CK 7 및 vimentin 양성이었다(Fig. 4).
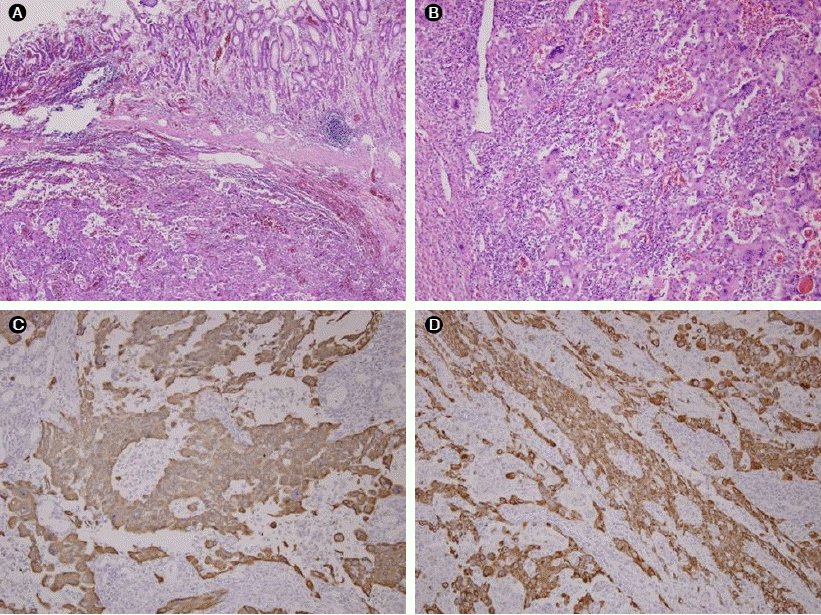
Microscopic and immunohistochemical findings of the tumor. (A) Histological examination of the resected specimen revealed that normal mucosa was preserved and undifferentiated neoplasic cells were found in the subepitheial area (hematoxylin and eosin [H&E] staining, × 40). (B) The tumor cells were pleomorphic with eccentrically placed nuclei and homogeneous, eosinophilic cytoplasm (H&E staining, × 100). Immunohistochemical staining was positive for (C) cytokeratin 7 and (D) cytokeratin 19.
경과: 환자는 위전절제 및 비장절제, 췌장미부절제를 시행한 지 5개월 후 복막 및 소장, 횡격막, 좌측 신장 등 다발성 전이가 발생하였고 2주 후 사망하였다.
고 찰
미분화 췌장암은 관상 선암의 드문 변이형이며 생존 기간이 불과 수주에 이르는 공격적인 종양이다[4]. 이들은 고령의 남성에 흔하고 주로 60-80대에 호발하는 것으로 알려져있다[5,6]. 체중감소, 피로, 식욕 감퇴, 복통, 구역, 구토 등의 일반적인 임상 증상들을 보이며, 특이한 임상 징후로는 황달, 그리고 만져지는 복부 종괴 정도이다[6]. 본 증례에서도 전신 쇠약 및 피로 등의 비특이적인 증상이었고 신체 검사에서도 복부 종괴 이외에는 특이 소견이 없었다. 발생 부위는 췌장의 어느 곳이나 가능하며, 문헌마다 호발 부위가 다양하지만, 관상 선암과는 달리 주로 체부와 미부에 호발하는 것으로 알려져 있다. 방사선적 소견은 일반적으로 복부 전산화 단층 촬영에서 조영제 주입 후 중심부에 괴사나 출혈이 동반된 소엽상의 돌출형 종괴 형태를 보인다[6]. 크기는 2.5 cm에서 20 cm까지 다양하지만, 평균 9.2 cm으로 대부분 발견 당시 8 cm 이상으로 보고된다[5]. 초기 동맥기와 문맥기에 조영 증강되는 정상 췌장 조직에 비해 저음영으로 보이는 관상 선암과는 달리 조영 후 주변부가 현저하게 조영 증강되는 것이 차이점이다. 이는 췌장의 점액성 낭선종 또는 낭성종양 및 내분비 종양 등과 유사한 소견으로, Ichikawa 등[7]의 보고에 따르면 대부분의 증례에서 수술 전 방사선적 진단도 이와 같이 잘못 판단되었다. 특징적인 내시경적 소견은 없으나 도넛 모양의 융기형 병변이나 화산 분화구 모양의 궤양형 병변이 진단에 도움을 줄 수 있다. 본 증례에서는 초기에 방사선적 및 내시경적 소견에 기초하여 위에서 기원하는 최대 직경 12 cm 크기의 거대한 위장관기질종양을 의심하였고, 위와 비장 및 췌장을 직접 침범하였지만 원격전이가 없어 수술적 절제를 시행하였으나, 절제 후 조직 검사에서 췌장 미부에서 기원하는 미분화암으로 최종적으로 진단되었다. 국내에서 보고된 미분화 췌장암 환자들은 총 6예로서 이들의 임상 증상과 발생 위치 및 방사선적 소견은 외국의 문헌 보고와 유사하였다(Table 1) [8]. 미분화 췌장암은 우세한 세포 종류에 따라 방추세포, 다형 거대세포, 구형세포 등으로 분류할 수 있으며, 면역조직화학적 검사에서 상피 세포 표식자인 CK 7, EMA, Pancytokeratin 등과 반응하여, 전이성 암종, 악성 흑색종, 횡문근육종, 융모막암종, 미분화 거대세포 림프종, 상피양 육종, 악성 섬유성 조직구종 등과 감별할 수 있으나, 일부에서는 간엽세포 표식자인 Vimentin, Desmin에 반응하기도 한다[6]. 본 증례에서도 CK 7, CK 19, Vimentin에 모두 양성 소견을 보였다. 또한, 미분화 췌장암에서는 K-ras 유전자 돌연변이가 흔하게 발견되며 돌연변이율은 66.7%까지 보고된다. 모든 돌연변이에서 12번 염색체 단완의 12번째 코돈에서 glycine이 valine으로 치환된 것을 관찰할 수 있으며, 이러한 환자들에서 불량한 예후와 상대적으로 짧은 생존 기간을 보인다[5,9-11]. Strobel 등[12]은 72예의 췌장암을 분석하여 통계학적 유의성은 낮지만 미분화 췌장암과 관상 선암에서 각각 5.7개월과 15.7개월의 평균 생존 기간을 그리고 근치적 절제가 불가능한 경우 관상 선암에서보다 예후가 훨씬 불량함을 보고하였다. 하지만 치료법에 대한 선택은 제한적이다. 근치적 절제는 대부분 발견 당시 광범위한 전이로 인해 성공적이지 못하며, 가능하더라도 수술 후 재발이나 간, 폐, 복막 등으로의 원격 전이가 빠른 편이다[6]. Paal 등[5]은 미분화 췌장암 35예 중 수술 후 2예에서 14.6년과 7.2년의 무병 장기 생존과 4예에서 평균 4.7년의 장기 생존이 있다고 하였으나, 나머지 29예에서 평균 5.5개월의 생존기간을 보고하였다. 또한 몇몇 증례들에서 방사선 치료가 시도되었지만 성공적이지 못했으며, 환자 상태의 급격한 악화등으로 항암 치료 역시 좋은 대상이 되지 못했다. 본 증례에서도 수술 후 6개월에 복막 및 소장, 신장, 횡격막 등 다발성 장기 전이로 사망하였다.
