관절염의 검사실 소견
Laboratory Findings in the Patients with Arthritis
Article information
Trans Abstract
Arthritis is caused by various diseases including rheumatoid arthritis (RA), osteoarthritis, gout and trauma, and joint involvement also occurs in some autoimmune diseases, such as systemic lupus erythematosus and Sjögren’s syndrome. Some laboratory tests provide useful information in both diagnosis and prognosis. RF and anti-CCP (cyclic citrullinated peptide) antibody are detected in approximately 70-80% of patients with RA, and often associated with a worse prognosis (e.g., bony erosion and joint deformity). Acute phase reactants, such as erythrocyte sedimentation rate and C-reactive protein, parallel the activity of RA, and their persistent elevation are also associated with a poor prognosis. Crystal examination in synovial fluid is essential to confirm the diagnosis of gout and pseudogout, and the synovial fluid culture is also important in septic arthritis. Anti-nuclear antibody helps to distinguish non-immune arthritis from systemic rheumatic diseases. However, arthritis cannot be diagnosed only with laboratory findings, and physician should consider comprehensive physical examination, clinical findings, and imaging findings as well as laboratory findings. In this topic review, laboratory tests useful for diagnosis of arthritis will be discussed and summarized. (Korean J Med 2012;83:174-177)
서 론
관절염은 여러 가지 원인에 의해서 관절에 염증이 유발되어 나타나며, 가장 흔한 증상은 관절의 통증이며, 관절이 붓거나 열감 또는 발적이 동반되기도 한다. 관절염의 진단을 위해서는 관절 자체의 문제인지, 인대나 점액낭 등의 관절주위의 문제인지, 급성으로 발생하였는지, 만성으로 발생하였는지를 종합적으로 검토하여야 한다.
일반적으로 관절염은 한 가지 소견만으로 진단할 수 없고, 임상 소견, 진찰 소견, 검사실 소견, 영상 소견 등을 종합적으로 고려해야 한다. 하지만 검사실적 소견은 관절염 환자의 진단을 위한 접근에 상당한 도움을 주며, 관절을 침범하는 다른 근골격계 질환과의 감별 진단에 도움을 준다. 또한 질환에 따라서는 검사실적 소견으로 질병의 활성도를 평가할 수도 있으며, 예후에 대한 정보도 얻기도 한다. 본 종설에서는 관절염의 진단에 도움이 되는 검사실 소견에 대해서 요약 기술하였다.
본 론
류마티스 인자와 항 CCP 항체
류마티스 인자(rheumatoid factor)는 IgG (immunoglobulin G)의 Fc 부위에 특이적으로 결합하는 자가항체로 류마티스 관절염의 진단과 예후 예측에 중요한 검사 소견이다. IgA, IgG 항체도 존재하나, 일반적으로 IgM 류마티스 인자가 가장 풍부하게 존재하며, 측정하기도 쉬우며, 진단적 가치도 가장 높은 것으로 알려져 있다[1].
류마티스 인자는 류마티스 관절염 환자의 약 70%에서 나타나며, 높은 역가의 류마티스 인자는 관절의 미란이나 파괴 등의 나쁜 예후를 시사한다[2]. 그러나 류마티스 인자는 민감도가 60%, 특이도가 80% 정도로 만족할 만한 수준이 아니며, 건강한 사람에서도 약 5%에서 양성을 보일 수 있으며, 70세 이상 노인에서는 10-20% 정도로 양성률이 증가하므로 진단에 주의를 요한다. 또한 다양한 전신 질환들에서도 양성을 보일 수 있다[3]. 즉, 쇼그렌 증후군, 전신홍반루푸스, 전신성 경화증, 만성 간질환, 유육종증, 결핵, B형 감염 등에서도 양성이 나타난다(Table 1). 또한, 초기 류마티스 관절염의 30-50% 정도에서는 음성 소견을 보이므로, 류마티스 관절염이 의심되는 환자에서 초기에 음성 소견이 보이더라도 6-12개월 후에 다시 추적검사를 해 보아야 한다.
최근 2010년 새롭게 개정된 분류 기준[4]은 류마티스 관절염의 조기 발견을 위하여 류마티스 인자와 함께 항 CCP (Cyclic Citrullinated Peptide) 항체를 포함하였다. 항 CCP 항체는 기존의 IgM 류마티스 인자의 민감도와 비슷하지만, 특이도는 96% 정도로 더 높은 것으로 보고되었으며[5], 류마티스 관절염 환자의 70%의 환자에서 존재한다고 알려져 있다[6]. 또한, 항 CCP 항체는 초기의 미분화성 관절염이 류마티스 관절염으로 진행하는 것을 예측하는데 민감도가 50%, 특이도가 97%로 측정되었고[7], 정상 대조군을 대상으로 한 코호트 연구에 의하면 류마티스 관절염이 발생하기 이전부터 이미 존재한다는 사실이 입증되었다[8]. 그러므로, 초기 염증성 관절염 환자에서 항 CCP 항체의 존재는 류마티스 관절염의 빠른 진단과 치료를 할 수 있게 하는 지표가 될 수 있다. 또한, 항 CCP 항체는 골미란 등의 방사선학적인 질병의 진행과 상관관계가 있다고 알려져 있으며, 특히 골파괴와 관련성이 있음이 알려져 예후인자로서의 중요한 역할을 한다[9].
요산(uric acid)
통풍은 진행성 관절염이며, 단일 관절염 및 소수 관절염 양상으로 나타나지만, 만성으로 진행하면, 몸 전신의 말초관절을 침범하고, 관절의 변형을 야기하는 질환으로, 요산 대사의 이상이 질환의 발생과 연관이 있다.
요산은 퓨린 대사의 최종 산물이며, 혈중 요산 수치는 나이와 성별에 따라서 다양하지만, 일반적으로 혈중 요산이 6.8 mg/dL 이상인 경우 고요소산혈증으로 정의한다. 사람의 체온에서 요산의 용해도의 한계는 6.8 mg/dL이므로, 이 이상의 농도로 존재할 경우, 혈장에 더 이상 용해될 수 없어 요산 결정(urate crystal)을 형성하게 된다. 일반적으로 요산의 농도와 통풍의 발생과는 상관관계가 있으며, 요산 수치가 7-8.9 mg/mL인 사람의 연간 발생률은 0.5%, 9 mg/mL 이상인 사람의 연간 발생률은 4.9%로 증가하게 된다[10]. 고요산혈증은 통풍 발생에서 중요한 요소이지만, 고요산혈증을 보이는 사람에서 15-25% 정도만 통풍이 발생하므로 진단에 필수적인 요소는 아님을 유의해야 하며, 통풍의 확진은 편광 현미경상에서 바늘 모양의 요산 결정(urate crystal)을 확인을 통하여 이루어 진다.
활막액 검사 소견
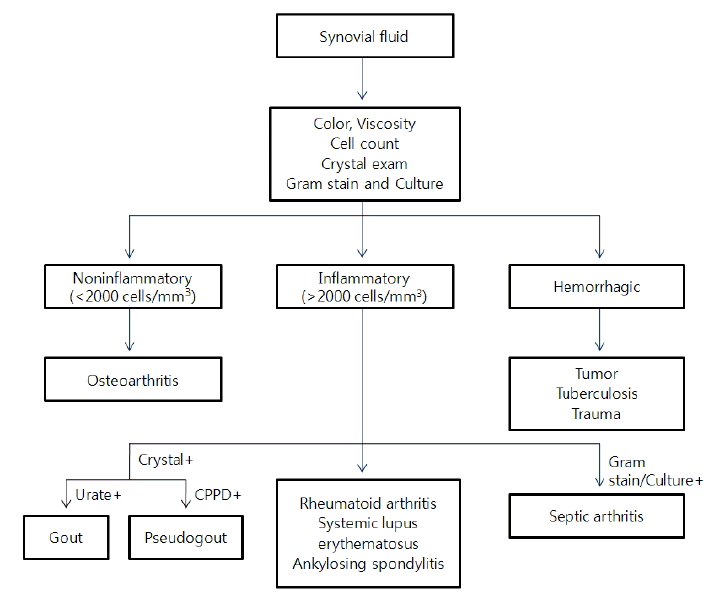
일반적으로 활막액은 소량의 당과 단백을 포함하고, 소수의 백혈구 및 적혈구를 포함하는 물질이며, 활막액 천자는 초음파 유도하에 또는 초음파 없이 바로 시행할 수 있다. 관절염 환자에서 이러한 활막액의 특성이 변화하므로 활막액을 분석하는 것은 관절염의 진단에 도움을 줄 수 있다. 특히, 급성 단일 관절염 환자에서 감염성 관절염이나 통풍 관절염의 진단에는 필수적인 검사라고 할 수 있으며, 관절의 부종을 동반한 외상이나 만성 다관절염 환자에서 새롭게 단일 관절염이 발생한 경우에도 도움이 된다. 활막액 검사에서는 세포분획의 산정과 결정의 존재 유무의 확인 및 세균 배양과 그람염색 등을 시행하여야 한다. 일반적으로 비염증성 관절액은 비교적 투명하며, 연한 갈색빛을 보이며, 백혈구는 주로 단핵구로 이루어져있으며, 2,000/mm3 이하로 존재한다. 반면에 염증성 관절액은 반투명한 성상을 보이며, 주로 다행핵(polymorphonuclear) 세포로 구성되어 있고, 백혈구가 2,000/mm3이상 존재하며, 50,000/mm3까지 존재할 수 있으며, 그 이상은 감염의 존재를 고려해야 한다. 만약 관절 천자한 활막액에서 혈액이 보인다면 혈관절증인지, 관절 천자 도중의 외상에 의한 것인지 감별해야 하며, 혈관절증의 원인에는 종양이나, 응고 장애, 결핵 등이 있으며, 이러한 질환들을 감별해야 한다.
화농성 관절염에서 가장 흔하게 원인이 되는 균은 포도상 구균이나 연쇄상구균 같은 그람 양성균이라고 알려져 있다. 활막액의 그람 염색법은 50%에서 미생물의 존재를 밝혀낼 수 있으며[11], 양성 예측도가 매우 높으나, 음성 예측도는 상당히 낮다고 알려져 있다. 화농성 관절염의 확진은 균 배양 검사이며, 활막액 뿐만 아니라 혈액에서 시행하는 것도 추후 치료를 위한 항생제의 선택에 도움을 줄 수 있다[12].
통풍 관절염의 경우는 활막액에서 바늘 모양의 음성 이중 굴절성을 갖는 요산 결정체(Needle-shaped, negatively birefringent urate crytal)를 확인하고, 가성 통풍 관절염은 마름모 모양의 칼슘피로인산(Calcium pyrophosphate) 결정체를 확인함으로써 확진할 수 있다(Fig. 1).
자가 항체(autoantibody)
전신적인 염증 증상을 동반하는 류마티스 질환들은 관절염 증상을 나타내는 경우가 많다. 전신홍반루푸스 환자의 85% 이상이 관절통이나 비미란성(Non-erosive) 관절염을 호소하며, 드물게는 관절의 변형을 초래하기도 한다. 또한, 쇼그렌 증후군에서도 50-80% 정도의 환자는 관절통이나 일시적인 관절염 증상을 호소한다고 알려져 있고, 전신성 경화증 환자 및 염증성 근염 환자에의 일부에서도 관절의 증상을 호소할 수 있으므로, 관절염 환자의 진단에 있어서 이러한 질환들을 고려해야 한다. 그러므로, 관절염 환자에서 전신적인 자가 면역 질환이 의심되는 증상이 있다면 항핵항체를 포함한 자가 항체를 검사를 통하여 적절한 진단을 하여야한다[13].
그 외 검사실 소견
급성기 반응 물질인 C-반응 단백과 적혈구 침강 속도는 다양한 질환에서 증가한다. 류마티스 관절염에서도 증가되어 있으며, 질병의 활성도를 반영하는 중요한 지표이며, 질병 경과를 파악하는데 도움이 되며, 지속적으로 상승하여 있는 경우 관절의 파괴 등 나쁜 예후를 시사하는 소견이 된다[14,15]. 그러나 다른 질환과 감별 진단에는 도움이 되지 않고, 특히 C-반응 단백이 10 mg/dL 이상 저명하게 상승하는 경우는 화농성 관절염을 꼭 고려해야 하며, 통풍 관절염에서도 상승할 수 있다. 류마티스 관절염에서는 혈소판이 증가되어 있는 경우가 많으며, 관절염이 조절되면 정상 수치로 되돌아 온다. 또한, 경한 정도의 빈혈도 나타날 수 있으며, 이 역시 질병의 활성도와 비례한다고 알려져 있다. 척추 관절병 환자에서는 흔하게 HLA-B27 유전자가 양성이므로, 척추 관절병의 임상양상을 갖는 환자의 진단에 도움이 된다. 더불어 간염 바이러스나 HIV (human immunodeficiency virus) 등의 바이러스에 대한 검사도 관절염 감별 진단에 도움이 될 수 있다.
결 론
관절염 환자에서 검사실 소견은 질환의 진단, 특히 류마티스 관절염의 질병의 활성도 및 예후 평가에 어느 정도 역할을 할 수 있다. 또한, 감염성 관절염이나 통풍 관절염의 경우 활막액의 검사를 통하여 진단이나 치료에 상당한 도움을 얻을 수 있다. 그러나 관절염에 있어 단일 검사 소견만으로 진단하여서는 안되며, 임상양상, 이학적 검사, 영상학적 검사 및 검사실 소견 등을 포괄적으로 종합하여 진단하여야 한다.