위암 항암치료의 최신지견
Recent Advances in Chemotherapy of Gastric Cancer
Article information
Trans Abstract
Surgery is the best and the only treatment modality for cure if a patient has resectable gastric cancer. The outcome can be improved by a strategy of perioperative (neoadjuvant or adjuvant) chemotherapy or chemoradiotherapy. Whereas, advanced gastric cancer is treated primarily with chemotherapy; however, no chemotherapy regimen has been considered a standard. First-line chemotherapy generally includes fluoropyrimidine and cisplatin, sometimes with the addition of a third drug (epirubicin or docetaxel). In second-line setting, chemotherapy with single-agent irinotecan or docetaxel has emerged as a new standard of care. With improved understanding of the biology of gastric cancer and the identification of key signaling pathways, a number of promising molecularly-targeted agents have been studied that broaden the therapeutic options in the future. Regardless of the extent of disease or treatment modality, a multidisciplinary team approach is always desired since it can provide best treatment options for the patients. (Korean J Med 2012;82:417-426)
서 론
위암(gastric cancer)은 국내에서 암 사망률의 수위를 차지하는 흔한 악성종양으로, 지난 20년간 위암으로 인한 높은 사망률은 큰 변화가 없었다[1]. 전 세계적으로도 위암은 암 사망률 2위이며[2], 위장에서 발생하는 악성종양을 통칭하지만 90% 이상이 adenocarcinoma이므로 일반적으로 위암이라고 하면 gastric adenocarcinoma를 지칭한다. 전 세계적으로 위암의 발병률이 감소하는 추세이긴 하지만 상대적으로 위장 내에서 위암이 발생하는 부위는 원위부(fundus 또는 antrum)에서 근위부(cardia 또는 위-식도 접합부)로 이동하고 있다[3]. 한편 Lauren 등[4]은 위암을 병리학적으로 diffuse와 intestinal type으로 분류한 바 있는데, diffuse type은 주로 젊은 환자에서 발생하여 주변 장기로 직접 확장되는 양상을 보여 복막전이(peritoneal metastasis)가 흔한 반면 intestinal type은 보다 고령에서 발생하고, 혈액을 통해 간 등의 원격 장기로 전이되곤 한다[5]. 근위부와 원위부 위암, diffuse와 intestinal type의 위암은 원인과 발병기전, 예후 등에서 차이가 있을 것으로 생각되나 아직 진단과 치료방법에 큰 차이가 없으므로 여기서는 위암으로 통칭하기로 한다.
수술적 완전 절제술만이 위암의 완치를 기대할 수 있는 유일한 방법이므로 조기에 진단하여 수술하는 것이 최선이긴 하지만 상당수의 위암 환자는 국소진행성(locally-advanced) 혹은 전이성(metastatic) 병기에서 진단되고 있다. 적극적인 조기진단이 행해지는 한국이나 일본의 경우 반수 가까운 환자가 조기위암(early gastric cancer)의 단계에서 진단되고[6], 수술 후 5년 생존율이 70%를 상회함에 비하여 미국이나 유럽 등의 서양에서는 조기위암이 5-10% 정도에 그처 결과적으로 5년 생존율도 20% 정도에 불과하다[7]. 그러나 이와 같이 진단 당시 병기와 치료 방법의 차이가 동서양 사이에 존재함에도 불구하고 비슷한 예후를 가진 위암 환자의 치료성적은 서양 환자와 동양 환자 사이에 큰 차이가 없다[8]. 또한 수술적 완전 절제가 가능했던 환자의 경우에도 반수 이상이 결국 재발하므로[9], 위암의 치료에는 수술 말고도 항암화학요법(chemotherapy)이나 방사선 치료(radiation therapy) 등의 수단이 중요한 역할을 차지하고 있다.
한편, 수술이 불가능하거나 전이를 동반한 경우 혹은 재발한 진행성 위암(advanced gastric cancer)의 경우에는 고식적 항암화학요법이 유일한 치료방법이며, 적극적 지지요법(best supportive care)에 비해 생존기간과 증상 조절의 측면에서 우월한 것으로 알려지고 있다[10,11]. 그러나 다른 장기에 발생하는 고형암과 달리 위암 환자는 식욕감퇴, 소화장애 등의 증상을 호소하는 경우가 많고, 복막전이를 종종 동반하므로 치료를 시작하기도 전에 이미 활동도가 크게 저하되어 항암치료 자체를 견디기 어려운 경우가 많다[12]. 위암에서는 5-fluorouracil (5-FU)와 cisplatin의 병용요법이 가장 널리 시행되는 항암화학요법이지만 아직까지도 전 세계적으로 인정된 표준요법이 확립되어 있지 않고, 지금도 새로운 약제들이 단독 또는 병용요법으로 임상시험을 통해 시도되고 있는 형편이다. 그래도 최근에는 고형암의 발병기전과 이에 관여하는 신호전달체계에 대한 이해를 통해 새로운 분자표적치료가 개발되어 이용되기 시작하면서 위암의 치료는 새로운 국면을 맞이하고 있다.
수술 전과 후에 행해지는 보조항암요법
앞서 언급한 바와 같이 수술적 완전 절제가 이루어진 경우에도 위암 환자의 재발률과 생존기간이 아직 만족스럽지 못한 것이 현실이다[13]. 위암의 수술 전에 항암화학요법, 방사선 치료 또는 이들의 병용요법을 시행하는 신보조(neoadjuvant 또는 preoperative) 항암요법의 전략은 미세전이를 사전에 제거하고, 병기를 낮추어 완전절제(R0 resection)가 가능하게 하는 것이 주된 목표이므로 특히 림프절 전이가 있거나 국소적으로 진행된 병기에서 더욱 유효하다. Dutch Gastric Cancer Group의 연구에서는 59명의 환자를 수술 단독군(n=30)과 4주기의 FAMTX (5-FU, doxorubicin, methotrexate) 항암치료 후 수술군(n = 29)으로 무작위 배정하였는데 비록 환자등록이 저조하여 조기에 중단되긴 하였으나 생존기간이 양 군 사이에서 차이가 없었다(중앙값: 수술 단독군 30개월 vs. 항암치료 후 수술군 18개월, p = 0.17) [14]. EORTC (European Organization for Research and Treatment of Cancer)의 주관으로 시행된 또 다른 임상시험에서도 수술 전 보조화학요법이 완전절제율(R0 resection)을 향상시킴이 증명되었으나 이같은 수술 성적의 향상이 생존기간의 연장으로 이어지는 것은 관찰되지 못하였다[15]. 반면 프랑스에서 시행된 ACCORD07/ FFCD9703 연구에서는 수술 단독군에 비해 수술 전 보조화학요법군에서 생존율이 의미 있게 연장됨이 관찰된 바 있다(5년 생존율 24% vs. 38%, p = 0.02) [16]. 현재까지 발표된 가장 대규모의 임상시험은 영국에서 시행된 Medical Research Council Adjuvant Gastric Cancer Infusional Chemotherapy (MAGIC) 연구로 503명의 위암 환자를 대상으로 수술 단독군과 항암화학요법을 수술 전후로 시행한 군으로 나누어 치료성적의 차이를 비교하였다[17]. 결론적으로 항암치료를 받은 군에서 통계적으로 유의하게 무진행생존기간(progression-free survival)과 전체생존기간(overall survival)이 향상된 것이 보고되었고, 5년 생존율도 항암치료군에서 36%, 수술군에서 23%로 큰 차이를 보였다. 다만 MAGIC 연구에 포함된 환자군은 등록 당시에 수술이 가능한 환자만을 대상으로 하였기 때문에 수술이 불가능한 경우 항암요법을 통해 수술이 가능할 수 있을지에 대해서는 알 수가 없었고, 항암화학요법이 수술 전과 후에 모두 시행되었고, 항암치료군의 반수 이상이 수술 후에 부작용 등을 이유로 계획된 항암치료를 받지 못했으며, 약 1/3의 환자가 수술 전 항암치료에 반응하지 않았기 때문에치료에 대한 반응을 보다 조기에 예측하거나 보다 효과가 뛰어난 항암요법의 개발이 과제로 남아있다. 최근에 시행된 메타분석에서는 위암의 수술 전 보조화학요법이 수술 단독군에 비해 생존기간이 의미 있게 향상됨을 보고한 바 있다[18]. 메타분석의 결과 수술 전 보조항암요법의 효과는 보다 진행된 위암(T3-T4)에서 저명하게 나타났으며, 단일 약제보다는 복합 항암화학요법(combination chemotherapy)이 더 우월하다고 하였다.
수술 전 항암요법의 목적이 국소재발을 방지하고, 병기를 낮추어 완전절제가 가능하게 도와주는 것이라면 또 다른 접근방법으로 방사선 치료를 위암 수술 전에 시행하는 방법도 고려해볼 수 있을 것이다. 이미 수술 전에 방사선 치료를 시행하여 위암의 국소재발을 감소시킬 수 있다는 연구결과가 보고된 바 있고[19], 비교적 소규모의 제2상 연구에서 이러한 항암방사선요법을 통해 높은 완전절제율과 조직학적 완전관해율이 보고된 바 있어서 향후 대규모의 임상시험이 기대되고 있다[20,21]. 국내에서의 연구에서도 위암의 수술 전 항암화학요법과 방사선 치료의 병용요법의 안전성이 입증되어 현재 제2상 임상연구가 진행 중이다[22].
이와 같은 이점에도 불구하고 수술 전 항암요법이 보편화되지 못하는 가장 큰 문제점 중의 하나는 치료 도중 병이 진행되거나 항암치료의 독성으로 수술이 불가능해지는 경우에 대한 우려다. 따라서 임상 현장에서는 수술을 먼저 시행한 후에 항암화학요법 및 방사선 치료를 추가적으로 시행하는 경우가 많다[23]. 이미 2001년에 미국에서 발표된 Intergroup INT-0116 연구에서 병기 Ib-IV (M0) 위암의 수술 후 항암방사선 치료의 병용요법이 수술만 시행한 경우에 비해 생존율을 향상시키는 것이 보고된 바 있다(35개월 vs. 26개월, p = 0.006) [24]. 그러나 이 연구에서는 상당수의 환자가 림프절곽청술을 받지 않았기 때문에 적절한 수술이 행해졌는가에 대한 논란이 계속되어 이러한 항암방사선 보조요법은 미국을 제외한 국가들, 특히 동양권에서는 흔히 적용되고 있지 못한 형편이다[13,25]. 한편, 일본에서 행해진 또 다른 대규모 3상 연구에서는 II-III 병기 위암의 근치적 수술 후 S-1을 1년간 경구투여하는 것이 수술만 시행한 경우에 비해 생존기간이 향상되는 것으로 보고된 바 있다[26]. 이 연구의 장기 추적관찰 결과에서도 5년 생존율이 수술 단독군에서 70%, 보조항암치료군에서 80%로 큰 차이가 입증되었다(p = 0.003). 그러나 이처럼 동양과 서양에서 시행된 위암의 보조항암화학요법에 대한 임상시험은 비교적 적은 환자군과 진단 및 치료방식의 차이로 인하여 일반적인 사용의 정당성을 증명하기에는 충분하지 않았고, 이러한 한계는 여러 연구자들에 의해 행해진 메타분석의 결과에서도 계속 언급되었다[23,27,28]. 가장 최근에 발표된 대규모 임상시험인 CLASSIC 연구에서는 D2 림프절곽청술을 포함한 위 절제술을 받은 병기 2-3기 위암 환자를 대상으로 수술 후 8주기의 XELOX (capecitabine, oxaliplatin) 항암화학요법을 받은 군(n=520)과 관찰군(n=515)으로 무작위 배정하였고[29], 보조항암화학요법을 통해 3년 무병생존율(disease-free survival)을 60%에서 74%로 향상시킴을 보고하였다(hazard ratio [HR] 0.56, 95% confidence interval [CI] 0.44-0.72, p = 0.0001).
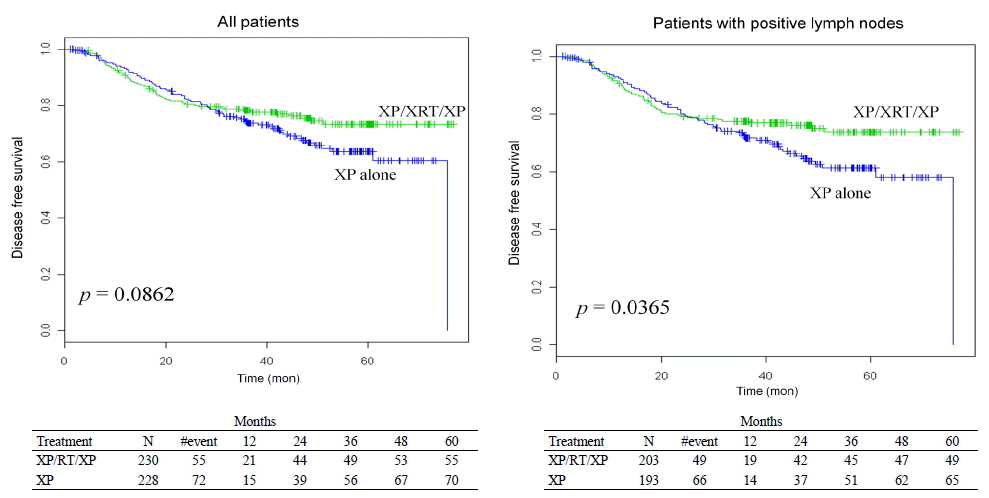
현재로서는 위암의 수술 후 보조항암요법의 필요성에 공감대가 형성되고 있으나 방사선 치료가 굳이 추가적으로 필요한가에 대해서는 아직 동서양 사이에 논란이 계속되고 있다. 앞서 언급한 INT-0116 [24] 연구의 결과에 따라 미국에서는 위암의 수술 후 보조항암방사선 치료가 표준치료로 권고되었으나[30] 대다수의 환자에서 충분한 림프절곽청술이 시행되지 못한 것이 계속 지적되어 왔으며[25], 이 연구에서 D2 림프절곽청술을 시행 받은 54명의 환자를 분석한 추적 연구에서는 수술 후 보조항암방사선 치료의 효과가 발견되지 못하였다[31]. 즉, 불충분한 수술이 행해지는 서양에서는 방사선 치료의 추가를 통해 치료효과를 향상시킬 수 있는 반면에 보다 광범위한 수술이 행해지는 일본이나 한국에서는 추가적인 이득을 기대하기 어렵다는 것이다. 이러한 의문점을 해결하기 위해 국내에서 시행된 ARTIST (Adjuvant Chemoradiation Therapy In Stomach cancer) 연구에서는 D2 림프절곽청술이 시행된 총 458명의 위암 환자를 보조항암화학요법군(capecitabine + cisplatin, XP)과 보조항암방사선 치료군(XP + 항암방사선 치료)으로 무작위 배정하여 치료성적을 비교하였고[32], 결론적으로 항암방사선 치료를 추가하여도 무병생존 기간의 의미 있는 향상은 달성되지 못하였으나(p = 0.0862) 림프절 전이가 있었던 환자군의 경우에는 그 차이가 관찰되었다(p = 0.0365; Fig. 1).
이상에서 보듯 영국과 유럽에서는 MAGIC 연구의 결과에 따라 수술이 가능한 위암 환자에게 수술 전과 후에 항암화학요법을 시행하도록 권장하고 있고[17], 미국에서는 INT-0116 연구에 의거하여 수술 후에 항암방사선 치료를 추가하는 방법이 널리 권장되고 있다[24]. 반면 일본과 한국 등에서는 S-1 [26] 또는 XELOX [29] 등의 항암화학요법이 수술 후 보조요법으로 권장되는 상황이며, 위암의 치료성적을 향상시키기 위해서는 수술 전이나 후에 추가적인 치료가 필요함은 동서양의 연구자 모두가 공감하지만 아직 표준요법이라고 부를 만한 치료법은 없는 형편이다.
진행성 위암의 고식적 항암화학요법
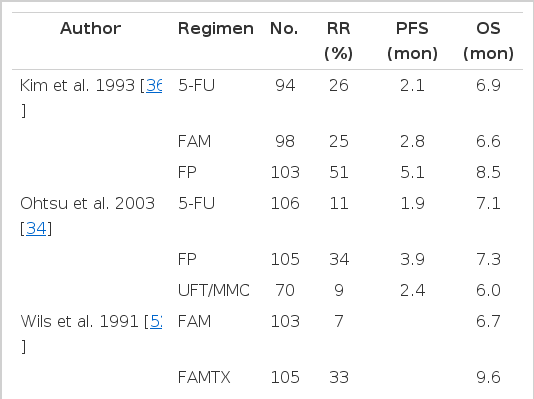
앞서 언급한 바와 같이 재발하거나 진단 당시에 이미 타 장기로의 전이가 확인된 진행성 위암의 경우 예후가 극히 불량하여 완치를 기대하기 어려움에도 불구하고 고식적(palliative) 항암화학요법을 통해 생존기간과 삶의 질을 향상시킬 수 있음이 입증된 바 있으나[10,11] 아직 표준요법으로 인정되는 약제나 병용요법은 없는 형편이다. 고전적으로는 5-FU, anthracyclines(doxorubicin, epirubicin), cisplatin, mitomycin C 등의 여러 약제들이 위암에 효과가 있다고 알려져 왔고, 이후 등장한 taxanes (paclitaxel, docetaxel), irinotecan, oxaliplatin, capecitabine, S-1 등도 위암 환자의 치료에 활발히 이용되고 있지만 모두 단일 약제로서의 반응률이 20% 이하이며, 타 약제와 병용하였을 경우에도 중앙생존기간이 1년 미만에 그치고 있다[33-35]. 5-FU의 단독 투여와 타 약제와의 병용요법을 비교한 3상 연구에서는 5-FU 단독에 비해 우월한 생존기간의 향상을 보인 병용요법은 없었다(Table 1) [33,34,36]. 그러나 반응률과 무진행생존기간의 측면에서는 cisplatin과의 병용요법이 5-FU 단독에 비해 우수하였고, 메타분석에서도 우월한 효과가 관찰되었기 때문에 실제로는 거의 모든 나라에서 5-FU 근간의 복합항암요법, 특히 5-FU와 cisplatin의 병용요법(CF)이 주로 사용되고 있다[37]. CF 요법을 받은 진행성 위암 환자의 중앙 생존기간이 기껏 10개월에도 미치지 못하였기 때문에 여기에 epirubicin, docetaxel, irinotecan 등의 약제를 추가하여 투여하는 방법이 계속 시도되어 일부에서는 약간의 생존기간의 향상이 보고되고 있으나 더불어 독성의 증가도 관찰되어 세 가지 이상의 다약제 병용요법이 더 효과적인지에 대해서는 아직 논란이 계속되고 있다(Table 2).
위암의 항암치료에 널리 이용되는 cisplatin의 경우 심한 구토와 신 독성이 종종 문제가 되므로 효과는 비슷하면서 보다 부작용이 적은 다른 백금계 항암제인 oxaliplatin이 대체제로 종종 이용된다[38]. Oxaliplatin은 cisplatin에 비해 부작용이 경미할 뿐 아니라 항암효과도 대등하거나 우수하다. 또한 5-FU의 경우 지속적 정맥주입이 필요한데 이는 환자에게 불편감을 초래할 뿐만 아니라 중심정맥관이나 포트를 필요로 하여 이를 통한 감염이나 혈전 등의 부작용의 위험이 높다. 따라서 최근에는 fluoropyrimidine 경구 제제인 capecitabine이나 S-1 등으로 5-FU 지속적 정맥주입을 대체하려는 경향이 있다. 환자들은 효과가 비슷하다면 정맥주사요법보다는 경구 요법을 선호한다[39]. Capecitabine 또는 S-1 등의 경구제제와 cisplatin 병용요법을 시험군으로 지정한 3상 연구에서도 XP (capecitabine + cisplatin) 또는 SP (S-1 + cisplatin) 요법의 효과와 안전성이 입증되었다[40,41]. 이러한 추세를 반영하여 현재 전 세계적으로 시행되고 있는 대규모 3상 임상시험의 상당수가 대조군(표준요법군)으로 XP 또는 XELOX요법을 채택하고 있다는 사실도 주목할 만하다.
세 가지 이상의 약제를 이용한 다약제 병용요법
현 시점에서 위암의 치료에 활발하게 이용되는 항암제는 anthracyclines, taxanes (docetaxel, paclitaxel), irinotecan, 백금계 항암제(cisplatin, oxaliplatin) 등이며, 이들 약제의 조합이 임상시험의 결과에 따라 혹은 치료자의 선호에 따라 선택되는 상황이다. 위에서 언급한 바와 같이 CF 요법에 다른 항암제를 추가한 ECF (epirubicin + CF), DCF (docetaxel + CF) 등의 3제병용 항암요법에서 생존기간의 향상이 보고된 바 있으나 그 중간값이 여전히 10개월 남짓에 머물러 있으며[42,43], 부작용이 증가할 우려가 있다. DCF 요법을 CF와 비교한 TAX 325 연구에서는 DCF (n=221)군에서 CF (n=224)군에 비해 통계적으로 의미 있는 생존기간의 향상이 관찰되었으나(중앙 생존기간 9.2개월 vs. 8.6개월, 1년 생존율 40% vs. 32%) [43], 호중구감소증, 설사, 신경독성 등의 부작용이 더 빈번하게 보고되었다. ECF 병용요법의 경우 FAMTX와 비교한 영국에서의 제3상 연구에서는 비록 ECF 군에서 생존기간과 삶의 질이 우월하게 보고되긴 했으나 ECF에 배정된 더 많은 환자에서 화학요법 후 외과적 수술이 시행되었다는 점에서 논란의 여지가 있으며[42], ECF를 5-FU 단독 혹은 CF와 직접적으로 비교한 비교임상시험은 아직까지 시행된 바 없다. 영국에서 행해진 또 다른 대규모 3상 연구인 REAL-2 연구에서도 capecitabine을 5-FU 대신 사용한 epirubicin, cisplatin and capecitabine (ECX) 화학요법이 기존의 ECF를 대체할 수 있을 것으로 제시된 바 있고[38], 메타분석에서도 5-FU, anthracycline, cisplatin의 3제요법이 타 항암요법에 비해 가장 우월한 생존기간을 보이는 것으로 보고된 바 있으나[37] 기존의 연구에서 XP (반응률 41%, 중앙생존기간 10.5개월)와 ECX (반응률 46%, 중앙생존기간 9.9개월)는 두 가지 혹은 세 가지 약제의 병용요법이라는 차이에도 불구하고 효과의 측면에서 큰 차이는 없어 보인다[38,40]. 국내에서도 ECX와 XP를 직접 비교한 연구가 시행된 바 있는데 두 항암요법 사이에 효과의 차이는 관찰되지 않았고(Fig. 2) [44], 저자들은 그렇다면 보다 부작용이 적고 간편한 2제요법을 선택하도록 권고하였다. 위암의 치료에 많이 쓰이는 다른 약제인 irinotecan 근간의 항암화학요법을 비교한 연구에서도 ILF (irinotecan, leucovorin, 5-FU)에 cisplatin을 추가한 PILF 요법이 ILF에 비해 우월하다는 결과는 도출되지 못하였다[45]. 이상에서 보듯 현재까지 세계적으로 인정되는 위암의 표준 치료는 없으며, 한국, 일본, 미국 등에서는 fluoropyrimidine (5-FU, capecitabine, S-1 등) 제제와 백금계 항암제(cisplatin, oxaliplatin 등)의 2제 병용요법이, 유럽 일부와 영국에서는 3제 요법인 ECF 또는 ECX가 널리 사용되고 있는 형편이다[8,37].
생물학적 제제 혹은 표적치료제
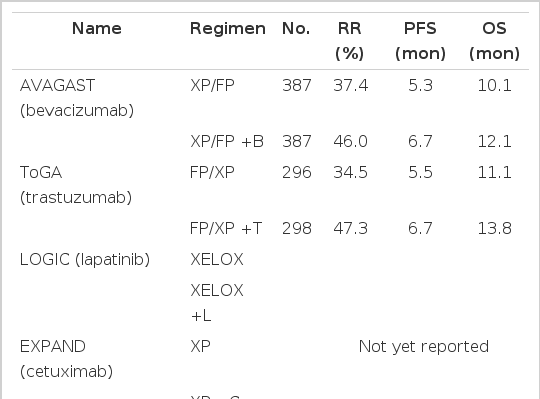
비록 다제병용 항암화학요법이 진행성 위암 환자의 생존율을 향상시킨 바 있고, 현재 표준치료로 널리 이용되고 있으나 여전히 생존기간의 중앙값은 채 12개월을 넘지 못하고 있다. 기존의 항암요법에 새로운 약제를 추가하면 항암효과는 향상될 가능성이 있지만 더불어 독성도 크게 증가할 것이 자명하다. 아직 위암에서의 연구결과는 적은 편이지만 최근 분자표적치료제(molecular targeted therapy), 특히 epidermal growth factor receptor (EGFR) 및 vascular endothelial growth factor (VEGF) 등의 표적에 대한 단일클론 항체 혹은 tyrosine kinase 억제제가 개발되어 활발히 연구되고 있고, 일부는 이미 폐암, 유방암, 대장암 등에서 표준치료로 자리잡고 있다. 이들 약제는 기존의 항암제에 비해 독성이 경미하고, 암 발병에 특이적인 신호전달체계에 작용하도록 설계되어 있으므로 환자에 따른 맞춤 치료가 가능하다는 이점이 있다. 위암의 경우에도 EGFR 단일클론항체인 cetuximab, panitumumab 등과 VEGF 항체인 bevacizumab을 단독 혹은 기존의 항암화학요법과 병용하여 투여하는 대규모 임상시험이 진행 중에 있거나 일부는 이미 결과가 발표되고 있다(Table 3).
Bevacizumab과 항암화학요법의 병용요법을 항암화학요법 단독투여와 비교한 AVAGAST (Avastin in Gastric Cancer) 연구에서는 비록 생존기간의 의미 있는 차이를 증명하지는 못하였으나(12개월 vs. 10개월, p = 0.1002) 무진행생존기간(6.7개월 vs. 5.3개월, p = 0.0037)과 반응률(46% vs. 37%, p = 0.0315)의 의미 있는 향상이 관찰되었다[46]. 흥미롭게도 AVAGAST 연구에 참여한 미국인 환자의 경우에는 생존기간의 뚜렷한 차이가 관찰되어(11.5개월 vs. 6.8개월) 동서양 환자의 사이에 bevacizumab 효과의 차이 또는 이차요법의 차이가 있을 가능성이 제기되었다. 한편, 2010년에 미국 FDA와 유럽의 EMEA는 HER2 단백질이 과발현된 위암 환자에서 trastuzumab과 항암화학요법의 병용요법을 승인한 바 있다. 이는 ToGA (Trastuzumab for Gastric Cancer) 연구에서 HER2 과발현 위암 환자를 대상으로 도출된 trastuzumab의 추가가 생존기간을 의미 있게 향상시킨다는(13.8개월 vs. 11.1개월, p = 0.0046) 결과에 근거한 것이다[47]. ToGA는 전세계 24개국의(북미를 제외한) 연구자들이 참여한 대규모 3상 임상연구로 3,807명의 진행성 위암 환자를 대상으로 HER2 검사를 시행하여 HER2+인 594명의 환자를 등록하였다. 비록 전체 위암 환자의 약 20%만이 HER2+로 진단된다는 제한점이 있지만 ToGA 연구는 진행성 위암 환자의 중앙 생존기간이 1년을 넘어선 최초의 대규모 임상시험이기도 하다.
일차요법 이후의 항암화학요법
고식적 항암치료가 진행성 위암의 표준치료이긴 하지만 일차요법의 반응률이 50% 미만이며, 다행히 일차요법에 반응한 경우라 할지라도 거의 모든 환자는 얼마 지나지 않아 다시 병의 진행을 경험하게 된다[48]. 그간 위암의 이차 항암화학요법에 대한 수많은 소규모 임상시험이 시행되었고, 일부에서는 항암치료를 통해 생존기간의 연장뿐만 아니라 삶의 질의 향상도 보고한 바 있으나 최근까지도 그 효과를 입증한 대규모 임상시험은 없었다[12]. 폐암이나 대장암 등과는 달리 위암 환자에서는 복막전이가 흔히 동반되기 때문에 일차요법에 실패하는 경우 전신상태가 급격히 악화되는 경우가 많아 실제로는 20-50%의 환자만이 이차요법의 대상이 된다[49].
최근 출판된 독일의 3상 연구는 비록 환자 모집에 어려움을 겪어 총 40명만을 등록한 후 종료되긴 했으나 일차 항암요법에 실패한 환자에서 irinotecan 단독요법과 적극적 지지요법을 비교하여 생존기간의 의미 있는 차이를 보고하였다(4.4개월 vs. 2.6개월, p = 0.0027) [50]. 국내에서 시행된 또 다른 3상 임상시험에서도 이차 혹은 삼차요법을 받은 환자와 적극적 지지요법을 받은 환자의 생존기간이 각각 5.3개월과 3.8개월로 큰 차이를 보여(HR 0.657, 95% CI 0.485-0.891, p = 0.007) 항암화학요법에 실패한 위암 환자의 경우에도 추가적인 항암요법을 통해 생존기간의 연장을 기대할 수 있게 되었다(Fig. 3) [51]. 본 연구에서는 이차요법으로 docetaxel 또는 irinotecan 단독요법이 이용되었는데 두 가지 약제 사이에 효과나 부작용의 차이는 관찰되지 않았다. 따라서 위암의 일차요법이 실패한 경우라 할지라도 전신상태가 비교적 양호하고, 환자가 치료에 적극적인 의지를 보인다면 추가적인 항암화학요법을 통해 생존기간의 연장을 기대할 수 있을 것이다. 다만 아직 위암의 이차요법에서도 어떤 약제가 가장 효과적인지 연구된 바가 없고, 전신상태나 활동도가 저하된 환자의 경우 항암제의 독성이 문제될 수 있으며, 환자에 따라서는 추가적인 항암치료를 원하지 않을 수도 있으므로 이러한 측면의 연구가 더 필요할 것이다. 또한 일차요법의 경우와 마찬가지로 이차요법에서도 표적치료제를 이용한 임상연구가 활발하게 이루어지고 있으므로 향후 위암 환자의 예후는 더 호전될 여지가 있다.
결 론
위암의 완치를 기대할 수 있는 유일한 방법은 근치적 완전절제이나 상당수의 환자에서 진단 당시에 이미 수술이 불가능하고, 비록 수술이 성공적으로 행해진다 하여도 많은 환자가 재발을 경험하게 된다. 수술이 가능한 위암의 경우 치료성적을 향상시키기 위해 수술 전 또는 후에 항암치료(항암화학요법 및 항암방사선 치료)를 추가하는 것을 고려해야 하며, 근치적 절제가 불가능한 진행성 위암의 경우에는 고식적 항암화학요법을 통해 생존기간의 향상과 증상의 호전을 기대할 수 있다. 지금까지 기술한 바와 같이 최선의 위암 치료에는 수술, 방사선 치료 및 항암화학요법이 모두 적절하게 적용될 필요가 있으므로 다학제 간 협의를 통해 환자에게 가장 적절한 치료를 선택하는 것이 이상적이다. 진행성 위암 환자의 경우는 비록 표준 항암화학요법이 아직 정립되지는 못하였으나 치료성적은 점점 나아지고 있고, 새로운 약제들이 계속 개발되고 있으므로 현 시점에서 치료방침을 정하기 위해 반드시 고려할 내용은 다음과 같다. 1) 항암치료를 견딜 수 있는 활동도가 양호한 환자에서는 생존기간의 연장과 삶의 질 향상을 위해 고식적 항암화학요법을 반드시 고려해야 한다. 2) 5-FU와 cisplatin의 병용요법이 표준이며, 활동도가 양호하여 항암제의 독성을 견딜 것으로 기대되는 일부 환자에서는 epirubicin이나 docetaxel 등의 약제를 추가할 수 있다. 3) capecitabine, S-1 등의 약제가 5-FU를 대체할 수 있고, cisplatin 대신에 oxaliplatin으로 대체할 수 있다. (4) HER2 과발현 위암 환자에서는 trastuzumab의 추가가 효과적이며, 이외에도 여러 분자표적치료제가 위암에서 활발하게 시험되고 있다. (5) 일차요법에 실패한 경우에도 활동도가 양호한 환자라면 적극적인 이차 및 삼차 항암화학요법을 통해 생존기간의 연장을 기대할 수 있다.