진행성 위암 환자에서 1차 요법으로 FOLFOX-4 병합화학 약물치료의 효과와 안정성
FOLFOX-4 Combination Chemotherapy as a First-line Treatment in Patients with Advanced Gastric Cancer
Article information
Abstract
목적:
전이성 위암 환자들에서 1차 치료로서 투여된 oxaliplatin, 5-FU, leucovorin (FOLFOX-4) 병합화학요법의 효과와 안정성에 대하여 분석하였다.
방법:
2006년 8월부터 2009년 2월까지 조직학적으로 확진하고 절제가 불가능한 진행, 전이성 위암 환자 35명을 대상으로 의무기록을 통하여 후향적으로 조사하였다. Oxaliplatin 85 mg/m2과 leucovorin 200 mg/m2을 제1일에 2시간 동안 정주하였으며, 5-FU는 400 mg/m2을 bolus로, 600 mg/m2을 22시간 동안 지속 주입하는 방법으로 제1일과 2일에 투여하였다. 이상을 2주 간격으로 시행하였다. 반응률은 2 내지 3주기의 항암요법 시행 후 평가하였고, 부작용은 NCI CTC ver. 2.0을 기준으로 평가하였다.
결과:
총 35명 환자들의 총 생존기간 중앙값은 8.5개월(6.23-10.90개월)이었고, 반응지속기간은 4.5개월(0.38-9.75개월)이었다. 치료반응에서 완전관해는 없었고, 부분관해 19예(54.3%), 불변 13예(37.1%), 진행 3예(8.6%)였다. 전체 항암요법 298회 중 grade 3 이상의 백혈구 감소증은 5회(1.6%)였고, 호중구 감소증은 총 27회(9%)였다. Grade 3 이상의 빈혈은 4회(1.3%)였고, 혈소판 감소증은 10회(3.2%)였다. 호중구 감소증에 의한 감염이 있어 1명의 환자가 사망하였다. Grade 1-2 신경병증이 44회(14.7%)에서 나타났다.
결론:
FOLFOX-4의 병합화학요법은 수술을 할 수 없는 진행성 위암 환자들에 대한 1차 요법으로 높은 반응률을 보이면서 독성이 약한 비교적 안전한 치료법이다.
Trans Abstract
Background/Aims:
This study examined the efficacy and safety of oxaliplatin-5-fluorouracil-leucovorin (FOLFOX-4) combination chemotherapy as first-line treatment in patients with advanced gastric cancer.
Methods:
This retrospective study enrolled 35 patients diagnosed with pathologically proven surgically unresectable gastric cancer who received FOLFOX-4 combination chemotherapy between August 2006 and February 2009, using medical records. The administered dose of oxaliplatin was 85 mg/m2 for 2 hrs and leucovorin 200 mg/m2 for 2 hrs on day 1, 5-fluorouracil 400 mg/m2 as a bolus and 5-fluorouracil 600 mg/m2 for 22 hrs on days 1 and 2, every 2 weeks. The response was assessed every three cycles. Toxicity was evaluated for every course of chemotherapy according to the NCI toxicity criteria ver. 2.0.
Results
The median patient age was 61 (range 27-77) years. The median overall survival was 8.50 (6.23-10.90) months and the median time to progression was 4.50 (0.38-9.75) months. With FOLFOX-4, there was no complete remission and 19 partial responses, for a response rate of 54.3%. Over 298 cycles, anemia worse than NCI toxicity grade 3 occurred in 1.3%, leukopenia in 1.6%, neutropenia in 9%, and thrombocytopenia in 3.2%. Grade 1-2 neuropathy occurred in 14.7% of the cycles. Neutropenic fever occurred in two cycles and the regimen was changed because of side effects in one cycle.
Conclusions:
FOLFOX-4 has a very high response rate with mild toxicity in patients with advanced gastric cancer as a first-line treatment. (Korean J Med 2012;82:37-44)
서 론
진행성 위암의 경우 보존적 치료(best supportive care)만 시행한 경우보다 항암화학요법(palliative chemotherapy)을 시행한 경우에 생존기간 및 삶의 질이 의미 있게 향상된다는 것은 이미 잘 알려져 있다[1-3]. 1970년대 이후 현재까지 치료반응이 더 좋은 항암요법을 찾기 위한 연구들이 계속되고 있으나 아직도 대부분의 경우 중앙생존기간이 6-9개월에 불과하며, 어떤 약제 또는 어떤 조합이 가장 효과적인 표준치료법인지 확실히 밝혀지지 않은 실정이다[4-6].
Oxaliplatin은 3세대 알킬화약물(alkylating agent)에 해당하는 백금복합제제(platimun-based drug)로 guanine과 결합하여 DNA복제를 억제한다. Oxaliplatin은 cisplatin 저항성의 대장암 세포 중에서 효과가 있음이 증명되었고, 5-FU와 병용할 때 시너지 효과가 있음이 입증되어[7], oxaliplatin, 5-FU, leucovorin (FOLFOX)의 병용요법은 전 세계적으로 대장암 치료의 1차 항암요법으로 인정되고 있다[8-10]. 최근에는 여러 연구들을 통하여 위암에서도 oxaliplatin을 기본으로 한 병용요법이 40-50%의 반응률을 보여 위암을 1차 항암요법으로도 널리 사용되고 있다[11-15].
이번 연구에서는 고신대학교 복음병원에서 수술 절제가 불가능한 전이성 위암 환자들에 대하여 1차 항암요법으로 시행한 FOLFOX-4 병합화학요법의 치료효과와 안정성에 대하여 분석하고 지금까지 발표된 FOLFOX-4를 1차 항암요법으로 시행한 국내 자료들과 비교해 보고자 한다.
대상 및 방법
대상
이번 연구의 대상은 2006년 8월부터 2009년 2월까지 고신대학교 복음병원에서 병리조직학적으로 선암(adenocarcinoma)이 확진되고, 진단 당시 근치적 절제가 불가능한 진행성 위암으로 진단받은 환자 중에 1차 요법으로 FOLFOX-4 병합화학요법을 받은 35명의 환자들로 하였다. 대상 환자의 선정 기준은 18세 이상이고 ECOG (Eastern Cooperative Oncology Group) 기준으로 활동도가 0-2에 해당하는 자로 검사실 소견에서 백혈구 수치가 4 × 109/L 이상, 혈소판 수치는 100 × 109/L 이상이고 혈청 빌리루빈이 2.0 g/dL 이하, 간기능 검사상 AST/ALT 수치가 정상범위의 3배 이하이며, 신기능 검사에서 혈중 요중 크레아티닌 청소율이 50 mL/min 이상인 환자들을 대상으로 하였다. 모든 환자들은 치료 전 동의서를 받았으며, 이 연구는 의무기록을 통한 후향적 조사로 이루어졌고 윤리 규정을 준수하였다.
치료 방법 및 약물 용량 조절
Oxaliplatin은 제1일에 체표면적(body surface area, BSA)당 85 mg을 2시간 동안 정주하였으며, leukovorin은 제1일에 BSA당 200 mg을 2시간 동안 정주하였다. 5-FU는 BSA당 400 mg을 일시주입(bolus)으로, BSA당 600 mg을 22시간 동안 지속 주입하는 방법으로 제1일과 2일에 투여하였다. 이상의 약물요법을 2주 간격으로 시행하였다.
항암치료 1주일째와 항암치료 전날 혈액 검사를 시행하여 절대 호중구 수치가 1,500/mm3 미만일 경우 granlocyte colony- stimulating factor (G-CSF)를 투여하였고, 혈소판 100,000/mm3 이하, 호중구 1,500/mm3 미만, 비혈액학적인 합병증이 심할 경우 항암치료를 연기하였다. 발열이 동반된 호중구 감소증이 있거나, NCI-CTC (National Cancer Institute Common Toxicity Criteria) grade 3 이상의 호중구 감소증, 혈소판 감소증이 3일 이상 지속되거나, ECOG 2 이상의 전신 상태가 안 좋은 경우 다음 번 주기에서 모든 약물을 용량을 20-25% 감량 후 항암치료를 지속하였다.
치료 효과의 판정 및 독성 평가
대상 환자는 치료 시작 전에 병력조사, 신체 검진, 일반혈액 검사, 간 및 신기능 검사, 심전도 검사, 흉부방사선 검사, 위내시경 검사, 대장내시경 검사, 복부전산화 단층촬영으로 전이 병소의 위치, 범위, 진행 정도를 결정하였다. 매 치료 시작 전에 신체 검진 및 흉부방사선 검사, 일반혈액 검사와 일반화학 검사를 시행하였다.
복부 전산화 단층촬영은 3주기 후 실시하였고, 진행이 의심되는 경우 2주기 후에 실기하기도 하였다. 반응 판정은 WHO 기준에 따라 완전반응(complete remission, CR), 부분반응(partial remission, PR), 불변(stable disease, SD), 진행(progressive disease, PD)으로 구분하여 평가하였다. 이때 뚜렷한 전이 병변이 있을 경우에는 전이 병변 또는 림프절을 기준으로 하였고, 측정 가능한 전이성 병변이 없는 경우에는 위 병변으로 계측하였다. 반응률(response rate)은 완전반응과 부분반응의 합으로 정의하였고, 질병통제율(disease control rate)은 완전반응, 부분반응, 불변의 합으로 정의하였다.
총 생존기간(overall survival time)은 진단일부터 사망한 날 또는 생존한 경우 마지막 내원일까지로 정의하였고, 무진행생존기간(time to progression, TTP)은 항암화학요법 시작일부터 악화 또는 사망일, 악화되지 않은 경우에는 마지막 내원일까지로 정의하였다. 독성은 매 주기마다 평가하였으며, NCI CTC (National Cancer Institute Common Toxicity Criteria) version 2.0을 기준으로 하였다.
통계 분석
통계 분석은 SPSS ver. 17.0을 사용하였으며, 무진행 생존기관과 총 생존기간은 kaplan-Meier method를 이용하여 평가하였고 log-rank test를 사용하여 검정하였다.
결 과
연구 대상의 특성
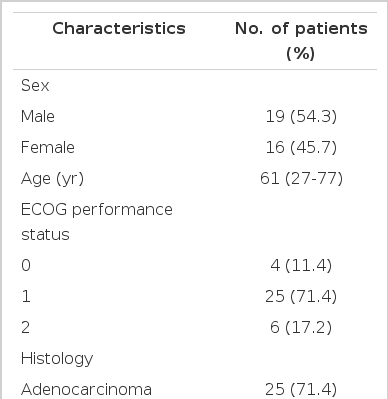
총 35명의 환자 중 남자 19명, 여자 16명이었고, 대상군의 중앙값은 61세(범위 22-77세)였다. 환자들은 전신 상태는 ECOG 기준으로 0-2에 해당하였고, 간 전이와 복막전이가 11명, 림프절 전이가 8명, 폐와 뼈전이가 각각 2명이었다. 두 곳 이상의 전이를 보인 환자는 10명이었으며 세포 분화도에 따라 구분하였을 때 반지 세포형은 9명(29.7%)이었다(Table 1). 총 35명의 환자의 항암요법은 298회 시행되었고, 평균 8.5회(3-21회)의 항암화학요법을 받은 것으로 나타났다.
치료 반응
환자들의 치료 반응에서 완전관해는 한 명도 없었고, 부분관해 19예(54.3%), 불변 13예(37.1%), 진행 3예(8.6%)였다. 반응률은 54%였고, 질병 통제율은 91%였다(Table 2). 총 35명의 환자들의 총 생존기간의 중앙값은 8.5개월(6.23-10.9개월)이었고, 반응 지속기간은 4.5개월(0.38-8.75개월)이었다(Fig. 1A and 1B).
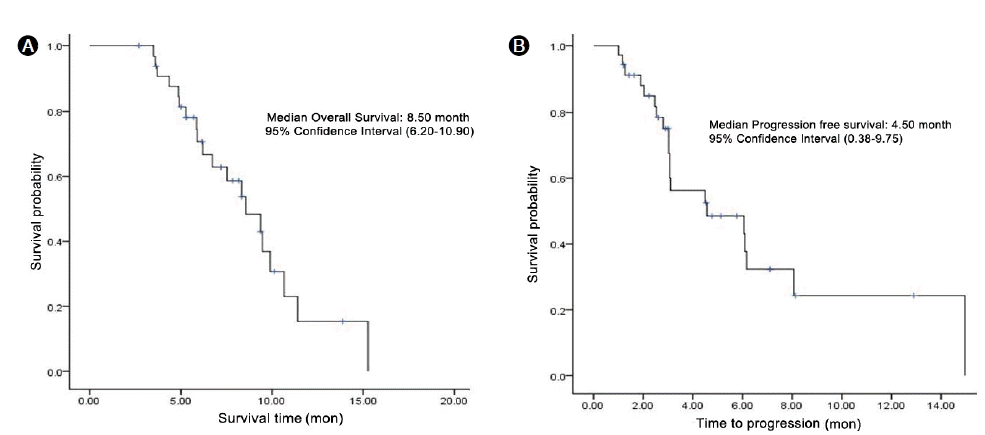
Overall survival and progression free survival of the patients after FOLFOX-4 combination chemotherapy. (A) The median overall survival was 8.5 months. (B) The median time to progression was 4.5 months.
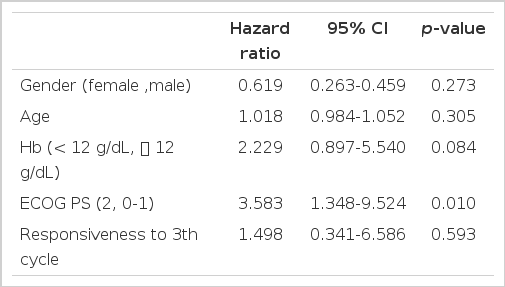
세포의 분화도에 따른 생존 기간과 반응 지속기간은 선암형의 경우 9.3개월, 6.0개월이었고 반지 세포형의 경우 8.3개월, 6.3개월로 나타났으나 통계적 유의성은 없었다(p= 0.87). 치료 반응에 대한 예측인자를 알기 위해서 나이와 성별, ECOG PS (Eastern Cooperative Oncology Group Performance Status), 혈색소, 이전 항암에 대한 반응성을 가지고 다변량 분석을 시행하였다. 분석결과 ECOG PS가 높을 수록 예후가 좋지 않았다(p= 0.002, Table 3).
부작용
전체 항암요법 298회 중 grade 3 이상의 빈혈은 4회(1.3%)였고, 백혈구 감소증은 총 5회(1.6%)였다. Grade 3 이상의 호중구 감소증은 27회(9.0%)였고, 혈소판 감소증은 10회(3.2%)였다. 발열이 동반된 호중구 감소증가 2회 있었고 G-CSF 투여 이후 회복되어 약제의 변경은 없었으나 1명의 환자에서는 감염에 의한 합병증으로 사망하였다. 1명의 환자에서 Grade 2-3의 혈소판 감소증이 7회 발생하여 약제 변경이 있었다. 비혈액학적인 독성으로 Grade 1-2의 오심과 구토가 69회(20.3%)로 가장 흔한 합병증이었고, Grade 1-2의 신경병증이 44회(14.7%)에서 나타났다.
고 찰
위암은 조기에 발견될 경우 90% 이상의 완치를 기대할 수 있지만 진행성 혹은 전이성(locally advanced or metastatic) 병기로 진단되면 항암 치료를 받는다 하더라도 2년 후에는 약 10% 정도의 환자만이 생존하게 되어 매우 불량한 예후를 보인다[16]. 위암의 치료에서 여러 조합의 병합화학요법이 시행되고 있고 대부분 30-50%의 부분관해를 보이며 이러한 경우 항암화학요법의 효과가 입증되고 있지만 완전관해를 얻는 경우가 매우 드물고 반응군의 효과도 일시적이기 때문에 좀 더 효과적인 항암화학요법에 대한 연구가 필요하다.
이번 연구에서는 현재 주목 받고 있고 활발하게 쓰이고 있는 oxaliplatin을 기본으로 한 FOLFOX 병합화학요법의 안정성과 효용성에 대해서 알아보고자 하였다. 연구는 의무기록을 바탕으로 후향적으로 진행하였다. 국내에 FOLFOX-4 병합요법을 1차 항암요법으로 시행한 경우가 없어서 국외의 논문들과 비교하여 치료 반응률과 합병증의 발생률의 차이를 조사하였다[12,13]. 이번 연구에서는 FOLFOX-4 병합화학요법을 시행하였던 다른 두 연구에서 비해서 치료 반응률의 경우는 54%로 높게 나왔으나 총 생존기간과 반응 지속시간의 경우에는 각각 8.5개월, 4.5개월로 외국의 두 연구에 비해서 짧은 것으로 나타났다. 합병증의 경우 신경 독성과 오심의 경우 두 연구에 비해서 적게 나타났다(Table 4). 결론적으로 같은 용량으로 치료한 본 연구와 외국의 연구를 비교하였을 때 생존기간과 반응 지속시간은 짧았으나 합병증의 경우는 적게 발생하였다. FOLFOX-4 병합화학요법에 대한 국내 환자의 반응률과 합병증에 대한 더 많은 대단위의 연구가 필요할 것으로 생각된다.
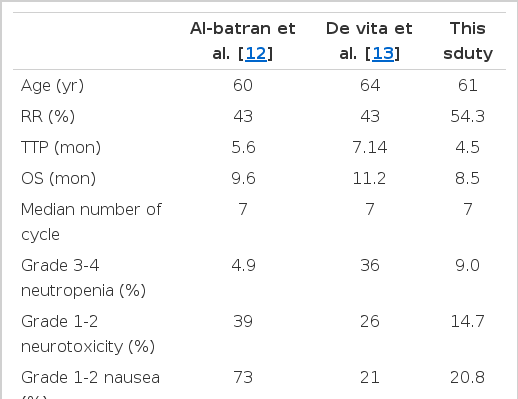
Summury of the efficacy and toxicity of oxaliplatin, LV, and 5-FU regimens as first-line chemotherapy
현재까지 oxaliplatin을 기본으로 한 항암치료를 위암에 대한 1차 치료로 한 결과를 발표한 국내자료들을 검색하여 이번 연구결과와 비교하였을 때 다른 연구들은 모두 modifiedFOLFOX-6에 대하여 조사한 반면 본 연구는 FOLFOX-4 요법에 대하여 조사하였다(Table 5) [17-19]. 다른 연구결과에서 약 40-44%의 치료 반응률을 보인 것과 비교할 때 본 연구의 치료 반응률은 54%로 비교적 높은 편이다. 이는 다른 연구에서 수술 후에 보조항암요법을 시행한 후 재발하였던 군을 포함하였으나 이번 연구에서는 치료한 적인 없는 환자만을 대상으로 하였던 것에 의한 차이로 보인다. 그러나 이번 연구와 김 등[18]의 연구에서는 WHO criteria를 사용하였고, 다른 연구들에서는 RECIST criteria를 사용하였다는 차이가 있으며, 최 등[17]의 연구는 65세 이상의 노인들을 대상으로 하는 환자군의 특성 차이도 있어 이러한 단순 비교에는 제한점이 있을 것으로 보인다. 그러나 oxaliplatin을 이용한 병합화학요법들은 대부분 좋은 효과를 보고하고 있다. 이번 연구에서 총 생존기간과 무진행 생존기간은 8.5개월, 4.5개월로 Modified FOLFOX-6를 시행하였던 연구에 비해 조금 낮은 편인데 이는 다른 연구과 달리 수술 후 재발한 환자를 포함하지 않았던 것과 항암제에 용량의 차이에 의한 반응률의 차이를 고려 할 수 있을 것이다. 하지만 이번 연구와 Modified FOLFOX-6 병합화학요법을 시행하였던 강 등[17]의 치료 반응률의 차이가 없었던 점과 국외 FOLFOLX-4 병합화학요법의 경우 Modified FOLFOX-6 병합화학요법을 시행한 국내 다른 연구와 치료 반응률에서 차이가 없었던 점에서 국내의 환자에서 두 병합화학요법 간의 치료 반응률의 차이에 대한 연구가 더 필요할 것으로 생각된다.
위암의 전통적인 항암제는 5-FU로 단독 사용시 21%의 반응률을 보이고 있으나 다른 약제와 병합시 반응률을 증가시키고 생존기간을 연장시키는 것이 입증되어 현재는 2-3제 이상의 약제들을 동시에 사용하는 병합화학요법이 위암치료의 원칙이 되었다[6]. 1990년대 후반부터 다양한 항암제가 개발되면서 taxen (paclitaxel, docetaxel), irinotecan, oxaliplatin, 경구 5-FU 제제인 capecitabine, S-1 등이 위암의 치료에 사용되고 있다. 특히 doxetaxel을 이용한 DCF요법은 50-60%의 반응률을 보이며 생존률의 향상을 보여주어 위암치료에 좋은 약물로 인정되고 있으나, 호중구 감소증 등의 심한 부작용 때문에 실제 임상에서는 그 용법대로 사용하지 못하며, 고령이나 환자의 전신상태가 불량한 경우에 사용하지 못하는 제한점이 있다[20,21].
Oxaliplatin은 비교적 골수억제 작용이 강하지 않아 국내와 국외에서 고령의 환자들을 대상으로 한 연구들이 이루어지고 있다[14,15]. 이번 연구에서는 Grade 1-2의 호중구 감소증은 3.0%, Grade 3 이상의 심한 호중구 감소증은 9%에서 발생하였다. 이는 10-24%를 보인 다른 연구들에 비해서 낮은 결과인데 이것은 oxaliplatin의 용량이 85 mg/m2으로 다른 연구들에 비하여 적기 때문인 것으로 보인다(Table 5). 실제로 이번 연구와 같은 용량의 oxaliplatin을 사용한 연구[14]에서도 grade 3 이상의 호중구 감소증은 6.8%로 낮은 결과를 보였다.
비혈액학적 합병증에서 오심과 구토가 흔한 합병증으로 나타났는데 다른 연구들과 발생률을 비교하였을때 오심의 경우 26-73%까지 다양하게 나타났으나 본 연구의 경우 14.8%로 비교적 적게 나타났는데 이는 oxaliplatin과 5-FU의 투여용량과 주입방식의 차이로 생각이 된다.
Oxaliplatin은 용량에 따라 누적 효과를 보이면서 가역적인 말초신경병증의 부작용을 보이는데 모든 연구에서 Grade 3 이상의 심한 신경병증을 보이는 경우는 거의 없었다. 이번 연구에서 Grade 1-2의 신경병증은 17.4%로 나타났고 다른 연구에서는 6-44%까지의 다양한 정도로 나타났는데 이는 대부분의 연구가 의무기록을 바탕으로 한 후향 연구였기 때문에 합병증에 대한 기록이 누락되었을 가능성이 있어 신경병증이 적었다고 단정 짓기는 어렵다.
결론으로 FOLFOX-4의 병합화학요법은 진행성 위암 환자들에 대한 1차 요법으로 비교적 높은 반응률을 보이며, 비교적 부작용이 적어 효과적이면서도 안전한 치료법이다. 위암 치료에 대한 다양한 항암요법들이 국내의 환자들에 대하여 적용되고 있으며 가장 적절한 항암제와 그에 대한 용량과 용법이 무엇인지에 대하여 지속적인 연구가 필요하다.