급성 신손상: 감별진단 및 New Biomarker
Acute Kidney Injury: Differential Diagnosis and New Biomarker
Article information
Trans Abstract
Incidence of acute kidney injury (AKI) is increasing and despite advances in supportive care, mortality from AKI in critically ill patients still exceeds 50%. Major causes of AKI can be classified into prerenal, renal and postrenal AKI and many of prerenal or ischemic acute tubular necrosis (ATN) are caused by decreased renal blood flow. In addition, exposure to nephrotoxicant or diverse drugs can lead to AKI and diseases that affect larger renal vessels, glomeruli, or renal microvasculature are also other causes of AKI. Because type of renal injury or initiation of proper therapy in setting of AKI is important in determining patient prognosis, differential diagnosis utilizing patients history, physical examination, and laboratory data including urinalysis, urine diagnostic indices, radiologic examination is important. Lack of sensitive biomarkers for early detection of AKI, which resembles troponin in acute myocardial infarction is one critical factor that has hampered the successful translation of various therapeutic strategies that were effective in animal research. However, over the last decade, efforts to identify and validate novel urine or plasma biomarkers in AKI led to identification of several promising biomarkers including neutrophil gelatinase associated lipocalin (NGAL), interleukin-18 (IL-18), cystatin-C and liver type fatty acid binding protein (L-FABP). Although far from replacing serum creatinine in clinical practice yet, data from large clinical studies are promising and here I briefly reviewed the characteristics of them and possible clinical utility in AKI. (Korean J Med 2012;82:5-10)
급성 신손상의 감별진단
급성 신손상은 허혈성 손상, 신독성 약제 외에도 신혈관 질환, 급성 사구체 신염, 결체조직 질환에서의 신장 침범 등의 다양한 원인에 의해 발생할 수 있으며 원인 질환에 따른 치료법 및 예후가 다양하고 조기에 치료를 시작하는 것이 신장의 비가역적 손상을 막고 신기능을 보존하는데 있어 매우 중요하므로 원인 질환에 대한 감별진단이 매우 중요하다. 급성 신손상의 감별진단에서 가장 기본이 되는 것은 환자의 병력청취 및 신체 검사 소견, 요검사를 포함하는 검사실 검사소견과 복부초음파 검사 등의 방사선학적 소견이다.
병력 및 신체 검사 소견
최근 고혈압, 당뇨 등 만성 신장병의 원인이 될 수 있는 질환의 유병률이 증가함에 따라 급성 신손상을 만성 신장병과 감별하는 것 또한 매우 중요하며, 자세한 병력 청취를 통해 급 만성 신손상 및 급성 신손상의 원인 질환에 대한 결정적인 도움을 얻게 되는 경우가 많이 있다. 자세한 병력을 청취해 보면 급성 신손상은 원인이 될만한 사건(event), 예를 들어 구토, 설사, 금식 등으로 인한 탈수로 신장혈류가 감소될 수 있을 만한 병력이 있는 경우가 있으면서 전신탈수 상태를 반영하는 신체상 변화가 있는 경우가 많다. 또한 관절염 혹은 관절통이 있는 사람에서 연관된 결체조직 질환(전신성 홍반성 낭창)이 급성 신부전의 원인인 경우가 있으며, 혹은 관절통을 완화시킬 목적으로 복용한 비스테로이드성 소염진통제(nonsteroidal anti-inflammatory drug, NSAID)가 급성 간질성 신염을 일으키거나 기존의 만성 신장병을 악화시키는(acute on chronic) 경우도 있다. 그 외에도 심한 간경변증의 과거력이나 심한 복수, 황달이 있는 환자에서는 비가역적인 간신증후군이 급성 신손상의 원인일 수 있으며, 동맥경화증이 심한 환자에서 혈관조영술 후 급성 신손상이 발생하였다면 조영제에 의한 급성 신손상 혹은 cholesterol 색전증에 의한 급성 신손상의 가능성 모두를 생각해 볼 수 있다. 또한 급성 신손상 환자에서 철저한 신체 검사가 중요하며, 특히 체내의 용적상태(volume status)를 평가할 수 있는 검사, 예를 들어 경정맥 상태, 기립성 저혈압의 유무, 액와부 발한 여부 등은 쉽게 시행할 수 있는 신체 검사이다(Table 1).
검사실 검사 소견
요 검사 소견
외래나 응급실에서 손쉽게 할 수 있는 요검사 소견은 급성 신손상의 감별진단에 도움을 주는 경우가 많다. 특히 신장 질환은 요검사를 통해 쉽게 진단에 접근할 수 있어서 초기의 감별진단에 용이하지만, 환자에게 수액 치료나 이뇨제 치료 등을 시행하는 경우에는 원래 질병에서 나타났던 양상과 틀리므로 주의한다. 표 2에서 여러 가지 요검사 소견을 통해서 원인 질환을 감별하는 방법을 알 수 있다. 그러나 최근에는 만성 신장병이 기존에 있는 상태에서 급성 신손상을 받는 경우가 많아 해석에 혼란을 주기도 한다.
요 화학 검사 지표
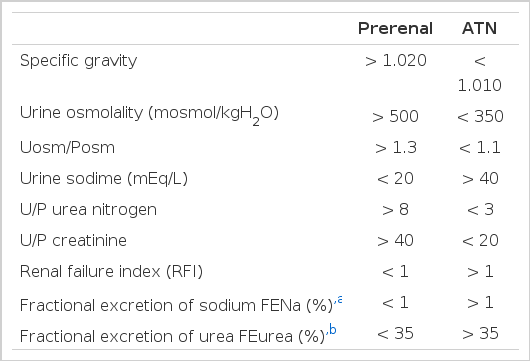
급성 신손상이 있는 환자의 요를 채취하여 시행하는 요 화학 검사는 감별진단에 아주 유용한 정보를 제공한다. 요중 소디움 농도, 요 비중, 요 삼투압 등의 검사는 환자의 세뇨관이 제대로 기능하고 있는 지를 알아보는 검사이다. 세뇨관 기능이 정상적으로 작동하는 신전성 급성 신손상의 경우에는 요의 농축과 함께 세뇨관에서 소디움의 재흡수가 활발히 일어나는 것이 요 검사상 반영된다. 이와 같은 검사에서 유용한 정보를 얻기 위해서는 환자가 도착한 즉시 어떤 처치도 하지 않은 상태에서 검사를 시행해야 한다. 특히 수액 투여, 이뇨제 등이 사용되지 않은 상태이어야 하며, glucose, contrast agent, carbenicilline 등 항생제가 요 중에 존재하는 경우에도 결과가 틀리게 나올 수 있다는 것을 알고 있어야 한다. 또한 기존의 기저질환, 특히 만성 신장병이 있는 경우에는 해석이 틀려질 수 있다. 아래 표에서 열거한 지표 중 renal failure index 및 FENa가 가장 유용한 지표이다. 그러나 bicarbonaturia, 염분소실이 있는 만성 신장병, 부신 기능 저하가 있을 경우 신전성 급성 신손상에서도 FENa가 1% 이상일 경우가 많으며 반대로 신후성 급성 신부전, 급성 사구체 신염 및 혈관염에서는 신전성 신손상이 아님에도 불구하고 FENa가 1% 미만으로 나오는 경우도 있음을 알고 있어야 한다.
방사선학적 검사
신장 초음파 검사
신장의 크기를 측정함으로서 많은 경우에 양측성으로 신장의 크기가 감소되어 있는 만성 신장병과의 감별에 도움을 받을 수 있다. 대부분의 급성 신손상에서는 크기가 정상이거나 혹은 약간 커져 있다. 특히 신후성 급성 신손상에서 관찰되는 양측 신장의 수신증은 진단에 결정적인 도움이 되며, 최근에 실시되고 있는 doppler를 이용하면 신 혈류 상태도 평가 할 수 있다.
DTPA 신 스캔
DTPA를 이용한 신 스캔을 통해서 신 혈류를 파악할 수 있고, 신 혈관 상태를 평가할 수 있다. 급성 신손상에서 통상적으로 3주가 지난 뒤에도 이뇨가 일어나지 않고 신기능이 회복 되지 않는 경우에 신 스캔을 시행하여 예후를 결정하기도 한다. 급성 신손상의 초기에 시행한 신 스캔상 신장내 관류가 좋은 경우에는 대부분 예후가 양호하여 신기능이 회복되는 경우가 많다.
갈륨 스캔(gallium 67 scan)
Gallium 스캔 검사로 급성 뇨세관 괴사와 간질성 신염을 감별할 수 있다. 세뇨관 괴사의 경우에는 음성이나 급성 간질성 신염에서는 양성으로 나타난다. 그 외 신우신염, crescenetic GN에서도 양성으로 나타날 수 있다.
신혈관 촬영
신동맥 또는 신정맥 촬영이 유용한 정보를 주는 경우가 있으나 조영제로 인한 손상이 올 수 있어 주의를 요한다. 신좌상(renal trauma), 신혈관 폐색, 다발성 동맥염(polyarteritis nodosa), 신정맥 혈전증 등의 진단에 유용하다.
그 외 검사
역행성 신우 촬영(retrograde pyelography)과 경피 신루 설치술(percutaneous nephrostomy), 하행성 신우 촬영술(antegrade pyelogrophy) 등은 요로 폐색을 진단하는데 유용한 방법으로 조영제로 인한 신손상을 피할 수 있다. 특히 신후성 급성 신손상의 경우 경피적 신루설치술을 시행함으로서 급성 신손상의 진행을 막고 신장기능의 회복을 기대할 수 있다.
급성 신손상과 새로운 Biomarker
최근 급성 신손상은 주로 중환자실에 입원하는 환자에서 패혈증 등으로 야기된 다장기 부전(multiple organ dysfunction syndrome)의 형태로 나타나며 이들 환자의 사망률은 동물모델을 이용한 급성 신손상의 병태생리기전에 대한 이해, 지속적 신대체 요법 등 지지적 치료법의 기술적 발달에도 불구하고 50% 이상으로 매우 높은 실정이다[1,2]. 아직까지 임상적으로 급성 신손상을 진단하는데 있어 혈청 요소질소나 크레아티닌의 상승에 의존하고 있으나, 크레아티닌은 잘 알려져 있다시피 손상의 종류(type), 시기(onset), 진행(propagation) 혹은 회복(recovery) 등의 급성 신손상의 핵심적 요소를 예측하고 평가하는데 전혀 도움을 주지 못한다. 이렇듯 급성 신손상에서 적절한 biomarker의 부재는 다양한 실험적 치료법의 임상으로의 성공적 translation을 방해하고 있는 가장 큰 요소가 되고 있다. 그러나 지난 십 여년간 급성 신손상에서 유용한 새로운 biomarker를 찾아내고, 나아가 이들의 임상적 유용성을 입증하기 위한 수많은 연구가 진행되어 왔고 그 중 일부는 임상에서 실제로 이용되고 있기도 한 실정이다. 비교적 잘 알려져 있는 급성 신손상의 몇 가지 새로운 biomarker에 대해 간단히 review하고자 한다. 멀지 않은 미래에 급성 신손상의 조기진단 및 예후 예측에 크레아티닌을 대신하여 새로운 biomarker가 쓰일 수 있으리라 생각된다.
Neutrophil gelatinase associated lipocalin (NGAL)
중성구에서 발견되는 25 kDa의 단백질로서 허혈성 손상 후에 신장의 근위, 원위 세뇨관에서 발현이 증가되며 혈장 및 소변에서 발견된다[4]. 소아 및 성인 심장 수술 후 발생하는 급성 신손상에서 크레아티닌보다 더 일찍 상승하여 급성 신손상을 조기에 진단하는데 유용한 것으로 잘 알려져 있으며[5,6], 또한 신장이식수술 후 이식신 지연기능(delayed graft function)의 조기진단에도 유용하다[7,8]. 조영제 사용 후 발생하는 급성 신손상의 조기진단 및 간 이식수술 후 발생하는 수술 후 급성 신손상의 조기 발견에도 유용함이 보고된 바 있다[9,10]. 최근 연구에 의하면 급성 신손상의 조기진단 외에도 급성 신손상의 회복 및 장기예후의 예측에도 유용할 수 있을 것으로 생각된다[11]. 혈장 NAGL의 경우 Alere사의 Triage® NGAL Test는 국내 일부 병원의 응급실에서 측정 가능하다.
Interleukin-18
IL-1 superfamily에 속한 염증성 싸이토카인으로 신장 손상 후 근위 세뇨관 외에 대식세포, 수지상 세포 등의 염증세포에서 발현이 증가하며 혈장 및 소변에서 검출된다. 다른 종류의 신손상에 비해 확립된 세뇨관 괴사(established ATN)환자의 소변에서 IL-18치가 증가되며, 2005년에 발표되었던 중환자실에 입원한 급성 호흡부전 환자(acute respiratory distress syndrome network trial)를 대상으로 한 연구에서 소변 중 IL-18이 이들 환자에서 급성 신손상의 조기 진단 외에 사망을 예측할 수 있는 독립적인 인자로서 유용함이 알려져 있다[7,8,12].
Liver type fatty acid binding protein (L-FABP)
주로는 간세포에서 생성되나 신장 손상 후 근위 세뇨관에서 발현이 증가되며 소변 중에 발견된다. 현재까지 급성 신손상에서의 임상연구 결과는 NGAL이나 IL-18의 경우보다는 미약하나 최근 연구결과에 따르면 소변 중의 L-FABP가 증가한 것이 급성 신손상을 동반한 패혈증 환자에서 사망을 예측할 수 있는 독립적인 인자임이 밝혀졌고[13] 또한 중환자실에 입원하여 치료받은 환자에서 소변 중의 NGAL과 함께 급성 신손상의 진단 및 사망률 예측에 유용한 biomarker 임이 보고된 바 있다[14].
Cystatin C
모든 유핵세포에서 생성되는 13 kDa의 cystein protease inhibitor로서 사구체를 통해 여과된다. 크레아티닌과는 달리 세뇨관 세포에서의 modification이 없으며 근육, 성별, 나이 등에 의해 영향을 받지 않는다는 장점이 있으나 갑상선 기능이상이나 glucocorticoid에 의해 영향을 받을 수 있다는 것이 단점이다. 심장수술 후, 중환자실 입원 환자 및 조영제에 의한 급성 신손상의 조기 진단에 있어서 모두 크레아티닌 보다 우월한 것으로 보고된 바 있다[15-18].
Kidney injury molecule-1 (KIM-1)
Kidney injury molecule-1 (KIM-1)은 immunoglobulin과 mucin domain을 가지는 type 1 transmembrane glycoprotein으로 정상 신장 및 소변에서 검출되지 않으나 허혈 혹은 신독성 물질에 의한 급성 신손상에서 탈분화된 근위 세뇨관(dedifferentiated proximal tubule)에서 발현이 증가된다[19]. 혈청 creatinine보다 조기에 급성 신손상을 진단할 수 있으며 또한 급성 신손상 환자에서 신대체 요법 및 사망 등의 예후를 예측하는데도 유용한 것으로 보고된 바 있다[20].
결 론
이상에서 몇몇 새로운 biomarker의 특성 및 현재까지 알려진 연구 결과에 대해 간략히 살펴보았으나 아직 급성 신손상의 진단 및 예후 예측에 기존의 크레아티닌을 대신하여 임상적으로 널리 쓰이고 있는 biomarker는 없다. 새로 개발되어지는 biomarker가 임상적 유용성을 획득하기까지는 이러한 biomarker가 단지 우수한 정확도와 신뢰도를 가지고 질환의 조기진단 및 예후 예측에 유용하다는 것으로 충분하지 않으며 궁극적으로 이들 biomarker를 통해 얻는 정보가 환자의 임상적 예후를 개선시키는데 결정적 역할을 할 수 있는가가 중요할 것이다. 예를 들면 어떤 종류의 biomarker가 증가되어 있는 것이 신대체 요법이 필요하게 될 고위험 환자를 가려내는 데 유용한지 혹은 치료적 intervention에 대한 반응 정도를 평가하는데, 혹은 환자의 장기 예후를 예측하는데 도움을 줄 수 있어야 한다는 것이다. 다양한 특징을 가진 보다 더 많은 수의 환자를 대상으로 하는 지속적인 임상연구가 필요한 실정이다.