제1형 신경섬유종증 환자에서 신경내분비종양과 위장관기질종양 2예
Two Cases of Neuroendocrine Carcinoma and GIST in a Patient with Neurofibromatosis Type 1
Article information
Abstract
제1형 신경섬유종증 환자에서 신경내분비종양과 위장관기질종양의 발생률이 일반인구에 비해 높다는 것은 잘 알려져 있지만 이들이 함께 발병한 경우는 전 세계적으로도 보고된 증례들이 매우 드물며 국내에서는 저자들이 알기에는 아직 보고된 바가 없다. 이에 저자 등은 제1형 신경섬유종증 환자에서 비기능성 고분화 신경내분비종양과 위장관기질종양이 함께 발생한 2예를 경험하여 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Patients with neurofibromatosis type 1 (NF1) are at increased risk of developing tumors throughout the gastrointestinal tract, including neuromas, gastrointestinal stromal tumors (GISTs), and periampullary somatostatin-rich carcinoids. The simultaneous occurrence of a GIST and a well-differentiated neuroendocrine carcinoma in a patient with NF1 is very rare. Here, we report two cases of the coexistence of a low-risk GIST in the jejunum with a well-differentiated neuroendocrine carcinoma in the duodenum in patients with NF1. These cases strengthen the known association of GIST with neuroendocrine carcinoma in patients with NF1. (Korean J Med 2011;81:786-791)
서 론
제1형 신경섬유종증(neurofibromatosis)은 유전성 전신질환으로 골조직, 연부조직, 신경계, 피부 등에 다양한 임상증상을 보이는데, 담갈색 반점(café-au-lait spots), 겨드랑이나 사타구니의 주근깨, 리쉬 결절(lisch nodules) 등이 나타나는 것을 특징으로 하며 발생 빈도는 약 3,000명 당 한 명 정도로 알려져 있다[1,2]. 제1형 신경섬유종증은 드물게 소화기계의 양성 또는 악성 종양의 발생과 연관이 있는 것으로 알려져 있으며, 위장관기질종양(gastrointestinal stromal tumor, GIST)이 3-25%에서 발생하는 것으로 보고되고 있으나[3], 신경내분비종양과 동시에 발병되는 경우는 드문 것으로 알려져 있다.
이에 저자들은 신경섬유종증 환자에서 위장관기질종양과 십이지장에 신경내분비종양이 함께 발생한 2예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
증례 1
환 자: 이〇〇, 남자, 55세
주 소: 위내시경검사상 우연히 발견된 위의 신생물
현병력: 건강검진 목적으로 시행한 위내시경검사상에서 위의 신생물이 관찰되어 내시경 점막하 절제술을 위해 입원하였다.
과거력: 20년 전 진단받은 신경섬유종증 이외의 특이적인 과거력은 없었다.
가족력: 환자의 어머니와 남자형제 2명에서 신경섬유종증이 있었으며 여자 형제에서는 발병하지 않았다.
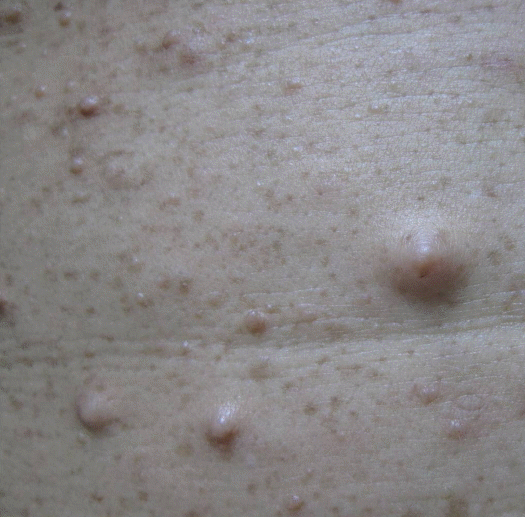
이학적 소견: 내원 시 혈압은 120/80 mmHg, 맥박수 76회, 호흡수 20회/분, 체온 36.0℃였으며 의식은 명료하였다. 복부 진찰상 압통이나 반발압통은 없었으며 간비대도 촉지되지 않았다. 이마, 앞가슴, 배부, 복부 및 사지 말단부 등 전신에 여러 크기의 신경섬유결절과 담갈색 반점 및 주근깨(freckles)가 관찰되었으나 압통은 없었다(Fig. 1).
검사실 소견: 내원 시 백혈구 수 5,300/mm3(분엽핵호중구 58.1%, 림프구 30.7%), 혈색소 14.8 g/dL, 혈소판 213,300/mm3이었다. 생화학 검사상 혈액요소질소 13.0 mg/dL, 크레아티닌 0.7 mg/dL, 혈청 나트륨 136 mEq/L, 칼륨 3.7 mEq/L, 총 단백 7.3 g/dL, 알부민 4.2 g/dL, AST 25 U/L, ALT 27 U/L, 총 빌리루빈 0.54 mg/dL이었고 암배아항원(CEA)은 2.87 ng/mL, 알파태아단백질(αFP) 2.07 IU/mL이었다.
내시경 소견: 식도위십이지장내시경에서 위의 대만부에 약 20 mm 크기의 납작하게 융기된 병변이 관찰되었고, 십이지장의 유두상부에서 상층부의 미란성 병변을 동반한 융기성 종물이 관찰되었다.
방사선 소견: 복부 컴퓨터 단층 촬영상 십이지장의 둘째 부분(duodenum 2nd portion)에 약 2 cm 크기의 조영증강되는 결절이 관찰되었고, 위의 날문방(pyloric antrum)에도 1 cm 크기의 조영증강 되는 결절이 관찰되었다.
치료: 방사선 소견상 팽대부주위 암종의 가능성이 있을 것으로 판단되어 유문보존 췌십이지장 절제술(pylorus- preserving pancreaticoduodenectomy, PPPD)을 시행하였다. 수술 소견상 팽대부에 약 3 × 3 cm 크기의 단단한 종물이 관찰되었고 소장에도 다발성 결절들이 관찰되었다(Fig. 2).
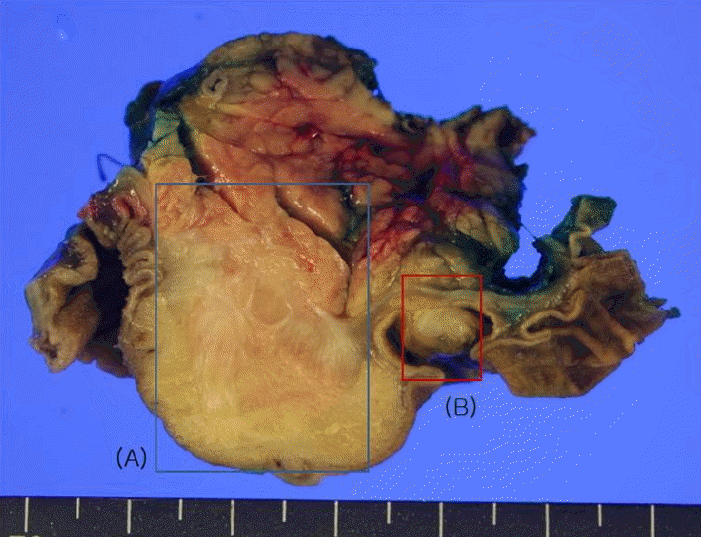
Cut section of the specimen. (A) Well defined larger nodule, measuring 2.5 cm in greatest diameter, showed a homogenous cut surface, and probably originated from the pancreas. (B) Smaller nodule, measuring 0.6 cm in greatest diameter, was presented in a form of submucosal mass.
조직학적 검사: 수술을 통해 절제된 십이지장, 췌장 일부 및 담낭에 대해 조직검사 시행하였으며 병리학적 소견상 팽대부 주위의 종물은 고분화 신경내분비암종(well differentiated neuroendocrine carcinoma)으로 진단되었다. 조직학적인 등급은 Grade 1이었으며 병리적인 병기는 pT4N1이었다. 절제부 변연의 침윤이나 림프혈관성 침윤, 신경주위침범 모두 관찰되지 않았다. 면역조직화학적 염색상 cytokeratin, synapto-physin과 CD56에 양성이었으며 chromogranin, gastrin, somatostatin, insulin, glucagon에는 음성이었고 Ki-67에는 2% 정도만 양성이었다. 절제된 소장에서 관찰된 용종에서도 조직검사를 시행하였으며 저위험도 위장관기질종양으로 판명되었다(Fig. 3).
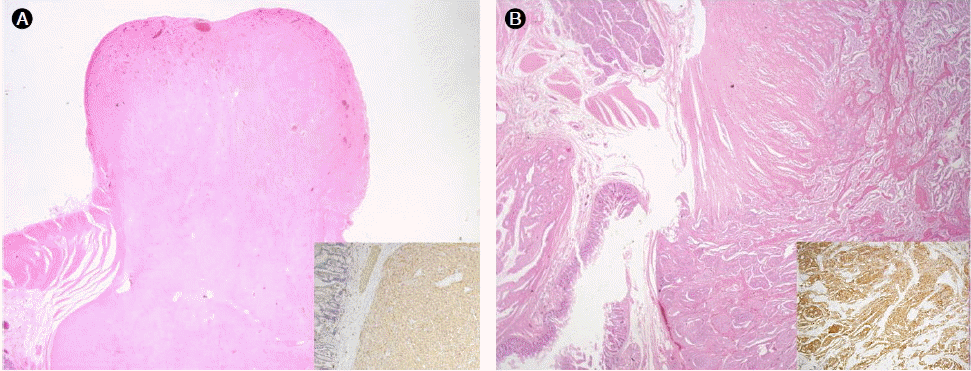
(A) The smaller nodule was the spindle cell type of gastrointestinal stromal tumor (GIST) (H&E, ×20). The tumor cells showed an immunoreactivity for C-kit (inset). (B) The larger nodule was a well differentiated neuroendocrine tumor, originated from the pancreas (H&E, ×20). Tumor cells of the larger nodule showed an immunoreactivity for CD56 (inset).
경과: 수술 시행 2달 후 복부 컴퓨터 단층촬영을 하였고, 재발이나 전이 소견은 관찰되지 않았다.
증례 2
환 자: 장〇〇, 여자, 36세
주 소: 상복부 통증
현병력: 식사 후 발생하는 상복부 통증으로 외부 병원에서 시행한 식도위십이지장경에서 십이지장 팽대부의 종물이 의심되는 소견을 발견하여 복부 컴퓨터 단층촬영을 시행하였고, 십이지장에 약 2.5 cm 크기의 종양과 함께 다발성 림프절 종대 소견이 관찰되어 내원하였다.
과거력: 신경섬유종증 외 특이적인 과거력은 없었다.
가족력: 환자의 아버지 및 남동생과 여동생은 신경섬유종증이 있었으나 다른 형제들에서는 나타나지 않았으며, 자녀 중 큰 딸에서 신경섬유종증이 있었다.
사회력: 음주 및 흡연력은 없었다.
이학적 소견: 내원시 혈압은 120/80 mmHg, 맥박수 88회, 호흡수 20회/분, 체온 36.0℃였으며 의식은 명료하였다. 복부 진찰상 압통이나 반발압통은 없었으며 간비대도 촉지되지 않았다. 복부, 배부, 상지 등에 여러 크기의 신경섬유결절과 담갈색 반점이 관찰되었다.
검사실 소견: 내원시 백혈구 수 7,300/mm3(분엽핵호중구 76.8%, 림프구 13.9%), 혈색소 12.1 g/dL, 혈소판 231,000/mm3이었다. 생화학 검사상 혈액요소질소 9.1 mg/dL, 크레아티닌 0.6 mg/dL, 혈청 나트륨 142 mEq/L, 칼륨 3.6 mEq/L, 총 단백질 7.8 g/dL, 알부민 5.1 g/dL, AST 18 U/L, ALT 26 U/L, 총 빌리루빈 0.9 mg/dL이었고 암배아항원(CEA)은 < 0.200 ng/mL, CA 19-9는 2.19 U/mL이었다.
방사선 소견: 췌장 자기공명영상에서 십이지장의 둘째 부분에 경계가 좋은 1.4 cm 크기의 종물이 관찰되었고, T1 영상에서 낮은 신호강도를 T2 영상에서는 보통의 신호강도를 보였으며 동맥기(arterial phase)에서 주변부가 조영 증강되고 지연기(delayed phase)에서는 전반적으로 조영 증강되었다. 이외에도 십이지장-공장 연결부에 약 1.6 × 1.3 cm 크기의 경계가 좋은 종물이 관찰되었으며, T1 영상에서 낮은 신호강도를 보이고 T2 영상에서는 높은 신호강도를 보였다. 조영증강 영상에서는 전반적으로 조영증강되는 양상이 관찰되었고, 복강 내에는 1.2 cm 이하 크기의 림프절이 여러 개에서 관찰되었다.
치료: 십이지장 둘째 부분의 종물에 대해 위유문보존 췌십이지장 절제술을 시행하였다. 수술 소견상 십이지장 둘째 부분에 1.5 cm 크기의 종물이 관찰되었고, 트라이츠 인대 바로 아래에 있는 공장에서 점막하 종양이 촉지되었으며 이와 인접한 장간막에 림프절 종대가 촉지되었다(Fig. 4).

Two nodules were presented. (A, B) Two nodules showed a homogenous cut surface and attached each other. (B) One nodule showed a focal hemorrhage.
조직학적 검사: 수술을 통해 절제된 십이지장, 췌장, 담낭에 대해 시행한 병리검사 소견상 십이지장의 종양은 고분화 신경내분비암종으로 진단되었다. 절제부 변연은 종양세포의 침윤이 관찰되지 않았으나 총 9개의 림프절에서 침윤이 발견되었다. 면역조직화학 염색상 CD34, synaptophysin, CD56에 양성이었고, chromogranin, gastrin, somatostatin, insulin, glucagon에는 음성이었으며 Ki-67은 1% 미만이었다. 공장에서 발견된 종양은 위장관 기질종양으로 판명되었다(Fig. 5).
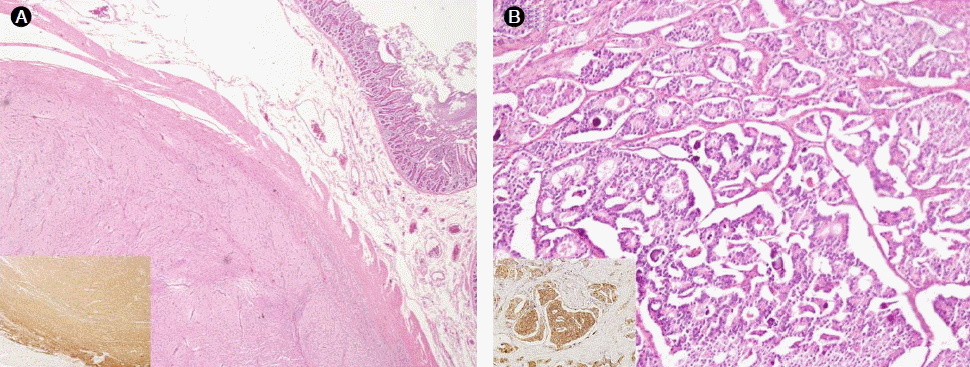
(A) The one nodule was the spindle type of gastrointestinal stromal tumor (GIST) (H&E, ×20). The tumor cells showed an immunoreactivity for C-kit (inset). (B) The other nodule was a well differentiated neuroendocrine tumor, probably originated from the pancreas. Tumor cells of the neuroendocrine tumor arranged in a tubular or trabecular pattern. Nuclear atypism and pleomorphism were not detected (H&E, ×40). Tumor cells of the larger nodule showed an immunoreactivity for CD56 (inset).
경 과: 수술 3개월 후 시행한 복부 전산화 단층촬영에서 1 cm 크기의 복강내 림프절 종대가 관찰되었으나 추적관찰에서는 림프절 크기의 변화가 보이지 않아 현재 외래 추적관찰 중이다.
고 찰
제1형 신경섬유종증은 상염색체 우성 유전질환으로, 염색체 17번의 장완에 위치한 NF-1 유전자의 변이로 인해 발생하지만 약 절반 정도에서는 산발적 돌연변이로 발생하기도한다[4]. NF-1 유전자는 neurofibromin 단백질을 만들어내며, 이는 RAS 신호전달경로를 억제함으로써 종양 형성을 억제하는 역할을 한다. 그러나 NF-1 유전자의 변이는 neurofibromin의 감소를 초래하고 이에 따라 Ras에 의한 신호 전달 경로가 활성화 되어 세포 성장이 촉진되는 것으로 알려져 있다[5]. 신경섬유종증은 종양의 발생과 연관이 있으며, 연구에 따르면 제1형 신경섬유종증 환자에서 악성종양이 발생할 확률이 일반 사람들에 비해 2.7배 정도 높은 것으로 조사되었다[6]. 제1형 신경섬유종증 환자에서는 신경아교종(glioma), 뇌실막종(ependymoma), 림프종(lymphoma), 골수성 백혈병(myeloid leukemia), 빌름스 종양(Wilms’ tumor), 크롬친화세포종(pheochromocytoma), 악성말초신경초종(malignant peripheral nerve sheath tumor, MPNST), 위장관 기질종양, 그리고 신경내분비 종양 등이 발생하는 것으로 알려져 있다[3].
위장관에서 발생하는 신경내분비종양은 장크롬친화성세포(enterochromaffin cell)에서 기원하는데, 가스트린(gastrin), 소마토스타틴(somatostatin) 등의 호르몬 단백질을 분비하는 경우가 많으며 실제 이런 영향으로 증상이 유발되는지 여부에 따라 기능성과 비기능성 종양으로 구분할 수 있다. 제1형 신경섬유종증 환자에서는 신경내분비종양의 유병률이 일반 인구에 비해 높은 것으로 알려져 있으며, 종양세포에서 호르몬 단백질을 분비하는 경우가 종종 있지만 실제로 설사나 안면 홍조 같은 연관 증상을 유발하는 경우는 드물다[3]. 발생장소는 일반적으로 췌장이 가장 흔하지만 신경섬유종증 환자에서는 십이지장의 둘째부분과 파터팽대(ampulla of Vater)에 더 흔하게 발생하는 것으로 알려져 있다[7]. 한 연구에 따르면 제1형 신경섬유종증 환자에서 팽대부 주위 또는 십이지장에서 종양이 발견된 경우에서 47%는 신경내분비종양이었다고 한다[1]. 본 증례의 경우도 일반적인 경우와 달리 파터팽대부와 십이지장 둘째부분에서 신경내분비암종이 발생하였다. 기존 문헌에서는 단지 8%만이 무증상이었으나 본 증례 중 한경우에서는 크기가 작고 비기능성 종양으로 임상증상의 발현은 없었고, 나머지 한경우에서는 비특이적인 위장관증상이 나타났다. 이렇듯 무증상의 신경섬유종증 환자에서도 십이지장의 종양에 대한 내시경검사가 주기적으로 필요할 것으로 생각된다.
위장관 기질종양은 카할 간질세포(interstitial cell of Cajal, ICC)에서 기원하며 일반 인구에서는 발생률이 연간 10만명당 1.5명 정도로 알려져 있다. 제1형 신경섬유종증은 위장관기질종양의 발생과도 연관이 있는 것으로 알려져 있으며, 발생률이 3.9%에서 25%까지 보고되기도 한다[3]. 일반적으로 발생하는 위장관기질종양은 면역조직화학염색에서 KIT와 PDGFRA에 양성으로 보이는 것이 특징이지만 신경섬유종증 환자에서는 음성을 나타내며 더 이른 나이에 다발성으로 발생한다는 점에서 차이를 보인다. 산발적으로 발생하는 위장관기질종양에서 KIT와 PDGFRA의 돌연변이는 종양발생의 중요한 기전으로 알려져 있다. 하지만 제1형 신경섬유종증환자에서는 다른 기전이 작용하는 것으로 생각되며 Ras에 의한 신호전달경로 활성화와 연관이 있을 것으로 추정된다[3,8]. 제1형 신경섬유종증 환자에서는 약 20%만이 c-kit 양성 소견을 보였으나 본 증례에서는 두 경우 모두 c-kit 양성소견을 보였다. 그러나 소장에 다발적으로 발생하여 산발적인 위장관기질종양과는 다른 임상양상을 보였다.
신경내분비종양과 위장관기질종양 모두 제1형 신경섬유종증 환자에서 그 발생 빈도가 일반 인구에 비해 높은 것으로 알려져 있지만 이들이 동시에 발생하는 경우는 매우 드물며 전 세계적으로도 보고된 증례들이 10건 미만으로 알려져 있다. 대부분의 경우 소마토스타틴종(somatostatinoma)이 위장관기질종양과 발생하였고, 특히 제1형 신경섬유종증에서 발생하는 신경내분비종양의 발생위치와 조직형태, 위장관기질종양의 임상소견과 c-kit 돌연변이가 기존 종양과 상이하였다. 본 증례의 경우 비기능성 고분화 신경내분비종양이 위장관기질종양과 함께 발생하였고, 제1형 신경섬유종증에서 신경내분비세포와 간엽조직 기원의 종양이 함께 발생한다는 것은 이들의 생성과정에서 공통적인 기전이 존재할 수도 있다는 가정에 이를 수 있어, 향후 신경섬유종증 환자에서 신경내분비세포종과 위장관기질종양의 발병 빈도, 생물학적인 특성 및 효과적인 치료법에 대한 연구가 되어야 할 것이다[9].