신장을 침범한 결정성 경화증에서 발생한 폐의 임파관평활근종증 1예
A Case of Pulmonary Lymphangioleiomyomatosis Associated with Tuberous Sclerosis and Renal Angiomyolipoma
Article information
Abstract
저자들은 신장의 혈관근 지방종과 간질로 결절성 경화증을 진단 받고 추적관찰 중인 환자에서 발생한 점진적인 호흡곤란으로 시행한 흉부 전산화 단층 촬영과 병리 조직 소견에서 HMB-45 양성의 폐 림프관 혈관종증을 진단한 1예를 경험하였기에 문헌과 함께 보고하는 바이다.
Trans Abstract
Tuberous sclerosis is an autosomal dominant disorder characterized by facial skin lesions, epilepsy, and mental retardation. Pulmonary involvement in tuberous sclerosis is rare and shows characteristic reticulonodular infiltration and cystic changes. Lymphangioleiomyomatosis is characterized by the progressive proliferation of smooth muscle cells and occurs in 0.1-1% of patients with tuberous sclerosis. We encountered a case of pulmonary lymphangioleiomyomatosis associated with tuberous sclerosis and bilateral renal angiomyolipoma in a 31-year-old female patient. This case is reported here along with a brief review of the literature. (Korean J Med 2011;81:775-779)
서 론
결절성 경화증은 안면의 피부 병변(adenoma sebaceum), 경련, 지능 저하 등을 특징으로 하는 우성 유전의 희귀한 유전성 전신질환으로 신장, 뇌, 심장, 폐 등의 장기에 침범할 수 있다. 그중 폐를 침범하는 경우는 드문 것으로 전체 환자의 0.1-1%에서 폐 림프관평활근종증이 관찰되며, 국내에서는 약 23예 정도가 문헌 보고되었다[1]. 폐 림프관평활근종증은 주로 젊은 여성에서 자주 발생하고 폐의 낭종성 변화와 흉벽, 기관지, 폐포벽, 폐혈관 그리고 림프관 등에 나타나는 비전형적인 평활 근의 점진적인 증식으로 궁극적으로는 호흡 부전으로 사망하게 되는 질환이다[2].
이에 저자들은 신장의 혈관근 지방종과 간질로 결절성 경화증을 진단 받고 추적관찰 중인 31세 여자 환자가 호흡 곤란과 기침으로 내원하여 폐 림프관 평활근 종증을 진단한 1예를 경험하였기에 보고하는 바이다.
증 례
환 자: 김〇〇, 여자 31세
주 소: 내원 2개월 전부터 시작된 호흡 곤란과 기침
현병력: 환자는 2-3세에 경련으로 입원하였고 이후에 안면에 특징적인 피지선종이 나타나 결정성 경화증을 진단 하에 항 경련약제 장기 투약 없이 경과관찰하고 있었다. 이후 점차 커지는 복부의 종괴로 본원 비뇨기과 내원하여 양측 신장의 혈관근 지방종 진단 받고 외래 추적관찰하고 있었다. 특이 증상 없이 지내던 중 내원 2개월 전부터 호흡 곤란과 기침 발생하여 외래에서 시행한 흉부 컴퓨터 촬영에서 림프관 평활근종증 의심되어 정밀 검사 위해 외래 통해 내원하였다.
개인력: 흡연력과 음주력은 없었다.
가족력: 특이 사항 없었다.
이학적 소견: 내원 당시 환자는 신장 167 cm, 체중 60.7 kg이었고, 혈압 150/90 mmHg, 심박수 98회/분, 호흡수 20회/분, 체온 36.4℃로 급성 병색이었다. 이학적 소견상 양쪽 안면 부위에 대칭성 피지 선종이 관찰되었고 양측 측복부에서 거대종물이 촉진되었으며, 호흡음은 선명하였고 천명음이나 악설음 등은 청진되지 않았다. 기타의 이학적 검사에서 특이 소견은 없었다.
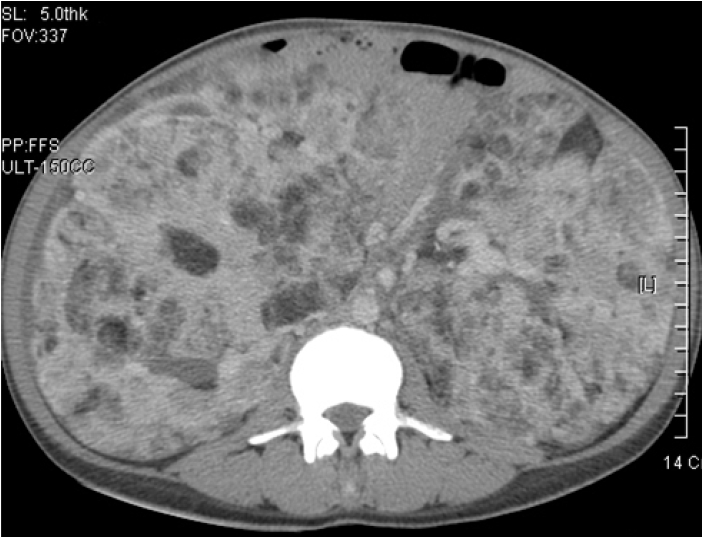
검사 소견: 말초혈액 검사 소견에서 백혈구 8,340/mm2, 혈색소 7.6 g/dL, 혈소판 385,000/mm3이었다. 혈액화학 검사에서는 BUN 31 mg/dL, creatinine 1.4 mg/dL이었으며, Aspartate aminotransferase (AST)14 IU/L, Alanine aminotranferease (ALT) 14 IU/L, C-reactive protein 2.5 mg/dL, 요 검사에서 비중 1.020, 단백질(2+), 적혈구 0-1/HPF, 백혈구 2-4 /HPF였다. 동맥혈 가스 검사 소견은 PH 7.397, PCO2 32.7 mmHg, PO2 69.7 mmHg, SaO2 94.2%이었다. 심전도는 정상이었고 흉부사진에서는 미만성 망상성 폐 침윤이 관찰되어 림프관 평활근 종증이 의심되었다(Fig. 1). 흉부 전산화 단층촬영술상 종격동의 림프절의 종대 소견은 없었고 양측 폐에 둥글고 얇은 벽을 가지고 있는 낭종성 병소가 다수 광범위하게 다양한 크기로 관찰되었으나 결정성 병변을 보이지는 않는 림프관 평활근 종증의 소견을 보였다(Fig. 2). 함께 시행한 복부 전산화 단층 촬영에서는 양측 신장에 큰 종괴가 관찰되며 신장의 대부분이 종괴로 대체되어 신 실질이 거의 남아 있지 않은 것으로 보였으며 조영제의 배설도 잘 보이지 않았다(Fig. 3). 입원 후 폐에서 시행한 조직검사에서 방추형 세포의 증식과 낭종의 형성 및 폐포벽의 비후가 관찰되었다(Fig. 4A). 면역 조직 화학 검사에서 smooth muscle actin (SMA) (Fig. 4B), HMB-45 (Fig. 4C), 에스트로겐 수용체와 프로게스테론 수용체(Fig. 4D)에 양성이었다.
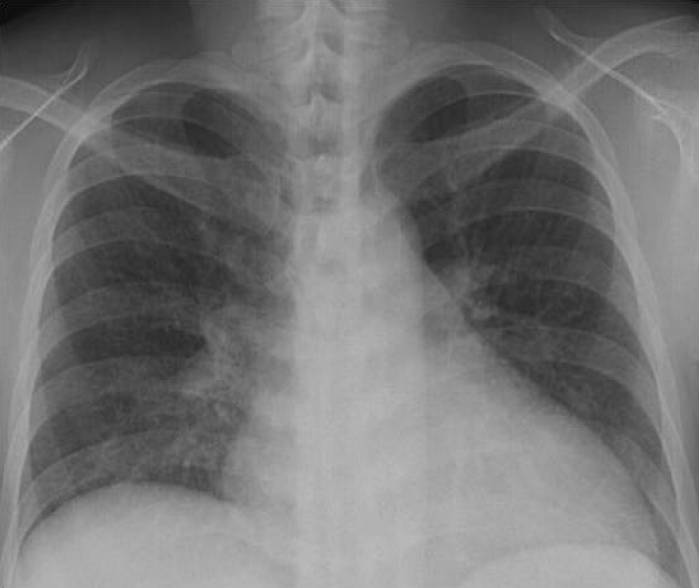
Posteroanterior chest X-ray showing diffuse reticulonodular opacities on the entirety of both lungs.
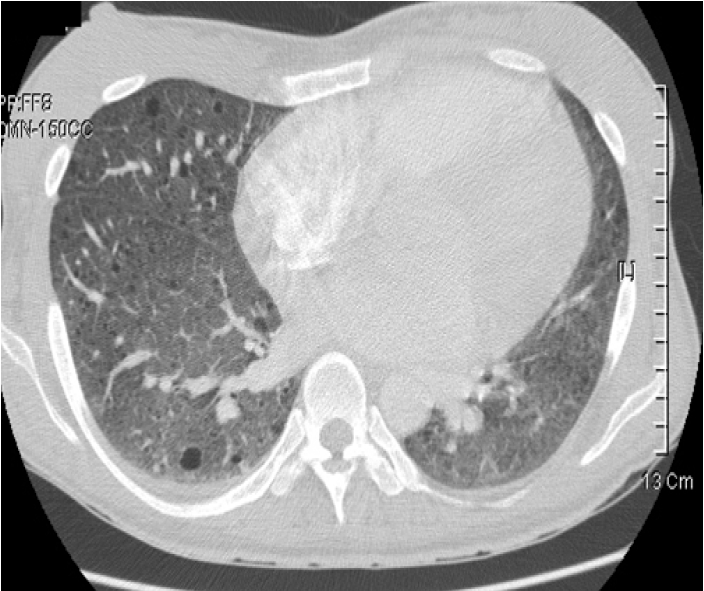
Chest computed tomography image showing multiple diffuse, round, thin-walled cysts on the entire lung.

(A) Thin-walled cystic spaces surrounded by nodular proliferation of smooth muscle bundles (arrow; hematoxylin & eosin stain, ×40). Immunoreactivity of smooth muscle actin, (B) lymphangioleiomyomatosis, (C) and monoclonal antibody HMB-45, (D) in the lung specimen.
입원기간 중 결절성 경화증의 동반 질환 유무를 조사하기 위해 시행한 두부 자기공명촬영상 T2W1에서 고해상도를 보이는 피질 결절이 관찰되었으며(Fig. 5) 심장 초음파에서는 이상 소견은 없었다. 망막에도 특이 소견은 관찰되지 않았다.
치료 및 경과: 환자 조직 검사 후 큰 이상 없는 상태로 기존에 증명된 효과적인 치료법이 없기에 보존적인 치료 시행 후 퇴원하여 외래 추적관찰하였다.
고 찰
결절성 경화증은 뇌, 심장, 피부, 눈 , 신장 그리고 폐 등의 여러 기관을 포함하는 과오종성 증식을 보이는 상염색체 우성 유전 질환이다[3]. 지능 저하, 경련, 안면의 피지 선종 등을 3대 증상으로 하고 있으나 최근에는 세 가지 증상이 모두 동반되지 않고 다양한 임상 증상이 나타나기도 한다[4]. 이 중 신장 병변은 대부분이 혈관근 지방종이며 다발성이고 양측성으로 증상이 없는 것이 보통이고 폐에서는 간질성으로 망상형, 결절형 또는 봉와상의 형태로 미만 성의 폐 침윤이 나타난다[5]. 발생 빈도는 10세 이하의 소아에서 12,000-14,000명당 1명이라는 보고가 있으나 최근 진단 방법의 향상으로 그 빈도는 증가할 것으로 추정된다[6,7].
진단은 임상 소견에 의하게 되며 대부분은 영유아기에 진단을 받게 되며 결절성 경화증 자체에 대한 특이 치료법이 없으므로 주로 대증요법을 시행하게 된다[3]. 최근에는 mammalian target of rapamycin (mTOR)의 억제제인 silorimus로 폐림프관 혈관종증과 신장의 혈관근 지방종이 있는 결정성 경화증 환자에 있어 일부 혈관근 지방종의 감소와 폐 기능의 호전을 보였다는 보고가 있다[8].
결절성 경화증에서 폐 병변이 발생하는 것은 전체 결절성 경화증 환자의 1-3%이며[9] 일반적으로 남성과 여성에서 동일한 발생률을 보이고 있는 결절성 경화증과 달리 대부분이 가임기 여성에서 발생하며[10] 결절성 경화증에서 폐 림프관 평활근 종증이 동반된 환자의 93%에서 신장의 혈관근 지방종이 나타나게 된다[11]. 폐 림프관 평활근종증은 폐포의 비전형적인 평활근의 증식과 폐 실질의 낭종성 변화를 특징으로 하며 이러한 병변은 폐의 전반에서 발생하며 진행성 양상을 띠게 된다. 이러한 진행성의 구조적 변화와 폐 기능의 손실이 결국에는 호흡 부전을 야기하게 되지만 아직까지는 확립된 치료가 없다[12]. 평균 생존 기간은 폐증상 발현후 5년으로 보고되어 있고 기흉과 폐 성심 등으로 인한 폐기능 장애로 사망하게 된다[13].
임상적 소견 및 병리 조직학적 소견 및 방사선 소견이 유사하기 때문에 폐 림프관 혈관종증을 결절성 경화증의 불완전한 형태로 보는 견해가 있고 결절성 경화증, 폐를 침범한 경화증, 폐의 림프관 평활근종증의 세 가지 질환을 하나의 스펙트럼으로 이해해야 한다는 견해가 있다[14,15]. 폐림프관 혈관종증과 결절성 경화증의 폐 침범은 병리 조직학 소견, 폐 기능 검사 소견, 신장의 혈관근 지방종을 동반하는 점 그리고 임신에 의해 악화되는 점은 유사하다. 그러나 우성 유전을 하는 결절성 경화증과 비교해 볼 때 폐 림프관 혈관종증은 가족력이 알려져 있지 않고 유미흉이 잘 동반되며 결절성 경화증의 특징적 임상 소견을 보이지 않는 등의 차이점이 있다.
폐 림프관 평활근종증의 임상증상은 호흡곤란이 주된 증상이며 기흉과 객혈이 나타날 수 있고 유미흉이 발생할 수 있다. 림프관 혈관종증의 방사선학적 소견으로는 단순흉부 X-선 검사에서는 비특이적이지만 망상형 또는 망상 결절형의 폐 침윤 및 양 폐야의 벌집 모양의 음영을 형성하게 된다. 진단과 추적관찰 검사에 유용한 흉부 단층 촬영에서는 특징적으로 양측성의 다수의 일정한 모양의 변연이 잘 그려지는 낭종성 병변이 고르게 분포되게 된다. 이러한 병변은 질환이 진행할수록 수와 크기가 증가하게 된다[12].
폐 림프관 평활근 종증의 병리조직학적 소견은 비전형적인 평활근 세포의 증식과 관련된 미만성 낭종성 변화이다. 특이할 것은 면역 조직 화학 검사에서 흑색종 세포계(melanoma cell line)의 세포질을 인지한다고 알려진 단 클론 항체인 HMB-45의 존재이다. 림프관 평활근 세포는 HMB-45가 양성인 반면 정상 및 다른 질환의 폐 세포는 대부분 HMB-45가 음성이며 개흉 폐 생검 뿐 아니라 기관지 폐 생검에서도 양성인 검체를 얻을 수 있기 때문에 진단에 유용할 수 있다[16].
폐 림프관 평활근종에서는 가임 연령의 여성에서 주로 나타나고 조직에서 에스트로겐, 프로게스테론, 당류 코르티코이드에 대한 수용체가 관찰되어 이들 호르몬과 관련성이 있을 것으로 판단되어 다량의 프로제스테론이나 항 에스트로겐 제재를 투여하거나 난소 적출술 등을 시행하지만 치료 효과는 보고자에 따라 다르며 질환의 희귀성으로 아직까지 최적의 치료에 대한 명확한 합의는 없다[17].