위장관 기질종양으로 오인된 거대 유경성 간세포암종 1예
A Case of Huge Pedunculated Hepatocellular Carcinoma Mimicking a Gastrointestinal Stromal Tumor
Article information
Abstract
유경성 간세포암종은 간세포암중에서 매우 드문 형태이다. 국내에서의 유경성 간세포암종의 증례 보고는 매우 드물었고, 대만과 일본 등의 증례가 소수 보고되어 있다. 저자들은 위저부 옆의 거대종괴에 대해 위장관 기질종양으로 의심하고 진단 겸 치료를 위해 수술을 시행하였던 경우로, 수술 후 목이 없는 거대한 외성장 형태의 유경성 간세포암종으로 진단되었다. 유경성 간세포암종은 일반적 간세포암종에 비해 절제 가능한 경우가 많지만, 빠른 성장을 보이기 때문에 빨리 진단을 하는 것이 예후에 매우 중요하다. 이러한 이유로 종괴가 간 이외의 위치에 있다고 하더라도, 초기 추정진단시 간세포암종의 가능성을 배제하여서는 안될 것이다.
Trans Abstract
Pedunculated hepatocellular carcinoma (P-HCC) can be defined as a carcinoma protruding from the liver with or without a pedicle. Cases of P-HCC showing extrahepatic growth are very rare. P-HCC constitutes 0.2-4.2% of all HCC cases in Japan and Taiwan, but few cases in Korea have been reported. A 67-year-old female patient was admitted to our hospital with a 6-month history of epigastric discomfort. Examination identified an abdominal mass in the left upper quadrant, and abdominal computed tomography revealed a huge mass adjacent to the fundus of the stomach. We diagnosed this mass as a gastrointestinal stromal tumor because of its size and site. However, postoperative histopathological findings showed that the mass was HCC. Here, we report this case and review the relevant medical literature. (Korean J Med 2011;81:764-768)
서 론
유경성 간세포암종(pedunculated hepatocellular carcinoma)이란 간으로부터 돌출된 간세포암종을 말한다[1]. 유경성 간세포암종은 모든 간세포암종의 0.2-4.2% 정도인 것으로 일본과 대만의 논문에서 소수 보고된 바 있다[2,3]. 우리나라의 경우 간세포암종은 인구 10만 명당 남자 47.1명, 여자 11.4명의 발생률을 보이며 1년에 약 1만 명의 환자가 새로 발생하여 위암, 폐암에 이어 암 등록순위 3위인 암일 정도로 많은 질환이기 때문에[4,5] 유경성 간세포암종의 보고가 많을 것으로 추정되나, 국내에서의 유경성 간세포암종의 증례보고는 두 차례 밖에 없었다[6,7]. 저자들은 위저부(fundus of stomach) 옆의 거대종괴에 대해 위장관 기질종양으로 의심하고 수술을 시행하였던 환자로, 간세포암종의 뚜렷한 위험인자가 없음에도 불구하고, 수술 후 목(pedicle)이 없는 외성장 형태의 유경성 간세포암종으로 진단된 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 김〇〇, 67세, 여자
주 소: 상복부 불쾌감
과거력 및 현병력: 특이 과거병력이 없는 자로 내원 6개월 전부터 시작되어 점점 악화되는 상복부 불쾌감을 주소로 내원하였다.
가족력 및 사회력: 음주나 흡연은 하지 않았고, 특이 가족력도 없었다.
진찰 소견: 내원 당시 활력징후는 혈압 120/80 mmHg, 맥박 76회/분, 호흡 20회/분, 체온 36.3℃였다. 신체검사에서 만성 병색을 보였고, 의식은 명료하였다. 흉부 청진에서 호흡음은 정상이었으며, 심박동은 규칙적이었고, 심잡음은 들리지 않았다. 복부청진에서 장음은 정상으로 들렸으며, 복부 촉진에서 심와부에 경미한 압통이 있었으나 반동압통은 없었고, 좌측 상복부에 큰 덩어리가 촉지되었다.
검사실 소견: 말초혈액 검사에서 백혈구는 4,600/mm3, 혈색소 12.1 g/dL, 혈소판은 220,000/mm3이었다. 혈청생화학검사에서 총 단백은 7.7 mg/dL, 알부민은 4.2 mg/dL, AST 37 IU/L, ALT 23 IU/L, ALP 63 IU/L, 크레아티닌 0.70 mg/dL였다. HBsAg과 HBsAb 모두 음성이었으며, HCV Ab도 음성이었다. 종양표지자 검사에서 α-FP 146.80 ng/mL, CA (carbohydrate antigen) 19-9 0.6 IU/mL, CA 125 88.04 IU/mL, CEA(carcinoembryonic antigen) 1.03 ng/mL로 α-FP과 CA 125 표지자에서 경도의 상승이 있었다.
방사선 소견: 복부 전산화단층 결과에서 비장과 위 사이에 12 × 13 cm 정도 크기의 거대한 종괴가 있으며 경계는 비교적 명확하고 위저부와 체상부에 인접해 있으며 비장과 횡행결장, 간만곡 등과도 인접해 있었고, 동맥기에 이질적인 조영증강이 있었으나 주변에 림프절 비대나 비정상적 액체저류는 관찰되지 않았다(Fig. 1A). 종괴의 위치와 크기 등을 고려하였을 때 위장관 기질종양으로 추정진단을 하였고, 초음파 유도를 이용한 경피적 침생검을 시행하였으나, 검체의 크기가 작아서 악성종양의 가능성이 높은 정도라는 것 밖에 알지 못했다. PET-CT를 시행하였고, 좌상복부에 높은 대사능(hypermetabolic)을 가진 큰 종괴가 관찰되었으며, 원격전이가 없음을 확인하였다(Fig. 1B).
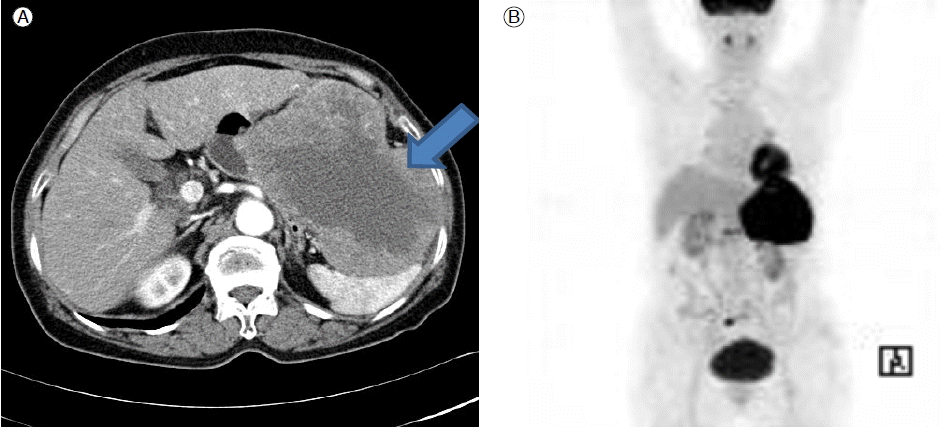
(A) Contrast-enhanced abdominal computed tomography findings. A hepatic arterial-phase scan showed a heterogeneously enhanced huge mass (arrow) in the abdominal cavity. (B) Huge, hypermetabolic mass in the left upper quadrant without distal metastasis.
조직학적 소견: 이에 정확한 진단 및 치료를 위하여 수술을 시행하였다. 수술적 소견상 종괴는 간 좌측의 외측엽(left lateral lobe of liver)에 이어져 있었고, 16.0 cm (가로) × 13.0 cm (세로) × 8.0 cm (높이)의 크기에 무게는 870 gm이었으며, 캡슐에 둘러싸여 있었다(Fig. 2). 병리조직검사결과 핵다형성(nuclear pleomorphism)의 정도가 심하였으며, 종양세포의 세포질에서 담즙이 관찰되어, Edmondson and Steiner 분류상 Grade IV에 해당하는 간세포암종으로 진단할 수 있었다(Fig. 3) [8].
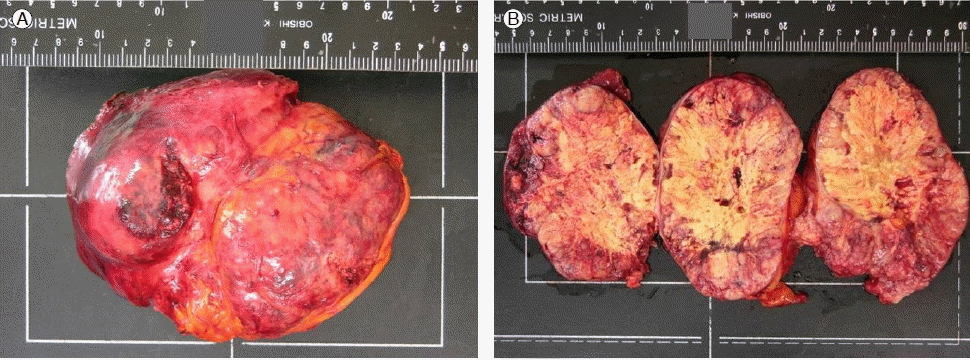
(A) Gross findings of the resected mass; it was encapsulated, 16.0 × 13.0 × 8.0 cm in size, and 870 g in weight. (B) On sectioning, the entire cut surface was yellowish-gray, solid, diffusely necrotic, and focally hemorrhagic.
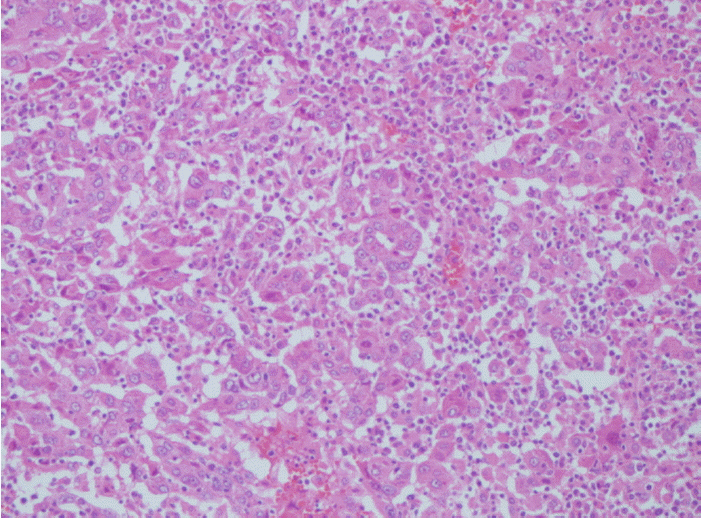
Microscopic findings showed the trabecular arrangement of individual tumor cells. These cells exhibited relatively abundant cytoplasm with bile and severe nuclear pleomorphism. This carcinoma corresponded to poorly differentiated hepatocellular carcinoma (Edmondson-Steiner grade 4; hematoxylin & eosin stain, ×200).
고 찰
간세포암종의 육안적 분류는 Eggel의 분류에 따라 괴상형(massive), 결절형(nodular), 미만형(diffuse)으로 분류하는 것이 널리 이용된다[9].
유경성 간세포암종이란 용어는 1897년 Roux가 처음으로 기술하였으며, 목의 유무에 관계 없이 간으로부터 돌출된 간세포암종으로 정의하였다[1]. 이후 1934년 Goldberg와 Wallenstein이 1.5 cm의 목을 가지고 있고 좌엽 하면부터 돌출된 간세포암종을 처음으로 증례보고 하였다[10]. 유경성 간세포암종은 돌출된 간세포암종이 목이 관찰되는 제1형과 이번 증례처럼 목 없이 간 표면에 붙어 외성장의 형태를 띄는 제2형으로 나눌 수 있다[11]. Goldberg 등은 유경성 간세포암종은 선천적으로 Glisson’s capsule에서 잘못 위치된 소엽에서 생기는 것으로 판단되는 것으로 보고하였고[10], Miyoshi 등 역시 유경성 간세포암종은 부엽(accessory lobe)에서 생기는 것으로 판단하였다[12]. 부엽은 간우엽에서 종종 관찰되고, 또한 혈관과 담관을 가진 목에 의해 연결되는 경우가 흔하다. 부엽은 해부학적으로 우엽의 하면에서 흔히 관찰되나 간의 모든 엽에서 관찰될 수 있다[12]. 유경성 간세포암종은 이소성 간 조직(ectopic liver tissue)에서도 또한 생길 수 있으며, 이소성 간 조직은 간의 삼각인대(triangular ligament), 비장, 제대와(umbilical fossa), 복강 동맥총(celiac axis) 옆의 후복막강, 장막, 담낭 등의 다양한 위치에서 관찰될 수 있다[13]. 일본에서는 유경성 간세포암종이 전체 간세포암종의 0.24%에서 3.00% 정도를 차지한다는 보고가 있었다[3]. 대만에서는 432명의 간세포암종 환자 중에서 18명(4.2%)이 유경성 간세포암종이었다는 보고가 있으며, 이 중 11명(61%)의 환자에서 조직학적 분화도가 좋은(well differentiated type) 특징을 보이고, 총 생존율(overall survival)에서 유경성 간세포암종의 평균 생존율(meal survival)이 94개월로, 그렇지 않은 일반 간세포암종의 평균 생존율인 54.5개월보다 유의하게 높았다고 보고하였다. 이는 유경성 간세포암종의 경우에는 돌출 종괴이기 때문에 간으로의 성장이 제한되는 효과가 있고, 일반 간세포암종에 비하여 혈관 침범이 나타나는 경우가 적었기 때문이라고 한다[2]. 혈관 침범이 외과적 절제 이후의 재발에 중요한 위험인자임을 고려할 때 유경성 간세포암종의 환자에서 생존율이 더 좋은 것으로 설명하고 있는 보고도 있다[14]. 일반적으로 간세포암종에서는 종양 크기가 클수록 나쁜 예후를 보이지만[15], 상기 참고문헌에 따르면[2,14] 유경성 간세포암종에서는 종양 크기가 크다고 하더라도 절제 가능한 경계를 얻을 수 있는 경우가 많은 것이 생존율을 증가시켰을 것이라고 판단된다.
혈청 α-FP는 종종 간세포암종과 복부의 다른 종양과 감별하는데 널리 이용되는데, 일본의 보고에 따르면 간세포암종에서의 α-FP 양성 비율이 68%였고, 이 중 유경성 간세포암종에서의 α-FP 양성 비율이 66%로 유의한 차이가 없었다는 보고도 있지만[16,17], 일본의 또 다른 연구에서는 7명의 유경성 간세포암종 환자 중에서 6명의 환자가 α-FP 음성을 보였다는 보고도 있어[18], 유경성 간세포암종을 진단하는 초기 검사에는 α-FP와 더불어 영상학적 진단이 매우 중요할 것으로 판단된다.
유경성 간세포암종은 후복막의 침범을 나타내는 경우, 우측 부신 종양으로 오인되는 증례보고가 소수 있다[19]. 하지만, 저자들은 본 증례와 같이 위저부 옆의 종괴로 나타나는 경우를 경험하였고, 본 증례에서는 복부 전산화 단층촬영에서 종괴와 간의 경계가 비교적 명확히 관찰되었으며, 음주력, 만성간염 등의 간세포암종의 위험인자가 없는 환자였기 때문에 추정진단에서 간세포암종의 가능성을 염두하지 못한 경우로 수술을 하고 나서야 진단할 수 있었던 증례였다.
유경성 간세포암종은 외과적 절제가 일반적인 간세포암종보다 용이하게 때문에 적절한 절제가 이뤄진 경우는 더 나은 예후를 보이지만, 그렇지 못했을 경우에는 빠른 성장을 보이는 경향이 있기 때문에 예후가 나쁠 수 있다[20]. 따라서 초기의 적절한 진단과 치료가 이뤄져야 할 것이고, 간 외부의 복강내 종괴에 대해서도 간세포암종의 가능성을 배제하여서는 안되겠다.