항합성효소증후군과 류마티스 관절염의 중첩증후군 1예
Overlap Syndrome of Antisynthetase Syndrome and Rheumatoid Arthritis: A Case Report
Article information
Abstract
저자들은 관절염과 근염을 동반한 중년 남성에서 류마티스 관절염과 항합성효소증후군이 동반된 중첩증후군을 진단하고 치료한 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
The antisynthetase syndrome is characterized by anti-Jo-1 antibody production, interstitial lung disease, inflammatory muscle disease, and, in many cases, fever, polyarthritis, Raynaud’s phenomenon, and mechanic’s hands. Joint signs and symptoms occur in up to 90% of patients with antisynthetase syndrome, occasionally as the initial manifestations. Although visual inspection of the hands shows changes that are highly suggestive of rheumatoid arthritis, notable differences exist. Antisynthetase syndrome is a predominantly nonerosive arthropathy with subluxations of the distal interphalangeal joints. It manifests as overlap syndrome with other connective tissue diseases. However, overlap syndrome of antisynthetase syndrome and rheumatoid arthritis is rare. We treated a 51-year-old male patient with overlap syndrome of antisynthetase syndrome and rheumatoid arthritis, and report the case with a review of the literature. (Korean J Med 2011;81:673-679)
서 론
항합성효소증후군(antisynthetase syndrome)은 항 Jo-1 항체 생성, 염증성 근염, 다발성 관절염, 간질성 폐질환, 발열, 레이노 현상, mechanic's hand를 특징으로 하는 증후군으로 1990년 Marguerie 등이 항 Jo-1 항체 양성인 29명의 환자를 후향적으로 분석하여 항합성효소증후군을 처음 정의하였다[1]. 증후군에서 관절증상은 약 90% 에서 있으며 외관상으로는 류마티스 관절염과 유사하지만 원위지골간 관절 침범 및 아탈구가 현저하여 류마티스 관절염과는 차이점이 있다[2].
항합성효소증후군 환자의 5-8% 정도에서 전신홍반 루푸스, 전신 경화증, 쇼그렌 증후군 같은 다른 결체조직질환관 중첩되어 나타날 수 있다고 보고되어 있으나, 류마티스 관절염과 항합성효소증후군이 중첩된 보고는 드물다[3]. 저자들은 임상적으로 관절염과 근염을 동반한 중년 남성을 류마티스 관절염과 항합성효소증후군이 동반된 중첩증후군으로 진단하고 치료한 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
51세 남자가 1개월 반 전부터 시작된 양손의 통증을 동반한 부종, 다발성 관절통과 근위부 근력 저하로 내원하였다. 고혈압의 과거력은 있으나 경구 혈압 강하제는 복용하지 않고 있던 환자로 내원 한 달 반 전부터 양측 손의 관절통과 부종이 발생하였고 이후 점차 팔을 들기가 힘들어졌으며 어깨, 무릎의 관절통 심해져서 타 병원에서 약 10일간의 입원치료 후 본원 내원하였다. 내원 당시 문진상 레이노 현상과 다발성 관절통, 근위부 근육통, 1시간 이상의 조조 강직을 호소하였다.
내원 당시 신체 검사상 혈압은 114/69 mmHg, 맥박수 69회/분, 호흡수 16회/분, 체온 36.6℃이었다. 피부 진찰에서 양측 손가락의 측면에 특징적인 과각질성 가피를 보이는 mechanic's hand가 관찰되었다(Fig. 1A). 흉부 청진시 양측 폐야 하부 전반에 걸친 수포음이 들렸다. 근력 검사에서 양쪽 상지와 하지 근위부에서 운동 등급 4등급으로 근력 저하 소견 보였다. 관절 진찰에서 양측 견관절, 양측 수근골 관절, 우측 1-3 중수골지골간 관절, 우측 3-4 근위지골간 관절, 좌측 1-4 중수골지골간 관절, 양측 슬관절, 양측 족근골 관절에 종창과 압통이 관찰되었다(Fig. 1B).

Photographs showing (A) roughening of the skin along the sides of the first fingers, referred to as mechanic's hands, and (B) swelling of both wrists, the first-third metacarpophalangeal (MCP) joints and third and fourth proximal interphalangeal (PIP) joints of the right hand, and the first-fourth MCP joints of the left hand (the fifth finger of the right hand was reconstructed due to an incomplete amputation 6 years previously).
검사실 소견으로 말초혈액 검사에서 백혈구 12,390/mm3, 혈색소 14.3 g/dL, 혈소판 853,000/mm3이었으며, 적혈구침강속도 60 mm/hr, C-반응성 단백 10.6 mg/dL이었다. 생화학적 검사에서 총 단백질 5.6 g/dL, 알부민 3.4 g/dL, 혈중요소질소 8.1 mg/dL, 크레아티닌 0.8 mg/dL이었고, AST 154 IU/L, ALT 160 IU/L, CK (creatinine kinase) 2,333 IU/L, LDH (lactate dehydrogenase) 561 IU/L, aldolase 33.9 sigma u/mL (정상 0-7.6 sigma u/mL)로 근육 효소 수치가 모두 증가되어 있었으며, 소변 검사는 정상, HBsAg, anti-HBs, anti-HCV는 모두 음성이었다. 면역혈청 검사상 류마티스 인자는 80.5 IU/mL로 양성, 항 CCP 항체는 316.13 U/mL (정상 <5 U/mL)로 양성이었고, 항 Jo-1 항체는 1192 AAU (정상 <150 AAU)로 양성, 항핵항체 음성, 항 RNP 항체 음성 소견을 보였다.
흉부 X-선 촬영상 양측 폐야 하부에 간유리음영 및 섬유화 소견 보였다. 동맥혈가스분석상 pH 7.4, pCO2 31.6 mmHg, pO2 99.0 mmHg, HCO3- 21.5 mmol/L, 산소 포화도 98.5% 소견 보였으며, 폐기능 검사에서 FEV1 1.83 L (59% ), FVC 2.41 L (58% ), FEV1/FVC 76% , DLCO 13.8 mL/mmHg/min (64% )으로 제한성 폐기능 장애 소견을 보였다. 흉부 고해상 전산화단층촬영에서 양측 폐야 하부에 유리 간질성 음영 보여 BOOP (bronchiolitis obliterans with organizing pneumonia)에 합당한 소견을 보였다(Fig. 2).

Chest computed tomography scan showing bilateral subpleural ground-glass opacity in the basal lungs, suggesting bronchiolitis obliterans with organizing pneumonia.
손의 단순 방사선 촬영에서 관절강의 협착이나 골미란은 찰되지 않았으며, 전신 뼈 스캔(whole body bone scan)에서 양측 견관절, 양측 수근골, 우측 1-3 중수골지골간 관절, 우측 3-4 근위지골간 관절, 좌측 1-4 중수골지골간 관절, 양측 족근골 관절에 동위원소 흡수가 증가된 소견 보였다.
신경전도검사와 근전도검사에서 근병증의 소견은 뚜렷하지 않았으나 하지 근위부 근육의 자기공명영상 촬영에서 양측 중간광근(Vastus intermedius muscle)에 미만성 부종 및 신호증강 소견 보였다(Fig. 3A). 중간광근에서 시행한 근조직 검사에서 근섬유의 국소적인 변성과 재생 소견, 간질에 염증 세포와 대식 세포의 침윤 소견 관찰되어 염증성 근염에 합당한 소견 보였다(Fig. 3B).
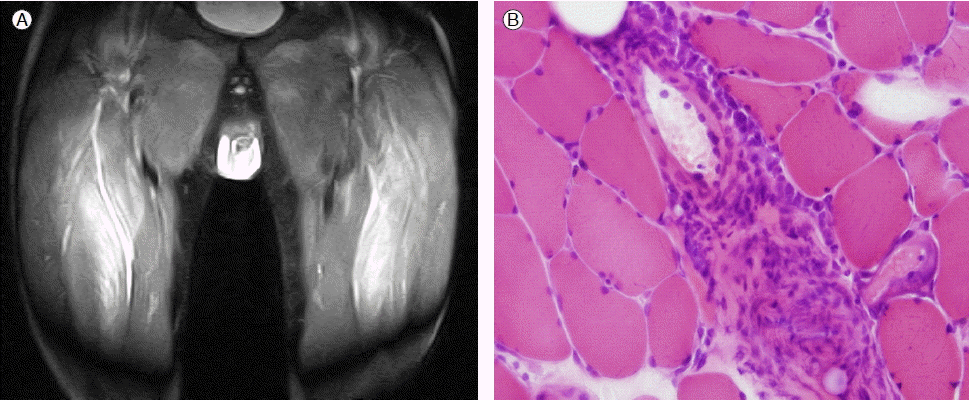
(A) Magnetic resonance images of the thighs revealed diffuse swelling and increased signal intensity of the vastus intermedius muscle on both sides. (B) A muscle biopsy showed degenerating fibers (perifascicular distribution) with inflammatory cells and macrophage aggregation, regenerating fibers, and perivascular inflammatory cell infiltration (hematoxylin & eosin stain, ×200).
이상으로 저자들은 근위부 근력 저하, 다발성 관절염, mechanic’s hand 등의 임상 소견과 검사실 소견에서의 항 Jo-1 항체 양성, 그리고 흉부 전산화단층촬영에서의 간질성 폐질환 소견과 근조직 검사의 피부 근염(dermatomyositis)에 해당하는 소견을 종합하여 항합성효소증후군을 진단하였다. 이와 더불어 1시간 이상의 조조강직, 3관절 이상의 관절염, 수지관절의 관절염, 대칭성 관절염이 6주 이상 지속되고, 류마티스 인자 양성, 항 CCP 항체 양성으로 류마티스 관절염을 진단하여 항합성효소증후군과 류마티스 관절염이 병발된 중첩증후군으로 진단하였다.
치료 위해 고용량 경구 prednisolone (60 mg/일), methotrexate (10 mg/주), sulfasalazine (1 g/일), 비스테로이드성 항염증제 사용 시작하였으며 이후 근위부 근력 저하, 관절통 등의 임상 소견은 호전되었으며 치료 2개월째 근육 효소 수치 CK 55 IU/L, LDH 216 IU/L로 정상화되었다. 현재 치료 1년 7개월째 prednisolone (2.5 mg/일), methotrexate (10 mg/주), sulfasalazine (1 g/일), 비스테로이드성 항염증제 투여하면서 근염의 재발 소견없이 관절염 증세 잘 조절되면서 외래에서 추적관찰 중이다.
고 찰
염증성 근염은 횡문근의 혈관 주위와 간질 조직내에 단핵구, 임파구, 다핵 백혈구의 침윤을 동반하는 전신성 교원성 질환이다. 염증성 근염 환자에서 알려진 근염 특이 항체(myositis-specific autoantibody)에는 항 SRP (signal recognition particle) 항체, 항 Mi-1 항체, 항 Mi-2 항체, 항 AAS (antiaminoacyl tRNA synthetases, synthetases) 항체 등이 있으며 임상 증상이나 병의 경과와 관련이 있다. 대개 항 SRP 항체는 심각한 심질환과 연관이 있으며, 항 Mi-2 항체는 스테로이드에 감수성 있는 피부근염과 연관이 있고, 항 synthetases 항체는 나쁜 예후를 시사하는 간질성 폐질환 및 관절염과 관련이 있다[3]. 근염 특이 항체 중에서 항 synthetases 항체가 가장 연구가 많이 되었으며 이 중 항 Jo-1 (histidyl-tRNA synthetase)항체는 1976년에 근염과 간질성 폐질환을 가진 환자의 혈청에서 처음으로 분리되었다[4]. Jo-1은 tRNAs를 아세틸화하여 단백질을 합성하는데 중요한 역할을 하는 세포질 내 효소이다[5].
Marguerie 등은 1990년 항 Jo-1 항체가 양성인 29명의 환자들에 대한 후향적 연구를 통해 항합성효소증후군에 대한정의를 처음 제시하였다[1]. 항합성효소증후군은 일반적으로 항 Jo-1 항체 생성, 간질성 폐질환, 염증성 근염, 다발성관절염, 발열, 레이노 현상, mechanic's hand의 특성을 보인다.
항합성효소증후군 환자에서 관절증상은 약 90% 에서 있으며 경우에 따라 초기 증상으로 나타나기도 한다[6,7]. 항 Jo-1 항체 양성인 염증성 근염 환자의 관절증에 대한 Oddis 등의 보고에서는 21명의 항 Jo-1 항체 양성인 환자에서 12명이 관절증이 있었으며 주로 수부의 소관절, 수근골 관절 등을 침범하였다[2]. 그들은 관절증상을 1) 변형 관절증(4명) 2) 비변형 관절증(8명)으로 구분하였는데, 변형 관절증은 주로 원위지골관 관절의 침범이 있었고 아탈구가 4명 모두에서 관찰되었으며 미란은 1명에서만 있었다. 비변형 관절증은 주관절, 슬관절, 견관절의 침범이 드물었다[2]. 결론적으로 항합성효소증후군 환자에서 관절증상은 외관상으로는 류마티스 관절염과 유사하지만 몇 가지 차이점이 있었다. 첫 번째는 원위지골간 관절의 현저한 침범이 있었으며 두 번째는 관절의 미란보다는 아탈구가 더 많았고, 또한 관절 주위에 석회화나 수산화인회석(hydroxyapatite) 침착이 종종 관찰되었다[2,3]. 하지만 아탈구에도 미란이 동반되거나 류마티스 인자가 양성일 수 있어 진단에 어려움이 있다[2,8]. 그러나 Nagashima 등은 항합성효소증후군에 관절염이 동반되는 것과 항합성효소증후군에 류마티스 관절염이 중첩되는 것을 구별하는데 항 CCP 항체가 도움을 줄 것이라고 보고한 바 있다[9]. 그들은 미란성 관절증을 동반한 피부근염이 있으면서 항 Jo-1과 항 CCP 항체가 양성인 환자 2명을 보고하였고, 2명 모두 항 CCP 항체가 류마티스 관절염에 상응하는 수치로 상승하였고, 류마티스 관절염의 ACR 진단기준(American College of Rheumatology criteria)에 합당하였다. Matsui 등은 피부근염과 다발성근염에서 항 CCP 항체가 27.3-30.0% 에서 양성으로 나올 수 있으나 류마티스 관절염보다는 휠씬 낮은 수치라고 보고하고 있다[10]. 여러 연구에서 항 CCP 항체의 민감도는 류마티스 인자보다 낮으나 특이도는 류마티스 인자보다 더 높다(95-98% )고 보고하였다[11]. 그리고 항 CCP 항체는 류마티스 관절염 초기에 검출 가능하고 악화 및 예후를 판단하는 지표로 사용될 수 있어 류마티스 관절염과 다른 류마티스성 질환을 감별하는데 유용하게 쓰일 수 있다[12]. 본 증례의 환자는 원위지골간 관절의 침범이나 아탈구, 관절주위 석회화가 관찰되지 않았으며, 류마티스 인자와 류마티스 관절염에 특이적인 항 CCP 항체 양성 소견 보이고, 1시간 이상의 조조강직, 3관절 이상의 관절염, 수지관절의 관절염, 대칭성 관절염이 6주 이상 지속되어 항합성효소증후군에 동반된 다발성 관절염보다는 류마티스 관절염이 같이 병발한 것으로 판단하였다. 그러나 현재까지 보고된 항합성효소증후군에 류마티스 관절염이 중첩된 증례들[9,13-15]은 모두 골미란이 있었고 3년 이상의 추적관찰 기간이 있었다. 또한 최근 발표된 2010 ACR/EULAR (American College of Rheumatology/European League Against Rheumatism) 류마티스 관절염 진단기준[16]을 보면 다른 질병으로 설명 가능한 활액막염은 제외시키고 있어 본 증례의 환자에서 류마티스 관절염의 진단에 논란의 여지가 있을 수는 있다. 본 증례의 환자는 증상 이환 기간이 길지 않아 초기 단순 방사선 소견에서 골미란 등의 류마티스 관절염에 특이적인 소견이 관찰되지 않았고 약 1년 후 손의 단순 방사선 촬영을 다시 시행하였으나 관절강의 협착이나 골미란은 관찰되지 않았다. 이는 COBRA trial [17]처럼 질병 초기에 고용량의 경구 prednisolone을 사용하여 치료한 결과일 수도 있으나, 본 증례의 환자가 류마티스 관절염과 항합성효소증후군이 동시에 병발하였음을 분명하게 확인하기 위해서는 추후 관절의 골미란의 발생 여부를 추적관찰하는 것이 필요할 것이라 판단된다.
항합성효소증후군은 단독으로 나타날 수도 있고, 전신홍반루푸스, 경피증, 쇼그렌 증후군 등의 다른 류마티스 질환과 중첩되어 나타날 수도 있다[5]. 그중 항합성효소증후군이 류마티스 관절염과 중첩되어 나타난 예는 드물게 보고되었으며, 외국 문헌에 5예가 보고되었었다[9,13-15]. 보고된 3예[13-15]는 류마티스 관절염을 진단받고 치료 받은 지 3-6년 후에 염증성 근염이 병발하여 항합성효소증후군을 진단받은 환자였고, 2예[9]는 항Jo-1항체 양성 염증성 피부근염을 진단받고 치료받은 지 4년 후에 류마티스 관절염을 진단받은 환자였다. 본 증례의 환자는 관절증상과 염증성 근염 증상이 동시에 발생하였으며 류마티스 관절염과 항합성효소증후군이 동시에 병발한 예는 본 증례가 처음이다.
항합성효소증후군의 치료는 고용량의 스테로이드 외에는 효과가 확실히 입증된 치료가 아직까지는 없으며, 스테로이드는 다발성 관절염의 증상을 포함하여 간질성 폐질환 및 염증성 근염의 증상을 호전시킨다고 알려져 있다[3]. 이전 보고된 류마티스 관절염에 항합성효소증후군이 병발한 환자 3예에서는 대부분 스테로이드와 면역억제제 또는 항류마티스약제를 병용하여 치료하였다(Table 1) [9,13-15]. 아직 환자 수가 많지 않지만 항합성효소증후군에 류마티스 관절염이 중첩된 경우에는 스테로이드와 항류마티스약제를 병용 치료하는 것이 관절의 손상을 방지하기 위해 필요할 것이라 생각된다.
본 증례와 같이 근염과 관절염이 병발하여 나타난 경우에는 항합성효소증후군을 의심하여 항 Jo-1 항체를 포함한 면역학적 검사를 시행하여야 할 것이다. 또한 항합성효소증후군에 류마티스 관절염이 중첩되어 발현될 수 있음을 고려하여 관절증상이 있는 염증성 근염 환자에서 항 CCP 항체와 관절의 방사선학적 소견을 확인하는 것이 추후 환자의 예후와 치료 방향을 결정하는 데 있어 도움이 될 것으로 생각된다.
