호지킨 림프종의 병리학적 특징과 감별진단
Pathologic Characteristics and Differential Diagnosis of Hodgkin Lymphoma
Article information
Trans Abstract
Recent advances in the understanding of the biology of Hodgkin lymphoma have led to a new classification. Hodgkin lymphoma is now recognized as a B-cell disorder of germinal center or post-germinal center origin. In the WHO classification, Hodgkin lymphoma consists of two categories, namely, nodular lymphocyte predominant Hodgkin lymphoma and classical Hodgkin lymphoma. Classical Hodgkin lymphoma encompasses not only nodular sclerosis, mixed cellularity, and lymphocyte depletion subtypes, but also lymphocyte-rich subtype, among which, nodular sclerosis stands out as a distinct entity. A borderline neoplasm with features intermediate between Hodgkin lymphoma and diffuse large B-cell lymphoma has also been recognized.(Korean J Med 2011;81:543-553)
서 론
호지킨림프종은 배중심 및 배중심후 세포 기원의 악성 림프종이다. 최근 수년 간 그 생물학적인 특성에 관한 지식이 축적됨에 따라 정의, 범위, 아형 등에 중요한 변화가 있었다. 이에 호지킨림프종의 새로운 분류와 그 근거 및 병리학적인 특성과 감별진단에 대해 알아보고자 한다.
본 론
호지킨림프종은 현재 결절성림프구풍부형 호지킨림프종(nodular lymphocyte predominant type, NLPHL)과 전형적 호지킨림프종(classical Hodgkin lymphoma, CHL)으로 대별된다. 전형적 호지킨림프종은 종양세포가 Reed-Sternberg 세포(RS 세포)이며, 종양세포와 반응세포의 비율, 변형된 종양세포의 성상, 종양세포의 이형성, 섬유화 등에 따라 혼합세포형(mixed cellularity type, MCCHL), 결절성경화형(nodular sclerosis type, NSCHL), 림프구감소형(lymphocyte depletion type, LDCHL)과 새로 추가된 아형인 림프구풍부형(lymphocyte rich type, LRCHL)으로 구분된다. 결절성림프구풍부형 호지킨림프종(NLPHL)은 LP세포가 종양세포이며, 임상경과가 아주 좋은 저등급 B세포 림프종이다.
역사적 고찰 및 분류의 변천
1832년 림프절과 비장을 침범하는 괴질로 기술된 후, 1865년 호지킨병으로 명명되었다[1,2]. 호지킨림프종의 분류 (Table 1)는 1944년 Jackson과 Parker가 부육아종, 육아종, 육종의 세 가지 아형을 제안한 후, 1966년 Lukes와 Butler가 현대 분류법의 기초를 마련하여, 같은 해 Rye회의에 채택되었다[3-5]. Rye분류는 사용하기에 쉽고 임상적 유용성이 높아 이후 근 30년간 잘 쓰여왔다. 그러나 호지킨병이 B세포 기원의 악성종양임이 확인되고[6,7], 다른 아형이 발견됨에 따라, 1994년의 REAL 분류에서 호지킨림프종으로 개명되었고, 결절성림프구풍부성 호지킨림프종(NLPHL)과 전형적호지킨림프종(CHL)으로 나뉘고, 전형적호지킨림프종(CHL)에 림프구풍부형(LRCHL)이 추가되어, WHO 분류에 채택되었다[8-12].
호지킨림프종의 역학
호지킨림프종은 서양인에서는 악성림프종의 15-30%로서 흔한 종양이지만, 한국인에서는 드물어서 림프백혈병 및 골수종을 포함한 모든 림프세포 종양의 4.1%이다[13-17]. 인구대비 발생빈도는 한국인에서 미국인의 십 분의 일 수준이다(Table 2). 한국인에서 림프종 전체의 발생빈도가 서양인에 비해 삼분의 일 정도로 낮지만 호지킨림프종의 발생빈도는 특히 낮은 편이다. 그리고 비호지킨림프종이 지난 수십 년간 세계적으로 꾸준히 증가해왔고, 한국인에서도 매년 4% 이상 증가한 반면, 한국인의 호지킨 림프종의 발생빈도는 큰 변화를 보이지 않았다(Fig. 1).
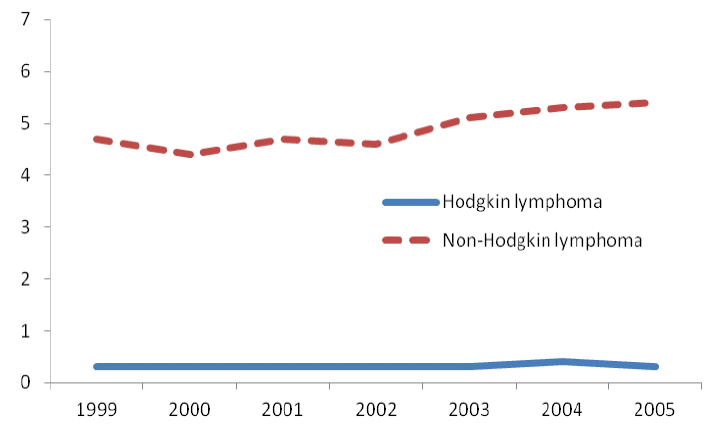
Annual incidences of Hodgkin and non-Hodgkin lymphoma in Korea in years 1999-2005. Y axis: The world agestandardized rate per 100,000 person-years (Korea National Statistical Office. Korean Statistical Information System. Available at: http://kostat.go.kr).
선진국에서 호지킨림프종은 15-34세에 가장 많이 발생하고, 55세 이후에 다시 증가하며, 소아에서는 매우 드물다[13,14]. 반면 개발도상국에서는 소아기에 가장 많이 발생하고, 혼합세포형(MCCHL)이 흔하며, 15-34세의 청년기 peak를 보이지 않는다[13,14]. 아형간 역학적 차이가 있어서, 결절성경화형(NSCHL) 등 예후가 좋은 아형은 선진국에서 발생빈도가 높으며, 주로 경제적 상류층, 핵가족에 흔한 반면, 혼합세포형(MCCHL)과 림프구감소형(LDCHL) 등 예후가 비교적 불량한 아형은 개발도상국, 소아, 노인에 주로 발생한다[13,14]. 여자보다 남자에서 1.5배 더 많이 발생하지만, 청년기에는 남녀비가 비슷하거나 역전된다. 한국인에서는 과거 전형적인 개발도상국형의 발생을 보이다가 최근에는 선진국형으로 변하는 중이다[15].
호지킨림프종은 면역이 결핍된 환자의 일부에서 발생율이 증가하며, 특히 HIV감염자에서 6-20배 증가하고, 주로 예후가 불량한 아형이며, 병기가 높고, Epstein-Barr virus (EBV)가 양성이다[18-20]. 흥미로운 사실은, 면역강화 고활성항바이러스요법 시행 이후 비호지킨림프종은 크게 감소한 반면, 오히려 호지킨림프종, 특히 결절성경화성아형(NSCHL)의 발생빈도가 증가한 사실이며, 이는 결절성경화성아형(NSCHL)을 비롯한 호지킨림프종이 면역력이 어느 정도 유지되어야 발생한다는 사실을 보여준다[19]. 장기이식 환자 중 동종이형 골수이식환자에서 6.2배 증가하며, 대게 이식 1년 이후 발생하며, EBV 양성이고, 주로 혼합세포형(MCCHL)이다[11,13,20]. 임상양상과 치료는 정상 면역인에서와 유사하다.
호지킨림프종의 원인: Epstein-Barr virus와의 관계
현재까지 가장 의심되는 병인은 Epstein-Barr virus (EBV)이다. 처음 기술될 때부터 감염원이 의심되어 왔으며, 호지킨림프종 조직에서 EBV가 발견되고, EBV의 클론성이 밝혀졌으며, 이는 EBV감염이 종양세포의 클론성 팽창 전에 일어난 것을 뜻하므로 EBV가 호지킨림프종 발생에 직접 관련됨을 보여준다[21-24]. 반면, EBV는 호지킨림프종의 일부에서만 발견되므로, EBV 없이도 호지킨림프종은 발생할 수 있다. EBV 잠복 감염된 종양세포는 LMP-1 (latent membrane protein-1), EBER (EBV-encoded early RNA), EBNA1 (Epstein-Barr nuclear antigen-1)을 발현하나 EBNA-2가 음성인 제2잠복형을 보인다. EBV는 에피좀으로 존재하며 잠복감염을 잘 유지하여 세포용해는 거의 일어나지 않는다. 대부분 EBV A 균주가 발견되나, 사람면역결핍바이러스감염환자에 발생할 경우 B균주가 흔하다. B균주는 또한 남미의 호지킨림프종 환자에서 흔하여, 균주의 분포에서 숙주의 면역의 차이 외에 지역적인 차이가 있음을 보여준다. EBV 잠복감염에서 암전환을 일으키는 기전에는 바이러스 단백, 특히 LMP-1이 중요하다. LMP-1은 세포의 활성항원, 항아폽토시스 유전자, 시토카인 등을 상향조절하고, 활성화된 종양괴사인자 역할도 하고, NFkB를 제정 활성화하는 등, 각종 신호전달체계를 유도하여 실험실조건에서 강력한 종양발생능을 보인다.
호지킨림프종에서 EBV의 빈도는 인종, 나이, 면역력, 지역, 사회경제적 여건, 조직학적 아형에 따라 20-90%까지 크게 차이가 난다[21-23]. 백인, 선진국에서 낮고, 소아, 노인, 남자에서 높다. EBV양성률이 가장 높은 아형은 혼합세포형(MCCHL) (75%)이며, 결절성경화형(NSCHL)은 낮아서 10-25%이고, 결절성림프구풍부형(NLPHL)은 0%이다. 림프구결핍형(LDCHL)과 림프구풍부형(LRCHL)에서의 양성률은 다양하게 보고되어 있지만, 림프구결핍형(LDCHL)은 양성률이 높은 편이다. 한국인의 호지킨림프종에서 EBV 양성률은 1996년 보고에서 69%에서 2010년 34.5%로 급격히 낮아졌으며, 이는 한국의 경제적 성장과 유관할 것으로 생각된다[25,26]. 호지킨림프종에서 EBV가 양성일 때, 예후에 미치는 영향에 대해선 논란이 있다. EBV양성인 호지킨림프종의 예후가 불량하다는 보고가 많았으나, 불량예후 아형이나, 면역저하 등의 요소를 제하했을 때, 독립적인 변수로서의 영향은 확실하지 않다[21,22,27]. 그리고 만성림프구성 백혈병 환자에서 fludarabine 치료 시 호지킨림프종이 증가하는데, 이때 종양세포는 EBV 양성이다[28].
전형적호지킨림프종(Classical Hodgkin lymphoma, CHL)
정의와 종양세포
호지킨림프종의 90-95%를 차지하며, 과거에는 다양한 아형을 포함하는 하나의 질병으로 생각되어 왔으나, 최근 연구결과에 따르면, 혼합세포형(MCCHL)과 림프구감소형(LDCHL)은 발생빈도, 전파양상, 면역결핍관련성 등이 유사한 하나의 연속체로 볼 수 있지만, 결절성경화성(NSCHL)은 역학적, 임상적, 형태조직학적으로 별개의 질환으로서, 원발성종격동 B큰세포림프종(mediastinal large B-cell lymphoma)이나 최근에 기술된 광범위 B큰세포림프종(DLBCL)-전형적 호지킨림프종(CHL)의 중간형태의 분류미상 B세포림프종과 연관된 질환으로 밝혀지고 있다[11,12,21,22].
종양세포인 Reed-Sternberg세포와 그 변형(Fig. 2)

Reed-Sternberg (RS) cells and Hodgkin cells. (A) Classic RS cells with large nuclei with clear karyoplasm, and huge, viral inclusion-like nucleoli and ample amphophilic cytoplasm. (B) Mononuclear RS cell (Hodgkin cell). (C) Multinuclear RS cells. (D) Mummified RS cell. (E) Bizarre, dysplastic RS cell. (F) Lacunar cell.
RS세포는 크기가 100 µm까지 되는 큰 세포로서 올빼미눈 같은 바이러스봉입체모양의 호산성 핵소체를 성글은 염색질의 투명한 띠가 둘러싸며, 핵막이 또렷한 쌍둥이 핵 또는 하나지만 크게 접혀서 두 개로 보이는 핵과 풍부한 연보라색 세포질을 가지며, 핵이 하나일 때는 호지킨세포라 한다. 이들 세포가 변성되어 핵염색질이 응축되고 세포질이 진하게 염색되면 미이라화 세포이다. 열공세포는 결절성경화성아형에 관찰되며, 포르말린 고정효과로 세포막이 주변에서 분리되어 세포가 떠 보이며, 핵이 작고, 핵소체도 희미하며, 세포질은 투명하고 풍부하며, 실 같은 돌기를 보인다. 결절성경화성아형 일부와 림프구결핍성에서 RS 세포가 기괴한 다형성을 보이기도 한다.
결절성경화형 호지킨림프종(nodular sclerosis classical Hodgkin lymphoma, NSCHL)
선진국에서 전형적호지킨(CHL)의 50-80%를 차지하며 꾸준히 증가하고 있다[21,22]. 한국인에서는 1996년 보고에서 19.5%였으나, 2010년 보고에서는 58%로 증가하여 한국인의 전형적호지킨의 역학이 변하고 있음을 알 수 있다[15,17, 25,26]. 선진국의 상류층, 청년기에 호발하며, 호지킨림프종 중에서 유일하게 여자에 호발한다[13,14]. EBV 양성률은 낮은 편이어서, 2010보고에 따르면 24%였다[26]. 대다수가 종격동을 침범하고 50% 이상에서 거대종괴를 보이지만, 비장(10%)과 골수 침범(3%)은 흔치 않다. 종격동에 발생 시 흉선을 잘 침범하며, 흉선에 낭성변성을 잘 일으킨다[21,22].
결절성경화성 호지킨림프종의 병리학적 특성(Fig. 3)
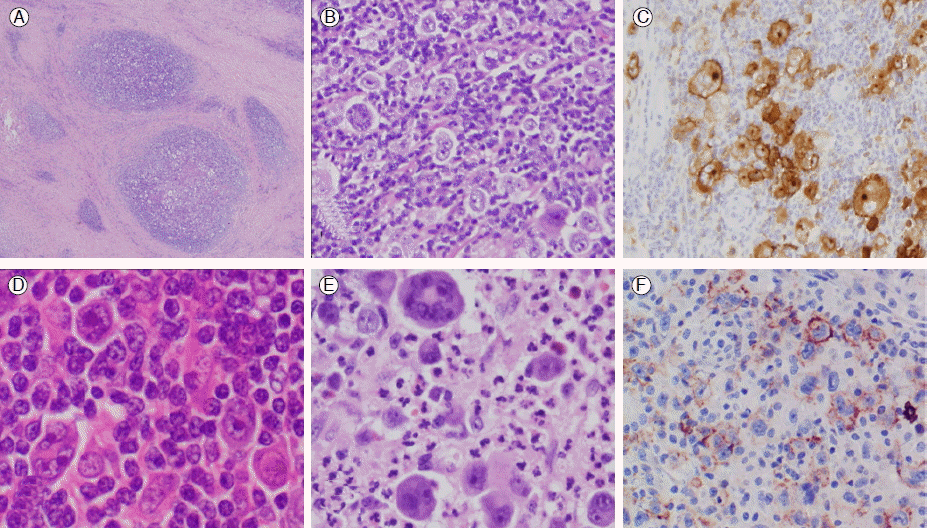
Classical Hodgkin lymphoma. (A) Nodular sclerosis type showing cellular nodules surrounded by dense collagen bands. (B) Cellular nodule of the Nodular sclerosis shows numerous lacunar cells. (C) CD30 immunostaing in the RS cells. (D) Mixed cellularity type showing frequent RS cells and macrophages. (E) Lymphocyte depleted type with numerous bizarre RS cells. (F) CD20 immunostain showing inconsistent staining in RS cells.
섬유화에 의한 경화(sclerosis)가 세포덩어리인 결절(nodule)을 동심원성으로 치밀하게 둘러싼다. 결절은 종양세포인 열공세포(lacunar cell), 소림프구, 호중구, 호산구, 대식세포 및 소수의 RS세포로 구성된다. 결절은 모양과 크기가 흔히 불규칙하고, 열공세포, 괴사, 농양 등으로 좀 파먹은 듯이 보이며, 괴사 주변에 육아종이 형성되기도 한다. 다수의 열공세포가 판상으로 관찰되면 융합변형(syncytial variant)이라 한다. 때로 RS세포가 심한 다형성을 보이기도 한다. 섬유화는 피막에서 시작하여 혈관중격을 따라 림프절 안으로 자라 들어가며, 편광현미경상 복굴절성을 보이는데, 그 양과 정도가 다양해서 세포가 많이 나오는 단계에는 콜라겐 띠가 관찰되지 않을 수 있으며, 림프절 전체가 치밀한 섬유화가 되어 세포가 찌그러져 보이면 진단이 매우 어려운 경우도 있다[22].
결절성경화형 호지킨림프종(NSCHL)의 등급
British National Lymphoma Investigation (BNLI) 등급이 대표적인 등급체계로서 그 기준은 결절 중 (A) 종양세포의 비율이 높고 괴사 25% 이상 또는 (B) 섬유 또는 섬유조직구 80% 이상 또는 (C) 림프구감소 없지만 역형성, 기괴한 종양세포 25% 이상일 때 2등급이라 정의한다[22]. 이 기준을 따르면 결절성경화형(NSCHL)의 15-25%가 2등급으로 분류되며, 불량 예후인자로 알려져 왔다. 그러나 호지킨림프종의 치료가 향상되면서 등급 간에 예후 차이가 미미해졌으며, 현재 세계보건기구 분류에서는 등급을 의무화하지 않고 있다[11,12].
원발성종격동 B큰세포림프종(mediastinal large B-cell lymphoma)과의 관계
최근 연구결과 결절성경화성 호지킨림프종(NSCHL)과 원발성종격동 B큰세포림프종은 다양한 면역표현형이 상당히 유사하여, 두 종양이 모두 흉선의 B세포에서 기원한 유관한 종양일 것으로 추측되고 있다[21,22]. 두 종양 모두 흉선 B세포에 발현되는 저친화성 면역글로불린 IgE 수용체인 CD23을 흔히 발현하며, 면역글로불린과 HLA class I 항원을 발현하지 않는 점, 원발성종격동 B큰세포림프종의 특성인 MAL 단백이 결절성경화성 호지킨림프종(NSCHL) 일부에서 발현된다는 점 등이다.
광범위B큰세포림프종(diffuse large B-cell lymphoma, DLBCL)과 전형적 호지킨림프종(CHL) 중간형태의 분류미상 B세포림프종
대부분의 호지킨림프종은 DLBCL과 쉽게 구분이 되지만, 때로 임상적, 조직형태학적 성상과 면역표현형이 두 종양 사이에 겹쳐서 분류가 애매한 림프종이 있다. 대부분은 20-40세 남자 환자에 발생하고 서양인에 흔하며, 원인은 알려져 있지 않고, EBV 양성률은 20% 이내이다[12,21,22]. 특징적으로 종격동 종괴로 발현하고, 상부 대정맥증, 호흡곤란 등을 보이기도 하며, 폐, 간, 비장, 골수로 퍼지기도 하지만, 림프절 외 기관은 거의 침범하지 않는다. 임상적으로 호지킨이나 원발성종격동 B큰세포림프종보다 더 악성도가 높으며, 항암제 치료와 방사선 치료의 복합치료가 필요하다.
광범위 B큰세포림프종과 전형적 호지킨림프종 중간형태의 분류미상 B세포림프종의 병리학적 특성
다형성을 보이는 종양세포가 광범위하게 섬유화된 기질 안에 판상으로 배열한다 종양세포는 종격동 DLBCL보다 더 크고 다형성도 심하며, 흔히 열공세포나 호지킨세포와 유사하다. 종양 내 부위에 따라 종양세포의 형태가 다양하여, 호지킨림프종으로 보이는 부위와 DLBCL로 보이는 부분이 섞여있다[21,22]. 소수의 호산구, 림프구, 조직구가 침윤되며, 괴사도 흔하지만, 호지킨림프종과 달리 괴사 내에 호중구 침윤이 없다. 말하자면, 형태학적으로 결절성경화형과 유사한 림프종이 CD30이 양성이면서 동시에 LCA와 CD20, CD79가 강양성일 때 또는 원발성종격동원발 B큰세포림프종 같이 보이는 림프종이 CD30이 양성이면서 CD20이 음성이거나, CD15가 양성이거나, EBV가 발견되면 이러한 진단범주를 사용하게 된다.
혼합세포형(mixed cellularity type, MCCHL)과 림프구감소형(lymphocyte depleted type, LDCHL)
선진국의 전형적 호지킨림프종 중 혼합세포형(MCCHL)과 림프구감소형(LDCHL)은 각각 10-30%와 1-5% 이내로 빈도가 낮은 반면, 후진국에서는 이들이 대부분을 차지한다[13,14]. 이 두 가지 아형은 역학적, 임상적, 생물학적 특성이 유사하여 사회경제적 여건이 낮은 계층, HIV감염, 남자에서 발생빈도가 높고, EBV가 대부분 양성이다. 청년기에 흔한 결절성경화형(NSCHL)과는 대조적으로, 혼합세포형(MCCHL)은 소아와 노년층에 많고, 림프구감소형은 노년층에 많다. 임상적으로도 결절성경화형(NSCHL)과 대조적으로 종격동, 흉선은 거의 침범하지 않고 주로 말초림프절과 골수를 침범하며, B증상이 흔하다. 이러한 차이에도 불구하고 현대적 치료에 잘 반응하여, 조직학적 아형간의 예후의 차이는 크게 줄어들었다[11,12,21,22].
혼합세포형(MCCHL)과 림프구감소형(LDCHL)의 병리학적 특성(Fig. 3)
혼합세포형(MCCHL)에서는 전형적 RS-호지킨세포가 림프구, 형질세포, 조직구, 호산구, 호중구와 섞여서 림프절 구조를 파괴한다. 초기에는 림프절의 소포사이에 국한되어 소포가 유지되기도 한다. 섬유화가 있기도 하지만 섬세하며, 열공세포나 팝콘세포는 보이지 않는다. RS-호지킨세포는 흔히 관찰되고 림프절 전체에 고루 분포한다. 림프구가 약간의 핵이형성을 보이기도 하지만, 만일 이형성이 심하다면 말초T세포 림프절을 감별해야 한다. 육아종이 흔히 관찰되며, 때로 조직구가 매우 많아서 storage disease로 오인되기도 한다.
림프구감소형(LDCHL)은 매우 다양한 형태를 보이는데, 기본적으로 종양세포가 림프구보다 많으며, 종양세포가 흔히 다형성을 보인다. 망상ㆍ육종형(reticular-sarcomatoid variant)과 광범위섬유화형(diffuse fibrosis type)의 두 가지 패턴이 있다. RS-호지킨 세포가 대다수인 망상ㆍ육종형은 매우 드물며, 과거에 진단된 예의 많은 수가 역형성대세포림프종(anaplastic large cell lymphoma) 등의 비호지킨림프종이 오진된 것으로 생각되고 있다[21,22]. 현재의 진단기법으로도 림프구감소형(LDCHL)의 망상ㆍ육종형과 RS 유사세포가 많은 B세포림프종과의 감별진단은 쉽지 않다[21,22]. 특히 DLBCL과 전형적 호지킨림프종 중간형태의 분류미상 B세포림프종, 그리고 노인성 EBV 양성 DLBCL과의 감별은 매우 어렵다. 광범위섬유화형은 단단히 섬유화된 기질 내에 종양세포가 뿔뿔이 흩어져 있으며, 섬유화로 종양세포가 찌그러져서 RS-호지킨세포를 확인하기가 어려울 때도 있다. 때로는 림프구는 적고 조직구가 매우 많이 보이는데, 특히 HIV환자에서 그렇다. 주의할 점은 전반적으로 림프구감소형(LDCHL)을 보이더라도 경화성 섬유밴드가 보이면 진단은 결절성경화형(NSCHL)이다.
림프구 풍부형 전형적호지킨림프종(lymphocyte-rich classical Hodgkin’s lymphoma, LRCHL)
전형적호지킨림프종의 5%를 차지하며, 소림프구로 주로 구성된 배경 내에 극소수의 RS세포가 흩어져 있는 형으로, 과거엔 흔히 결절성림프구풍부성 호지킨림프종(NLPHL)으로 분류되었다[21]. 주로 남자에 흔하며 발생 연령군은 결절성림프구풍부성(NLPHL)보다 높고, 환자는 1, 2병기의 말초 림프절 병증으로 발현하고, 거대종괴나 B증상이 드물다. EBV는 대게 음성이고, 예후는 매우 좋아서 30개월 OS가 97%이다[11,12,20,21].
림프구 풍부형 전형적호지킨림프종(LRCHL)의 병리학적 특성(Fig. 4)

Nodular lymphocyte predominance Hodgkin lymphoma. (A) Irregular, enlarged nodules with many LP cells. (B) Scanning power photograph of CD20 stain showing enlarged irregular nodules. (C) LP cell with popcorn-ike nucleus. (D) LP cell with CD20 positivity.
저배율소견상, 퇴화되고, 중심을 다소 벗어난 듯이 보이는 림프소포를 IgM, IgD 양성 B세포로 구성된 외투(mantle)와 변연부(marginal zone)가 둘러싼 결절로 구성되고 종양세포는 외투, 변연부에 흩어져 있다[21]. 종양세포를 T세포가 둘러싸서, CD20 면역염색 시, 소포의 외투가 좀먹은 듯이 보이며, 이들 T세포는 결절형림프구풍부형(NLPHL)과 달리 CD57이나 PD1 등의 소포T세포 항원을 발현하지 않는다. 소포돌기세포망(follicular dendritic cell meshwork)은 느슨하게 확장되어 있다. 림프구는 풍부하지만 호산구나 형질구는 드물다. LP와 유사한 세포가 보이기도 하고, 열공세포가 보일 수도 있다. 종양세포는 전형적인 RS-호지킨세포이지만, 다른 전형적호지킨 아형에서보다 더 크기가 작고 이형성도 적다[21]. 드물게는 미만성이거나 소포간형을 보이며, 이때는 림프구의 대부분이 B세포가 아니고, 주로 T세포로 구성된다[22].
분류미상 전형적호지킨림프종(Classical Hodgkin lymphoma, unclassified)과 림프절외 기관에서의 호지킨림프종의 진단
어떠한 아형으로도 분류하기 곤란한 증례는 무리하여 한 아형으로 분류하지 말고 분류미상 전형적호지킨림프종으로 진단한다[21]. 생검조직이 너무 작거나, 림프절외 기관의 조직이거나, 림프절을 부분적으로 침범한 경우, 생검조직의 보존이 불량하여 병리학적 검사가 불가능한 경우가 모두 여기에 해당한다.
림프절외 기관에서 전형적 호지킨림프종의 진단의 기준은 환자가 이미 호지킨림프종으로 진단되었지만 병기를 알기 위해 간, 비 생검을 한 경우, 전형적인 RS세포가 관찰되지 않더라도 여러 가지 세포가 섞인 배경에 비정형 단핵구가 관찰되면 가능하며, CD30이나 CD15가 양성이면 더욱 확실히 진단한다[21]. 반면, 환자가 이미 호지킨림프종으로 진단되지 않은 경우, 진단은 매우 조심해야 하며, 반드시 면역검사를 하여 확인해야 하고, 아형을 정하기는 매우 어렵다.
결절성림프구풍부성 호지킨림프종(nodular lymphocytic predominant Hodgkin’s lymphoma lymphocyte, NLPHL)
정의와 종양세포
호지킨림프종 전체의 3-8%를 차지하며, 임상, 역학, 면역형, 유전적으로 전형적 호지킨림프종과 크게 차이가 난다[11,12]. 남녀비가 3:1로, 주로 30-50세의 남자 환자에서 증상 없이 림프절 한 부위가 커져서 병원을 찾게 된다. 경부, 액와, 서혜부, 대퇴, 그리고 장막림프절의 순으로 발생하며, 편도, 침샘, 연조직에도 발생한다. 종격동 침범은 드물며, 골수 침범은 극히 드물고 예후가 불량하다. EBV와 무관하며, 예후는 매우 좋아서 치료 없이도 대게 문제가 없으나, 치료 후, 병기에 무관하게 늦게 재발하는 경향이 있는데, 재발하더라도 잘 치료된다. HIV 감염 환자에서 빈도는 증가하지 않는다[23]. 전형적호지킨림프종으로 변환하지 않지만 DLBCL로 일부 전환된다.
결절성림프구풍부성(NLPHL) 호지킨림프종의 종양세포인 LP 세포
Lukes & Butler 분류의 lymphocytic & histiocytic predominance형이라는 명칭에서 유래한 L&H세포[4], 또는 팝콘세포로 불려왔는데, 2008년 WHO부터는 LP세포로 칭한다. 핵은 크며, 복잡하게 주름지어 팝콘처럼 보이며, 핵인은 보통 크기로 호염기성이며, 여러 개이고, 세포질은 많지 않고 Wright 염색상 연보라색이다.
결절성림프구풍부성 호지킨림프종(NLPHL)의 병리학적 특성
저배율 소견상 정상소포 대신 소포돌기세포(follicular dendritic cells, FDC)가 느슨하게 뭉쳐서 거대결절을 이루어 림프절 구조가 파괴된다[23]. 결절은 주로 대부분 B세포인 소림프구로 구성되며, 그 안에 종양세포인 LP세포와 조직구가 흩어져 좀먹은 모양이다. 종양세포인 LP세포는 결절의 안과 밖에 모두 관찰된다. 결절을 이루는 소림프구, 조직구, LP세포, 소포돌기세포의 상대적 비율은 환자마다 다르며, 같은 림프절 안에서도 다양할 수 있다. 소포돌기세포 중에는 다핵세포 (Warthin-Fingeldey-type)가 흔히 관찰된다. 전형적인 RS세포와 유사한 세포도 드물지 않게 관찰되지만, 염색형이 달라서 전형적호지킨림프종과 감별된다. 조직구의 수는 다양하며 그 수가 많은 경우 림프조직구형(lymphohistiocytic type)이라 칭하며, 드물게는 결절 주변으로 조직구가 반지형태를 형성하기도 한다[23]. 결절 사이는 소림프구와 키 큰 내피소정맥이 채우고, 형질세포나 호산구는 드물다.
시간이 지나면 B림프구는 줄고 T림프구가 증가하며, 결절이 널리 퍼져 광범위형으로 변하는 경향이 있으며, 심하면 T-cell and histiocyte-rich DLBCL과 구분이 어렵다. 감별점으로는 광범위형 결절성림프구풍부형에서 T세포는 소포내 T세포의 특징인 CD4, CD57, PD-1이 양성인 반면, T-cell and histiocyte-rich DLBCL에서는 CD8이 양성이고, CD57, PD-1이 음성이다. 또한 남아있는 결절 모양이 HE에선 관찰되지 않더라도 소포돌기세포 항원인 CD21염색 시에 관찰이 되면 광범위형 결절성림프구풍부형으로 진단된다. 광범위형이 될 경우의 임상적 의의에 대해서는 논란이 있지만 결절성림프구풍부형 호지킨림프종에서 크게 벗어나지 않을 것으로 생각되고 있다[21,23]. 그리고 이를 T-cell and histiocyte-rich DLBCL (T/HRBCL)에 포함해서는 안된다는 생각이 지배적이다[21,23].
진행성 배아중심변환반응(progressive transformation of germinal centers, PTGC)과의 관계
진행성 배아중심변환 반응은 주로 10대 남아에서 경부림프절증으로 발현하며, 결절성림프구풍부성(NLPHL) 형과 유사한 결절을 보이나, LP세포가 관찰되지 않고, 림프절구조가 유지되며, 소포과형성(follicular hyperplasia)이 동반되는 반응성병변이다[23]. 한 림프절에서 결절성림프구풍부형(NLPHL)과 같이 관찰되기도 하며, 그 전구병변으로 생각되지만, 진행성 배아중심변환 반응은 비교적 흔한 병변인데 반해서 결절성림프구풍부성 호지킨림프종(NLPHL)은 매우 드물어, 진행률은 매우 낮은 것으로 생각되고 있다[23].
광범위 B큰세포림프종(DLBCL)으로의 전환
3-10% 정도에서 전형적인 DLBCL로 전환하며, 이때 결절성림프구풍부성 호지킨림프종(NLPHL)과 DLBCL이 한 림프절에 같이 보이곤 한다. 때로 DLBCL이 먼저 진단된 후 결절성림프구풍부성 호지킨림프종(NLPHL)이 이어서 발생하기도 한다[21,22]. 이들 DLBCL의 예후는 매우 좋은 것으로 알려져 왔으나 최근 보고에 의하면 일부, 특히 T-cell/histiocyte-rich인 조직형일 경우 공격성으로 예후가 좋지 않아서 원칙적으로 de novo DLBCL로 취급해야 한다[21,23].
호지킨림프종의 면역염색형
호지킨림프종은 일차적으로 전형적인 종양세포가 적절한 반응세포와 함께 관찰될 때 진단을 하게 되지만 확진을 위해서는 면역염색이 필요하다(Table 3). RS-호지킨세포는 CD30 (tumor necrosis factor receptor superfamily의 일원)이 거의 100%에서 양성이고, CD15 (Lewis x carbohydrate adhesion molecule)은 85%에서 양성이며, B세포기원이지만 CD20과 CD79a는 소수에서 불규칙하게 염색되며(10-40%), LCA가 음성이다[21,22]. EBV는 특히 혼합세포형과 림프구감소형에서 양성이며 EBER in situ hybridization과 LMP-1 면역염색으로 검사한다.
결절성림프구풍부형(NLPHL)의 LP세포는 CD15과 CD30이 음성이고 B세포 항원 CD20과 CD79a가 거의 100%에서 양성, LCA양성이며, 면역글로불린과 경쇄폴리펩티드인 J chain 양성이다[21,22]. B세포 전사인자 중 Pax-5 (B cell-specific activator protein, B세포 commitment에 중요)은 RS세포와 LP세포에 모두 양성이지만, Oct-2와 BOB.1 (소포생성과 면역글로불린생성에 중요)과 같이 분화가 더 진행된 B세포 전사인자는 LP 세포에서만 양성이다. 림프구 및 골수세포 발생에 필요한 조절인자인 PU.1는 LP세포에서만 양성이다[21].
반응세포도 크게 달라서 림프소포에서 발생하는 결절성림프구풍부형(NLPHL)에서는 IgD 양성인 B세포가 풍부하고, LP 세포가 소포내 T세포 특징인 CD57, PD-1 양성 T세포로 둘러싸인 반면, 전형적호지킨림프종은 T세포가 풍부하며, 리드스턴버그-호지킨세포를 둘러싸는 세포가 CD4+ CD28+CD57-이다[21,22].
결 론
호지킨림프종의 진단은 과거 전형적인 현미경 소견만으로도 진단이 되었지만, 비호지킨림프종, 상피암종, 성세포암종 등 다양한 감별진단이 필요하므로 반드시 면역염색이 동반되어야 한다. 호지킨 림프종의 아형은 형태학적 면역학적인 차이뿐 아니라 임상적으로도 서로 다르므로 정확한 아형 분류가 중요하다.
감사의 글
이 원고를 작성함에 충분한 시간을 허락해주신 편집진에 진심으로 감사드립니다.


