심방세동의 비약물적 치료
Nonpharmacologic Treatment for Atrial Fibrillation
Article information
Trans Abstract
Atrial fibrillation (AF) is the most common cardiac arrhythmia and its prevalence is expected to increase with increasing age. The risk of stroke also increases substantially with age. There are three strategies for the management of AF, that is, rate control, rhythm control and anticoagulation for prevention of embolism. Antiarrhythmic drugs are usually used for rhythm control as first line therapy but there are some limitations in using antiarrhythmic drugs for AF. Catheter ablation of AF should be considered as second line therapy. The primary indication for catheter ablation is the presence of symptomatic AF refractory or intolerant to antiarrhythmic medication. Warfarin is more effective effective in preventing stroke than aspirin and combination aspirinclopidogrel. Despite its proven efficacy, warfarin is often not well tolerated by patients, has a very narrow therapeutic range, and has a high risk for bleeding complications. Echocardiography and autopsy studies showed that the left atrial appendage (LAA) was the source of thrombi in more than 90% of patients with non-valvular AF. Percutaneous catheter-based devices have been developed to close and thereby effectively exclude the LAA from the systemic circulation. (Korean J Med 2011;81:428-433)
서 론
심방세동은 가장 흔한 심장 부정맥으로 부정맥 입원 원인의 1/3을 차지하며 뇌졸중 원인의 6-24%에 해당하는 것으로 알려져 있다. 심방세동의 유병률은 나이에 따라 증가하여 60세 미만에서는 약 1%의 유병률을 보이는데 반해 80세 이상에서는 인구의 약 9% 이상이 심방세동을 가지고 있으며 장기적으로 중풍, 심부전, 사망률을 증가시키는 것으로 알려져 있다. 심방세동은 동반되는 질환 없이도 발생되나 승모판막 질환, 심부전, 허혈성 심질환, 고혈압 등에 흔히 동반되는 것으로 알려져 있으며 심방세동의 병태생리적인 기전으로는 심방의 섬유화 및 심방 근육의 소실이 관련되어 있는 것으로 보고되고 있다. 여러 분자생물학, 유전적 원인이 제시되고 있고 결국 좌심방의 전기적이고 해부학적인 이상이 심방세동의 발생 및 진행에 관여하는 것으로 알려져 있으며 이러한 기전에 대한 이해가 심방세동 환자의 치료 방침을 정하는 데 있어 매우 중요하다[1].
심방세동이 발생하는 경우 초기 치료의 기본은 혈전 색전을 예방하기 위한 항혈전 치료 및 심박수 조절치료(rate control) 이다. 이후 환자의 상태에 따라 동율동 전환을 위한 리듬 조절치료(rhythm control) 여부를 결정해야 한다. 동율동 전환을 위한 일차적인 치료법은 약물요법이지만 동율동 전환 치료의 효과에 있어 제한점이 있어 비약물적 치료인 고주파 전극도자 절제술이 심방세동 치료법의 효과적인 수단으로 제시되고 있다[2]. 한편 혈전 색전을 예방하기 위한 항혈전 약물사용에 문제가 있는 심방세동 환자에서 뇌졸중의 예방을 위해 좌심방 부속기의 폐쇄법이 제시되고 있다.
심방세동 고주파절제술
심방세동 환자에서 심박수 조절치료(rate control)와 리듬 조절치료(rhythm control)의 효과에 대해서 많은 연구가 시행되었다. 항부정맥제의 낮은 동율동 전환 성공률, 다른 부정맥의 발생 조장, 기타 여러 부작용, 증상 개선 및 생존율 향상에 대한 불확실성 등이 약물요법에 의한 심방세동 환자의 동율동 전환 치료에 있어 제한점이 되어 왔다. 1990년대에 Cox 등에 의해 시작된 Maze 수술법은 심방의 전기적 신호전달을 변형시켜 심방세동의 비약물적 치료의 길을 제시하였으나 수술의 침습성으로 인해 보편화하는 데 한계가 있었다. 이후 심방세동의 기전에 대한 이해가 증대되고 폐정맥 내의 심근조직(myocardial sleeves)이 심방세동을 일으킨다고 알려지면서 심방세동을 유발하는 방아쇠(trigger) 역할을 하는 폐정맥을 목표로 한 고주파 전극도자절제술이 심방세동 치료법의 효과적인 수단으로 제시되고 있다. 심방세동 발생 부위인 폐정맥 내의 심근조직에 대한 국소 전극도자절제술을 시행하여 효과를 보기도 하였으나 절제술 중의 재현성 있는 심방세동 유발의 어려움, 폐정맥 이외의 부위에서 발생하는 심방세동의 문제, 높은 재발률, 폐정맥 협착 등과 같은 합병증으로 인해 최근에는 폐정맥 내의 심근조직 절제 보다는 삼차원 지도화 장비를 이용하여 폐정맥과 좌심방을 전기적으로 격리시킴으로써 심방세동의 절제 성공률을 높이고 있다[2-5]. 여러 기술적 발전을 통해 발작성 외에 지속성 및 영원성 심방세동의 전 영역에 걸쳐 고주파 전극도자절제술이 시도되고 있다.
심방세동 고주파절제술 대상 환자의 선택
약제 불응성 발작성 심방세동(drug-refractory paroxysmal AF)
고주파 전극도자절제술이 효과적인 환자군은 발작성 심방세동군이다. 미국 ACC/AHA 지침에도 반복적인 발작성 심방세동 환자에서 약물요법에 반응하지 않는 경우 고주파 절제술을 추천하고 있다. 여러 연구결과에서 항부정맥 약물 내성의 발작성 심방세동 환자군에서 고주파 절제술의 우수성이 보고되었다[2].
고주파 전극도자절제술전의 진단방법
심전도가 일차적인 심방세동의 진단방법에 해당되며 경흉부 심초음파도가 심장의 구조 및 기능을 평가하기 위해 필요하다. 경식도 심초음파도는 고주파 절제술 전에 심방내의 혈전 여부를 확인하기 위해 추천되며 전기해부학적인 3차원적인 영상(3-dimensional electroanatomical mapping, 3D EAM)을 통해 시술의 정확성 및 편의성이 증대되었고 최근 MRI 및 CT 영상을 전기해부학적인 3차원적 영상과 병합함으로써 시술 중의 방사선 피폭량을 줄이고 고주파 전극도자절제술을 좀 더 효율적으로 시행하게 되었다.
고주파 전극도자절제술의 시행 방법
심방세동의 발현양상이 심방세동의 기전 및 고주파 전극도자절제술의 시행 방법을 계획하는 데 도움이 된다. 짧은 시간 동안의 발작성 심방세동은 주로 방아쇠 기전으로 이해되며 반면에 지속성 및 영속성 심방세동은 복잡한 원인 및 해부학적인 기질 이상을 반영하는 것으로 알려져 있다. 방아쇠 기전의 대부분은 폐정맥 부위에서 기인하는 것으로 보고되고 있고 부정맥을 유발하는 기질에 대해서는 현재 많은 연구가 진행 중이다. 이러한 다양한 기전으로 인해 한 가지 방법에 의한 고주파 전극도자절제술이 아닌 다양한 전략이 제시되고 있고 현재 크게 PV isolation, LA linear ablation, ablation of LA electrophysiological target의 세 가지 방법이 시행되고 있다(Fig. 1).
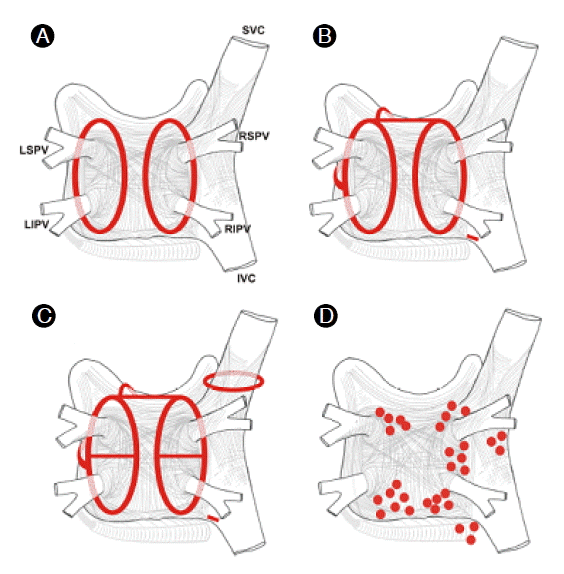
Schematic diagram in the radiofrequency catheter ablation of atrial fibrillation. (A) Circumferential ablation around the right and the left PVs. (B) linear ablation lesions. : roof line, mitral isthmus line and anterior linear lesion. (C) addition of additional linear ablation lesions between the superior and inferior PVs and electrical isolation of the superior vena cava. (D) ablation lesions when complex fractionated electrograms (CFAE) are targeted.
PV isolation
PV-LA junction을 절제하는 것이 좌심방으로부터 부정맥을 유발하는 폐정맥을 분리하는 효과적인 방법으로 알려져 있다. 이러한 PV Isolation은 발작성 심방세동의 효과적인 치료방침으로 알려져 있고 PV potentials의 dissociation 등으로 확인할 수 있다. PV isolation 단독요법 만으로 약 60-80%의 발작성 심방세동 환자에서 항부정맥 약제 없이 동율동을 유지하는 것으로 보고되고 있다. PV입구의 절제에 의한 PV isolation보다는 wide area circumferential ablation이 고주파절제술 1회 시술 또는 반복 시술 이후의 항부정맥 약제의 사용 없이 동율동을 유지하는 비율이 높은 것으로 보고하고 있다. 심방조동이 심방세동 환자에서 동반되는 경우가 많아 전형적인 심방조동이 증명되어 있거나 시술 도중에 증명되는 경우에는 추가적인 cavotricuspid isthmus ablation이 성공률을 높이는데 필요하다. PV Isolation 시술 이후의 부정맥의 재발은 흔히 폐정맥 입구부위에서 다시 전기 전도가 회복되는 것과 관련되어 있다.
LA linear ablation
PV isolation 단독요법만으로는 지속성 심방세동 환자의 정상 동율동 회복 및 유지에 불충분한 것으로 알려져 있고 이러한 환자군에서 roof line 또는 mitral isthmus line 과 같은 추가적인 절제가 부정맥 유발 기질을 제거하고 심방세동으로 진행하는 large atrial reentrant circuits을 예방할 수 있는 것으로 알려져 있다. 완전한 linear lesion이 성공률을 높이는 데 효과적이며 불완전한 linear line 일지라도 심방세동 발생을 줄이는 데에 기여하는 것으로 보고되고 있다.
Ablation of LA electrophysiological target
심방세동 환자에서의 high frequency fractionated potential 의 기전에 대해서는 정확히 알려져 있지 않고 local areas of slow or anisotropic conduction, continuously reentering impulses, temporal overlap of different activation waves 등의 여러 가설이 제시되고 있다. 일부 연구자가 이러한 병변에서의 절제술이 효과적이라 보고하였지만 좀 더 자세한 기전 및 치료에 대한 연구가 필요하리라 생각한다.
고주파 전극도자절제술의 병합요법
한 가지 고주파 전극도자절제술이 모든 심방세동 환자에서 효과적이지는 않기 때문에 여러 고주파 전극도자절제술의 병합요법이 추천되고 있고, 심방세동의 기전에 따라 다양한 치료가 제시되고 있다. Stepwise approach도 long-standing persistent AF 환자에서 제시되고 있고 좋은 성적을 보고하고 있다.
고주파 절제술의 시술 종료점(procedural end points of catheter ablation)
현재 LA-PV junction 부위에 대한 고주파 전극도자절제술의 치료에서 전기적인 PV isolation에 대해서는 대개 합의가 이루어진 상태이다. Linear lesions에 대한 conductional block이 예후를 좋게 하지만 불완전한 차단은 심방부정맥의 재발과 관계가 있다고 알려져 있다. 고주파에너지에 의한 vagal reflex의 제거가 향후 좋은 예후를 반영한다는 보고도 있다. Complex fractionated electrograms에 대한 연구는 아직까지 확립되지 않은 상태로 좀 더 연구가 필요하다.
고주파 전극도자절제술 시의 end points로서 첫째, 계획된 병변의 완성, 둘째, 절제술 동안에 심방세동의 종료, 셋째, 절제술 후에 심방세동이 유발되지 않는 세 가지가 제시되고 있다. 기전에 따라 방아쇠 유발 심방세동과 기질에 의한 심방세동 사이에는 전기생리적 및 병태생리적인 차이가 있으므로 한 가지 전략이 모든 시술에 적용될 수는 없을 것이다.
일반적으로 발작성 심방세동에는 PV isolation이 기본 시술 전략에 해당되고 약 70% 환자에서 효과적이다. 나머지 30% 환자의 경우에는 시술 도중 심방세동이 종료되거나 시술 후 부정맥이 유발되지 않아야 된다는 관점으로 보면 불충분하며 추가적인 electrogram-guided ablation 또는 linear lesions의 효과에 대해서는 아직 불명확한 상태이다. 고주파 전극도자절제술 이후에 심방세동이 유발되지 않는 경우 좀 더 좋은 예후를 보이기는 하지만 불필요한 병변 및 좌심방 조직의 손상을 가져올 수 있으므로 좀 더 연구가 필요하다.
지속성 및 영속성 심방세동에 대해서는 아직 procedural end point에 대해서는 확립되지 않은 상태이며 현재까지는 PV isolation과 LA lesions 등의 계획된 병변의 완성이 기본 시술로 남아 있는 상태이다.
고주파 절제술의 임상 종료점(clinical end points of catheter ablation)
항부정맥 약제를 사용하지 않고 증상의 유무에 관계없이 심방세동이 없어지는 것이 가장 이상적인 임상 종료점이라고 할 수 있다. 실제로 임상연구 등에 있어서는 적절한 모니터링 방법 및 허용될 수 있는 최소한의 AF burden에 대한 합의가 필요하다. 많은 연구에서 다양한 시간 간격의 홀터 검사, event monitor 검사, 심전도 등의 모니터링 방법을 사용하고 있다.
고주파 전극도자절제술 이후 대개 1-3개월의 blanking period를 두고 이 기간 동안에는 조기 재발한 경우 약제의 사용 및 DC cardioversion 등을 시행하며 있으며, 이 기간에 재발된 환자의 약 1/3의 경우에 대개 시술 3-4개월 사이에 저절로 호전되는 것으로 알려져 있다. 부정맥이 DC cardioversion 또는 약물에 의한 동율동 전환 이후 다시 재발되는 경우에는 고주파 전극도자절제술의 재시술이 추천된다.
고주파 전극도자절제술의 임상 성적
전극도자 고주파 절제술의 심방세동에 대한 효과를 항부정맥 약제와 비교한 여러 연구 결과를 메타 분석해보면 약제 투여 1년 후 정상 동율동 유지율이 약 절반인데 반해 전극도자 고주파 절제술의 경우에는 1회 전극도자 고주파 절제술 후 57%, 반복 전극도자 고주파 절제술 후 71%, 여기에 약물을 투여한 경우 77%에서 정상 동율동을 유지하는 것으로 보고하였고, 5%에서 고주파 절제술에 의한 부작용을 보고하였다. 고주파 절제술 후 5년 추적관찰 결과 약 절반 정도에서 동율동을 유지하는 것으로 보고하고 있다[6].
고주파 전극도자절제술의 안전성
고주파 전극도자절제술 시술에 대한 전 세계적 차원의 조사에 의하면 주요 합병증은 약 4.5%에서 발생하는 것으로 보고되고 있다. Cardiac tamponade가 약 1-2.2%, phrenic nerve 손상이 0.5%, gastric hypomotility 등이 보고되고 있다[6]. 고주파 전극도자절제술의 가장 심각한 합병증은 atrioesophageal fistula 이며 0.05-1%에서 보고되고 있고 약 50% 이상에서 사망하는 치명적인 합병증이다. 폐정맥 협착이 1-10% 보고되고 있고 LA-PV junction 부위에 대한 절제술 및 저강도 에너지의 사용 이후 감소하고 있다. 고주파 전극도자절제술은 심내막 손상에 의한 혈전반응을 일으켜 혈전을 형성하여 전신 혈색전을 일으킬 수 있으므로, 헤파린을 사용하여 ACT (activated clotting time)을 300초 이상 유지하도록 하고 특히 350-400초 유지하였을 경우 시술 전후의 색전의 위험성을 감소시킬 수 있는 것으로 보고되고 있다. 고자파절제술 후의 혈색전은 대부분 시술 30일 이내에 일어나는 것으로 알려져 있으므로 특히 이 기간 동안의 철저한 항혈전 치료가 매우 중요하며, 시술 이후 정상 동율동을 유지하더라도 3-6개월간의 항혈전 치료를 추천하고 있으며 위험인자에 따른 장기간의 뇌졸중에 대한 연구가 필요하다.
고주파 전극도자절제술의 적응증
현재 심방세동에 대한 리듬 조절치료를 위한 전극도자 고주파 절제술의 적응증은 1) 증상이 심한 약제 내성의 심방세동으로 한 가지 이상의 항부정맥 약제 사용 후에도 심방세동이 재발하고 증상이 있는 경우, 2) 항부정맥 약제에 대한 부작용 또는 동결절 기능부전을 동반한 빈맥-서맥 증후군에서와 같이 약제유지가 불가능한 심방세동, 3) 뇌졸중의 위험이 높거나 심부전증이 동반된 심방세동, 4) 좌심방 재구도가 많이 진행되지 않은 심방세동 환자이다.
좌심방 부속기의 폐쇄
심방세동 환자에서 심방세동이 없는 환자에 비해 뇌졸중의 위험도가 약 5배 증가하고 사망률도 약 2배 증가하는 것으로 알려져 있다. 따라서 뇌졸중 고위험도의 심방세동 환자에서는 일반적으로 항혈전 치료을 위해 와파린의 사용을 권고하는데 와파린의 사용 시 여러 제한점이 있다. 즉, 와파린 사용시 치료 범위가 좁아 출혈의 위험성이 있고 생명을 위협하는 출혈도 약 12%까지 보고되고 있다. 또한 와파린 사용 시의 적절한 항응고 효과를 위해 INR 2-3을 목표로 하는데 약 50-60%의 경우에만 적절한 INR을 유지하는 것으로 알려져 있어 INR이 3을 초과하는 경우 출혈의 위험성이 2배 이상 증가하고 INR이 2 미만인 경우 뇌졸중의 발생이 약 70% 증가하는 것으로 알려져 있다. 심방세동 환자에서 심방내에 혈전이 발생하는 경우 90%에서 좌심방 부속기(LA appendage)에서 혈전이 형성되어 혈전 색전이 발생하는 것으로 알려져 있다. 따라서 주로 혈전이 생성되는 좌심방 부속기를 기구로 막아 순환계에 노출시키지 않고자 하는 시도가 있어 왔다. 현재 좌심방 부속기를 폐쇄하는 기구로 상업적으로 이용 가능한 것은 WATCHMAN device이다. WATCHMAN device는 경피적으로 경중격 도자를 이용하여 좌심방 부속기를 폐쇄하는 기구이다(Fig. 2). 뇌졸중 위험인자를 가진 심방세동 환자를 대상으로 한 무작위 배정 와파린 대조군 대조의 3상 임상시험인 PROTECT AF 연구에서 뇌졸중, 혈전 색전, 심혈관 사망의 발생에 있어 WATCHMAN device 사용군이 대조군인 와파린 사용군과 비교하여 비열등함을 보여 주었다[7]. 따라서 항혈전 약물사용에 문제가 있는 심방세동 환자에서 뇌졸중의 예방을 위해 좌심방 부속기의 폐쇄를 고려할 수 있겠다.
결 론
고주파 전극도자절제술은 선택된 심방세동 환자군에서는 약물치료에 비해 우월한 것으로 알려져 있고 일부 연구에서 사망률을 감소시키는 것으로 보고되고 있다. 현재 다양한 환자군에서 연구가 진행되고 있으며 심방세동의 기전에 대한 자세한 이해 및 여러 기술적인 개발이 이러한 치료법을 향상시키는데 기여하리라 생각한다. 또한 항혈전 약물사용에 문제가 있는 심방세동 환자에서 뇌졸중의 예방을 위해 좌심방 부속기의 폐쇄를 고려할 수 있겠다.
