부신수질증식증이 동반된 알도스테론 분비 부신피질선종 1예
An Adrenal Cortical Adenoma with Adrenal Medullary Hyperplasia
Article information
Abstract
부신피질과 수질은 서로 다른 기원과 기능을 가지고 있으나 드물게 혼합된 임상소견을 보이는 경우가 보고되고 있다. 저자 등은 갈색세포종의 증상을 보여 시행한 호르몬 검사 상 알도스테론 분비 부신피질선종의 소견을 보인 환자에서 수술 후 병리 조직 소견상 부신피질선종과 부신수질증식증이 동반된 드문 경우가 있어 문헌고찰과 함께 국내에서 처음으로 보고하는 바이다.
Trans Abstract
The relationship between the adrenal cortex and medulla has been studied since the 1960s. Rarely, a patient with an adrenal cortical adenoma presents with the findings of pheochromocytoma. However, there has been no report of a case with the clinical features of pheochromocytoma showing the pathological features of an adrenal cortical adenoma with medullary hyperplasia on histological examination. We report a 59-year-old-man who was shown to have an adrenal cortical adenoma, with medullary hyperplasia, during a diagnostic work up for pheochromocytoma. (Korean J Med 2011;81:393-396)
서 론
부신은 기능적으로 완전히 구분되는 두 종류의 내분비선인 부신피질과 수질로 구성되어 있다. 부신피질은 당류코르티코이드, 염류코르티코이드 그리고 성호르몬의 주된 호르몬을 분비하며 부신수질에서는 노르에피네프린과 에피네프린 등이 분비된다[1]. 부신에서 기원한 호르몬 종양은 각각 부신수질과 피질에서 발생하나 드물게는 갈색세포종의 증상을 보이면서 부신피질증식증으로 진단된 경우가 있어 그 기원이 동시에 일어날 가능성이 있음을 시사한다[2]. 저자들은 갈색세포종의 임상적 양상을 보이나 수술 및 병리 조직 소견상 부신수질증식증이 동반된 알도스테론 분비 부신피질선종 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다
증 례
환 자: 59세, 남자
주 소: 심계항진증, 두통, 안면 홍조
과거력: 10년 전 고혈압을 진단받은 후 지속적으로 항고혈압약을 복용하고 있었고 당뇨병, 결핵, 간염 등의 과거력은 없었다.
가족력: 모친 고혈압으로 치료 중이다.
현병력: 내원 1년 전부터 반복적이고 발작적인 심계항진증이 발생하였으며 두통, 안면 홍조 등의 증상이 동반되었다. 또한 꾸준히 고혈압약 복용했음에도 불구하고 혈압이 조절되지 않았으며, 심계항진 증상이 있을 때 수축기 혈압이 180-200 mmHg으로 측정되어 갈색세포종에 대한 정밀검사를 받기 위해 입원하였다.
신체검사 소견: 내원 시 혈압은 171/82 mmHg, 맥박은 분당 66회, 호흡수 분당 20회, 체온 36.5℃이었고 의식은 명료하였다. 흉부 검진에서 이상소견은 없었으며, 복부 검진에서도 장음은 정상이었고 압통 및 반발통도 없었다.
검사실 소견: 입원하여 시행한 혈액검사상 백혈구 6,910/mm3, 혈색소 13.8 g/dL, 헤마토크리트 38.3%, 혈소판 269,000/mm3, 적혈구 침강속도는 11 mm/hr로 정상범위였으며 혈청 생화학검사에서 Na 143 mmol/L, K 4.1 mmol/L, AST/ALT 17/11 IU/L, BUN 18.0 mg/dL, 크레아티닌 1.2 mg/dL, 총 단백질 7.0 g/dL로 이상 소견은 관찰되지 않았다. 호르몬 검사에서는 24시간 소변 메타네프린이 317 μg/day (참고치 0-300 μg/day)로 약간 상승되어 있었고 다른 카테콜아민 및 카테콜아민 대사물은 정상 수준이었다. 코르티솔 오전 16.19 μg/dL (참고치 4.3-22.4 μg/dL), 오후 13.3 μg/dL (참고치 3.09-16.66 μg/dL), 부신피질 자극호르몬 오전 20.01 pg/mL (참고치 5-60 pg/mL), 오후 18.40 pg/mL (참고치 6-30 pg/mL)으로 정상범위였다. 레닌 앙와위 0.18 ng/mL/hr (참고치, 0.68-1.36 ng/mL/hr), 기립위 0.17 ng/mL/hr (참고치 0.24-4.7 ng/mL/hr), 알도스테론 앙와위 247.0 pg/mL (참고치 10-105 pg/mL), 기립위 247.2 pg/mL (참고치, 34-273 pg/mL)으로 보고되었으며, 알도스테론/레닌 비율은 앙와위 137%, 기립위 145%였으며, 부신 정맥 혈액 검사상 알도스테론치가 우측 부신 53.0 pg/mL, 좌측 부신 176.2 pg/mL, 하대정맥 82.4 pg/mL로 좌측 부신에서 증가소견을 보여 일차성 알도스테론 분비 선종이 의심되었다.
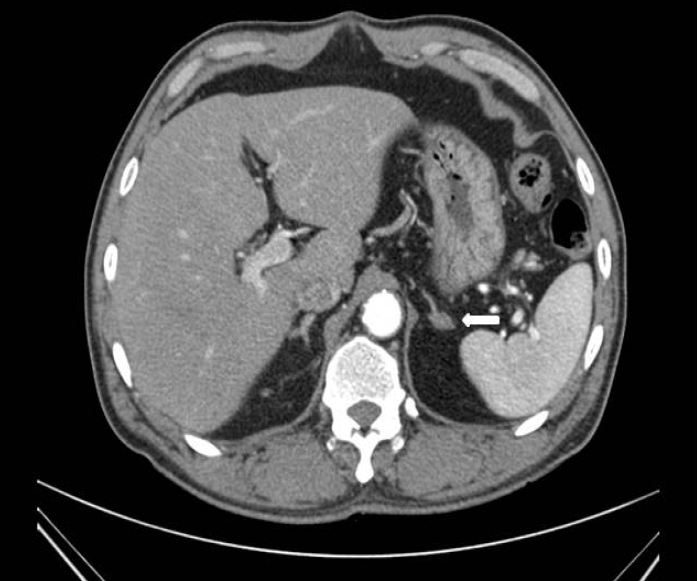
방사선 소견: 전산화단층촬영상에서 좌측 부신에 9 mm 크기를 보이는 저밀도 음영의 선종이 관찰되었으나(Fig. 1) NP59 스캔 및 MIBG 스캔에서는 특이 소견이 없었다.
치료 및 경과 : 좌측 부신 알도스테론 분비선종 의심하에 복강경을 이용한 좌측 부신 전절제술을 시행하였다. 좌측 부신에 약 1.2 × 1 × 1 cm 타원형이며 어두운 노란색의 종괴가 관찰되었으며 육안으로 관찰 시 부신수질증식증 소견이 관찰되었다(Fig. 2A). 광학현미경 검사에서도 부신피질선종의 소견이 있어 좌측 부신 알도스테론 분비선종으로 확진되었다(Fig. 2B). 또한 synaptophysin 특수 염색을 시행하여 부신수질증식증을 확인하였다(Fig. 2C). 왼쪽 부신 전절제술 후 혈압은 130/80 mmHg 정도로 고혈압 약물 사용량을 줄였음에도 불구하고 혈압 조절이 잘되고 있는 상태이며 현재 정기적으로 외래 추적관찰 중이다.
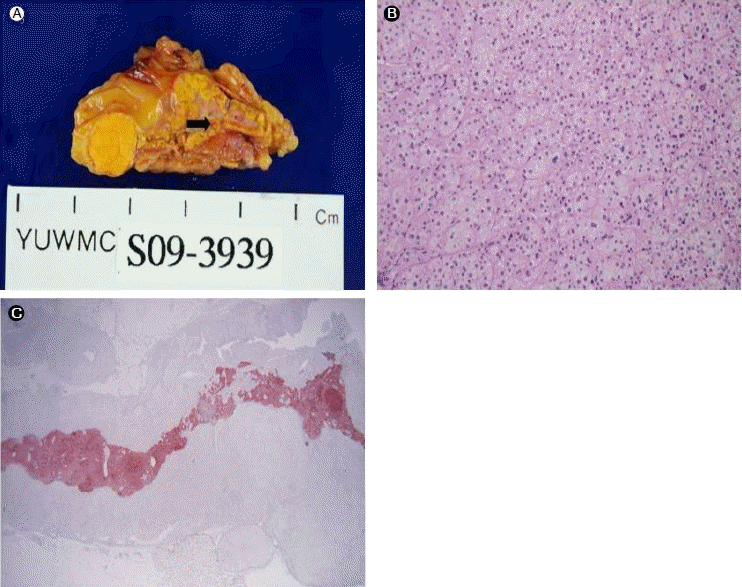
(A) Grossly, the cut surface of the left adrenal gland shows a well-defined, round, yellow, fibrotic, 1.2×1×1 cm nodule and medullary hyperplasia (arrow). (B) Microscopically, the cells are uniform in shape and size with vacuolated cytoplasm (H&E stain, ×12.5). (C) Immunohistochemically, the lesion is synaptophysin negative (adrenal medullary hyperplasia).
고 찰
부신은 쌍을 이루고 있는 구조로 사람의 경우 신장 상부에 밀착되어 존재하며 발생학적으로 중배엽에서 기원한 부신피질과 신경외배엽에서 기원한 부신수질로 나누어진다[3,4].
부신피질선종은 경계가 뚜렷한 피막에 의해 싸여 있는 2-4 cm 크기의 노란 표면을 가진 덩어리로 보이며 전자현미경에서 부신피질선종은 다발층과 그물층에서 관낭, 미토콘드리아, 지질 공포, 특히 풍부한 무과립성내형질세망이 관찰된다[5]. 부신피질 선종과는 달리 갈색세포종은 부신수질의 크롬친화성 세포에서 기원하는 신경외배엽 종양으로 윤곽이 뚜렷한 섬유 피막에 둘러싸여 있으며 3-5 cm 크기로 종양의 횡단면은 옅은 회갈색을 띠며, 괴사와 출혈 혹은 낭성의 연화된 병소들로 관찰된다[3,4].
갈색세포종의 임상적인 증상들은 카테콜아민의 지속적 혹은 간헐적 과다 분비로 인한 현상으로, 주 증상으로는 조절되지 않는 발작성 또는 지속성의 고혈압, 두통, 발한, 심계항진, 오심 및 구토, 창백, 흉골 하 동통 및 복통, 호흡 곤란 등 매우 다양하게 나타날 수 있어 이러한 경우 갈색세포종을 일차적으로 의심하여 진단하기란 쉽지 않다[6]. 갈색세포종의 일차적 진단방법은 24시간 소변에서 카테콜아민 농도를 측정하는 것으로 특이도는 95% 이상이며 민감도는 100%에 가깝다. 일반적으로 하루 소변의 총 카테콜아민 농도가 250 μg 이상이면 생화학적으로 갈색세포종을 진단할 수 있다[1].
부신피질과 수질과의 관계에 대해서는 1960년대부터 현재까지 많은 연구가 이루어져 왔으며 부신피질과 수질은 다른 기원과 기능을 가지고 있으나 드물게 혼합된 임상소견을 보이는 경우가 드물게 보고되고 있다[7-10]. 이렇게 혼합된 임상소견을 보이는 것은 Eranko와 Hanninen [8]이 처음으로 하나의 부신 세포에서 피질과 수질의 특징이 함께 공존하는 것을 기술하였다. 즉, 생화학적으로 카테콜아민이 과다 분비되는 갈색세포종의 임상 증상과 징후를 보이지만, 광학현미경에서 부신수질과 교감신경절이 보이지 않는 피질의 특징만을 지닌 2예를 보고하게 되면서 피질과 수질이 혼합된 종양세포의 존재가 거론되기 시작하였다.
Kovacs과 Horvath [9]은 1973년 사람과 쥐에서 알도스테론을 분비하는 부신피질선종 사례를 보고하였다. 이 사례에서 부신피질선종의 일부 세포에서 전자현미경상 피질의 특징인 sER과 지방 방울, 수질의 특징인 rER, 고밀도의 세포막에 결합된 신경분비 과립 등이 함께 공존하는 예를 발표하였다
Alsabeh 등[2]도 부신피질암 2예, 부신피질선종 3예에서 임상적으로 갈색세포종의 특징을 지녔으나, 이들 종양의 면역조직화학검사 및 전자현미경검사에서 수질의 특징을 확인하였다. 이들은 추적검사상 2개의 부신피질선종 환자에 있어서 수술 후 소변 카테콜라민 및 혈압은 정상화된 예를 보고 하였다.
또한 Ivsic 등[7]은 심계항진증을 동반한 조절되지 않는 고혈압 등 갈색세포종의 임상양상을 보인 환자에서 부신피질선종을 진단한 증례를 보고한 바 있다.
본 예는 발작적인 심계항진증, 두통, 안면 홍조 및 조절되지 않는 고혈압 등 임상양상이 갈색세포종의 증상을 보여 검사를 시행했으나 그 결과가 갈색세포종에 합당하지 않았고, 호르몬 검사상 24시간 소변검사에서 메타네프린이 약간 증가되어 있으며 알도스테론 분비 선종으로 의심되는 환자였다. 본 환자는 부신 절제술 결과 병리학적으로 부신피질 선종이 진단되었다. 부신 절제술 후에 수술 전 조절되지 않던 고혈압이 조절되었고, 환자 임상 증상 상 갈색세포종이 의심되는 소견을 보였기 때문에 수질증식 및 수질세포가 피질 내에 존재하지 않는지 확인해 본 결과, 부신피질선종과 동반된 부신수질증식증을 진단할 수 있었다. 따라서 본 환자의 임상증상은 부신수질의 과형성에 기인한 것으로 생각할 수 있었다.
본 예와 같이 심계항진, 두통 등 갈색세포종의 임상적 증상을 보이지만 부신피질 선종으로 진단되었으며, 임상증상은 부신수질증식증에 의한 것으로 판단된 드문 증례가 있어 보고하는 바이며 추후 그 기원을 밝히는 연구가 필요할 것으로 생각된다.