골 전이 병변의 증상 조절과 치료
Treatment of Bone Metastasis
Article information
Trans Abstract
The bone is a very common site of metastasis in patients with advanced cancer. Bone metastases can cause a wide range of symptoms and complications, such as pain, pathologic fractures, spinal cord compression, and hypercalcemia. The aim of treatment is to reduce the risk of skeletal related events, which in turn can increase quality of life and life expectancy. The main therapeutic alternatives directed at treating bone metastases in advanced cancer have been orthopedic stabilization, radiotherapy, bisphosphonates, and radioisotope treatment, in conjunction with chemotherapy or hormonal therapy. Drugs used for pain relief include non-opioid analgesics, opioid, and adjuvant analgesics. Most patients require a combination of medications for optimal pain relief. It has been demonstrated that single-fraction radiotherapy with 1 × 8 Gy is as effective for pain relief as multi-fraction regimens. Painful bone metastasis with pathologic fracture or spinal cord compression should be treated with multi-fraction long-course radiotherapy. Denosumab, a new generation of bone metastasis treatment, is a fully human monoclonal antibody that inhibits osteoclast maturation, activation, and function by binding to receptor activator of nuclear factor kappa B ligand, with the final result being a reduced rate of bone resorption. (Korean J Med 2011;81:300-306)
서 론
암세포의 골 전이의 빈도는 암 질환에 따라 다른데, 전립선 암과 유방암은 병의 진행과정 중 70%가 골 전이를 일으키며, 폐암, 신장암, 갑상선암은 40%가 골 전이를 일으킨다[1]. 통증을 동반한 골 전이는 환자들의 삶의 질을 현저히 떨어드린다. 골 전이가 진행되면 병적 골절이나 척수신경 압박 등 여러 가지 합병증을 동반하게 된다. 골 전이가 있는 암 환자들의 예후는 일차적인 원발 암에 달려 있어 폐암의 경우 중앙 생존기간은 수 개월에 불과하나, 유방암, 전립선 암, 갑상선 암의 경우 수 년간 생존하기도 한다[2]. 골 전이만 있는 환자의 예후는 다른 장기에 전이가 있는 환자보다 중앙 생존기간이 더 길다. 최근 치료성적의 향상과 함께 암환자들의 생존기간이 늘어남에 따라 골 전이의 빈도도 증가하게 되어, 이에 대한 치료 방침은 점점 중요해지고 있다.
본 론
병태생리
골 파괴 세포(osteoclasts)는 골 조직을 흡수하며, 골 생성 세포(osteoblasts)는 골 조직을 대체하여 지속적으로 뼈의 리모델링을 하게 되는데[3,4], 골 전이는 골 융해작용이 증가되고 골 조직의 흡수가 증가된다. 골 전이는 흔히 정상 뼈 조직의 파괴가 뚜렷한 골 융해성 전이(osteolytic metastasis)와 새로운 뼈의 형성이 뚜렷한 골 형성 전이(osteoblastic metastasis)로 분류된다. 대개는 두 가지 과정이 혼합되어 있어 정상적인 뼈의 리모델링에 영향을 주게 된다[5]. 성장인자가 골 기질에서 분비되어 종양세포의 성장을 자극하고, 사이토 카인을 분비하면, 골 감소증(osteopenia)으로 진행되어 병적 골절의 빈도가 증가하게 된다. 골 기질에서 칼슘의 분비가 증가하면 고 칼슘혈증을 초래하게 된다.
임상증상
골 전이가 있을 때 가장 흔한 임상 증상은 암과 연관된 통증이다[6]. 골 융해성 전이는 골 감소증을 초래하고, 이어서 기질적 통증을 유발한다. 통증은 수 주 또는 수 개월에 걸쳐 점점 심해지고, 통증을 일으키는 전이 부위를 정확히 가려내기가 어려워진다. 통증은 종종 만성적인 성격을 띄며, 국한된 통증을 호소하기도 하나, 때로는 움직임에 따른 돌발성 통증의 성격을 띄기도 한다. 그래서 통증이 지속적이기도 하고, 갑작스럽게 나타나기도 해서 각각 이를 일차적 통증과 이차적 통증으로 구분하여 불리기도 한다. 일차적 통증은 골 조직의 재흡수와 뼈 구조물의 파괴에 의해 유도되고, 미세 골절, 종양의 성장으로 인한 골막의 확장(distention of periosteum)과 신경 자극으로 유발되며, 골 조직의 붕괴 등을 초래한다. 이차적 통증은 화학적 통증 유발 물질의 분비, 신경 뿌리의 압박이나 침투, 근육 긴장으로 인한 신경자극 등에 의해 나타나기도 한다. 이러한 통증은 대개 병이 진행함에 따라서 마약성 진통제나 방사선치료, 또는 수술적 치료가 필요하다. 통증 이외도 골 전이와 연관된 임상적 특징은 병적 골절, 척수 압박, 고칼슘혈증 등의 합병증을 동반하기도 한다.
치료
골 전이가 있는 환자에서 치료의 목적은 종양 종괴를 줄이고, 종양이 진행하거나 전이되는 것을 예방하며, 통증이나 병적 골절, 고칼슘혈증 등 합병증을 막는 것이다. 골 전이의 적절한 치료는 원발 질환의 생물학적 특성, 골 전이의 상태와 정도, 환자의 기대 여명에 따라서, 내과적 치료, 방사선 치료, 수술 치료가 요구됨으로 다학제 팀의 구성이 필요하다.
합병증을 동반하지 않는 골 전이의 통증치료
전신치료
골 전이의 전신치료는 종양세포 자체를 파괴하는 치료와 종양세포에서 분비되는 여러 가지 성장인자, 사이토카인 등의 작용을 막는 치료가 있을 수 있다. 항암화학치료, 생물학적인 표적치료와 호르몬 등 내분비치료 등은 직접적인 항종양 효과를 나타내며, bisphosphonate, denosumab 등은 골 파괴세포 등 숙주세포의 종양생성물 등과 반응을 막아서 효과를 나타낸다.
통증 조절을 위한 약물치료
통증 완화를 위한 약물은 비마약성 진통제와 마약성 진통제, 보조 진통제를 포함한다. 대부분의 환자는 통증완화를 위해 이들의 복합치료가 필요하다.
비마약성 진통제
자주 쓰이는 비마약성 진통제로는 아세트아미노펜, ibuprofen, naproxen, diclofenac, indomethacin, ketoprofen, mefenamic acid, piroxicam, sulindac 등이 있으며, 코르티코스테로이드는 짧은 기간의 통증 완화에 효과적이나 장기 사용시 부작용이 문제가 된다. COX2 억제제를 포함한 NSAIDs는 골 통증이 있는 환자에서 유용하다. 아세트아미노펜은 혈소판 억제 작용이 없어 출혈경향이 있는 암환자에게 유용하다.
Ketorolac tromethamine은 강력한 NSAID로 중등도에서 심한 급성 골통증을 완화시킨다[7]. 30 mg ketorolac 혈관내 주입은 15 mg morphine을 혈관내 주사로 주입하는 것과 같은 효과이다. 하루 용량이 100 mg 미만인 경우에는 부작용이 작으나 장기 투여는 바람직하지 않다[8,9]. NSAIDs은 내성이나 신체적 정신적 의존성이 없으나 위장장애, 피부 발진, 간 장애, 신 장애, 혈소판 억제 등의 부작용을 가져 올 수 있고,20%에서 기관지 수축(bronchospasm)을 일으킬 수 있어서 아스피린 알러지나 천식이 있는 사람은 신중히 사용되어야 한다. Etodolac, meloxicam, celecoxib, nabumetone 등의 상대적으로 선택적 COX2 억제제는 위장관 독성을 일으키는 빈도가 다른 비선택적 NSAIDs에서 발생하는 위장관 독성의 빈도보다 낮다[10].
마약성 진통제
마약성 진통제는 악성 질환 외에 비악성 질환에서 유발되는 중등도 또는 중증의 아주 심한 통증의 치료에 반드시 필요한 약물이다. 환자나 가족들이 마약성 진통제에 대한 약제 내성이나 의존성 등의 두려움을 가지고 있어서 암 통증치료에 마약성 진통제를 사용하는 데 장애가 되고 있다. 환자들은 중등도의 통증에 마약성 진통제를 복용하면 더 심한 통증이 발생 시 듣지 않으면 어떻게 할까라는 두려움 때문에 통증을 표현하지 않고 견뎌보려고 하며 이것이 불충분한 치료로 이어질 수 있다. 이러한 잘못된 생각이 적절한 통증치료에 방해가 되고 있다.
Tramadol은 60 mg보다는 100 mg이 보다 효과적이며, morphin 10 mg 근육주사에 해당한다[11]. 수 시간 또는 수 일간 지속되는 간헐적인 중등도 또는 중증의 심한 통증에는 적절한 강도와 짧은 반감기를 갖는 먹는 마약성 진통제에 조절된다. 속효성 oxycodone, morphine, hydromorphone, oxymorphone은 30-60분에 통증이 완화되고, 3-4시간 효과가 지속된다. 먹는 morphone은 12시간에서 24시간 지속되는 제형이 적절하다. Transmucosal fentanyl은 5-10분 이내에 효과가 나타나서 1-2시간 지속된다. 상대적으로 지속적인 일정한 통증에는 서방형 morhine 또는 oxycodone (매 8시간 또는 12시간 복용), transdermal fentanyl (fentanyl patch) 등으로 조절되어야 하고 fentanyl patch는 24시간 또는 72시간마다 교체할 수 있다[12,13]. 마약성 진통제 사용 시, 오심이나 변비 등의 부작용 예방을 위해 예방약이 사용되며, stool softner, lactulose (15-30 mL), polyethylene glycol (17 g)이 마약성 진통제와 함께 추가적으로 사용되어 변비 발생을 예방하거나 치료하는 데 사용된다. 최근 장 운동을 교정하여 변비 발생을 줄이는 마약성 진통제도 쓰이고 있다.
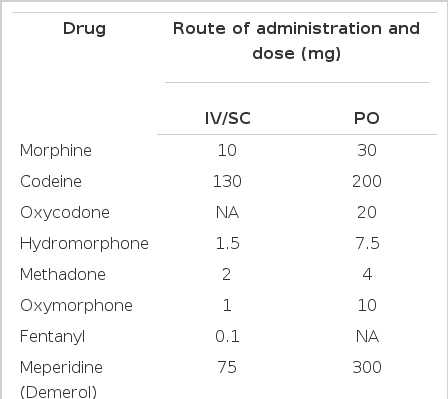
골 전이의 심한 통증으로 빠른 통증완화가 필요할 때는 정맥 주사용 마약성 진통제가 사용될 수 있으며, 적절한 통증완화가 이루어지면, oral or transdermal opioid로 교체하여 투여한다(Table 1).
Bisphosphonate
Bisphosphonate는 골 기질의 생리적 구조물인 pyrophosphate의 synthetic analogue이다. 골 파괴세포의 활동을 직접, 간접적으로 억제시켜, 골 흡수를 줄여, 골 전이로 인한 합병증을 줄이고 통증을 완화시킨다[14-16]. Zoledronate는 골 전이가 있는 전립선 암의 비교 3상 임상시험에서 골 전이의 합병증을 줄이는 효과가 입증된 첫 bisphosphonate제제로[17], 주입시간이 짧아서, 값이 저렴한 pamidronate보다 편리하며, 외래환자에게 투여가 용이하다[18]. 전립선 암 이외에 비소세포폐암, 특히 유방암에서 골 전이로 인한 합병증을 의미 있게 줄이고, 특히 유방암에서는 pamidronate보다 더 효과적이라고 보고되었다[19]. Zoledronate는 flu like symptoms을 유발할 수 있으나 증상조절은 가능하다. 신기능에 영향을 줄 수 있으므로, 신기능 장애가 있는 환자는 용량 조절이 필요하다. 장기간 bisphosphonate의 치료를 받은 소수의 환자에서는 턱뼈의 골 괴사(osteonecrosis of the jaw)가 발생할 수 있는데, 이들 환자의 대부분은 이환된 뼈의 수술적 제거가 필요하다[20]. 병적 골절이나 척수신경압박의 합병증을 줄일 수 있는 다른 약으로는 anti-DKK1 antibody and RANK-ligend inhibitor인 denosumab이 있다[21]. Denosumab은 이전의 bisphosphonate사용에 관계없이 골 흡수 표지자의 감소를 보이고, 유방암에서 zoledronate와 비교하여 골 전이로 인한 합병증을 지연시키거나 예방할 수 있다고 보고되었다[22]. Denosumab은 피하주사로 자가 투여가 가능하고 신 독성이 거의 없는 새로운 약제이다[23].
방사선 치료
방사선치료는 합병증 없는, 통증 있는 골 전이의 표준치료이다. 방사선 치료로 통증의 감소의 효과는 50-90%에서 보이며, 완전한 통증의 소멸도 10-50%에서 보이기도 한다[24]. 단선량 방사선치료(single fraction radiotherapy)는 적어도 6 Gy 이상을 의미하는데 대개는 8 Gy를 선호한다. 몇몇 무작위 임상시험에서 단선량 방사선 치료가 다선량 방사선 치료(multi-fraction radiotherapy)에 비해 통증완화 효과에 열등하지 않다는 것을 보여주고 있다[25,26].
Chow 등은 최근의 메타분석에서 16개의 무작위 연구의 5,000명의 환자를 분석하여 단선량 방사선 치료(대개 1 × 8 Gy)에서 58%, 다선량 방사선 치료(5 × 4 Gy 또는 10 × 3 Gy)에서 59%의 통증 완화의 반응률을 보이고, 통증이 완전히 사라지는 완전 반응률은 각각 23%와 24%를 보고하고 있어 양 군에서 차이가 없는 것으로 보고하고 있다[27]. 이전에 방사선 치료를 받았던 부위에 통증의 재발로 인해 다시 방사선 치료를 하는 재방사선 치료의 비율은 단선량 방사선 치료의 경우가 다선량 방사선 치료를 했을 때보다 높은 비율로 발생한다. Sze 등은 재방사선 치료의 비율은 단선량 후에 22%, 다선량 후에 7%로 의미 있게(p< 0.05) 단선량 치료에서 높다고 하였다[28]. 단선량 방사선 치료 후 재방사선 치료는 안전하고 효과적이다. 재방사선 치료의 필요성이 단선량 치료 후 더 높다는 의견은 아직 이견이 있다. Chow 등은 병적 골절이 생기는 비율이 3.2%와 2.8% (p= 0.75)로 차이가 없다고 하였으나[27], Sze 등은 방사선 치료 후 병적골절의 비율이 단선량 치료 후 3.0%, 다선량 치료 후 1.6% (p< 0.05)로 의미 있게 차이가 있다고 하였다[28]. 따라서 상대적으로 예후가 좋은 환자군에서는 장기간의 다선량 방사선 치료가 추천된다[29].
방사선 치료와 함께 bisphosphonate를 사용하여, 병적 골절을 줄일 수 있는데, 이는 ossification과 biomechanical strenth를 증가시킬 수 있기 때문이다[30]. 더욱이 삶의 질을 높이고 환자의 활동도를 높일 수 있는 장점이 있다.
방사선 치료와 관련된 가장 흔히 발생하는 급성 독성은 피부 반응과 오심, 구토, 설사와 같은 소화기 독성이다. 이 같은 독성은 단선량 치료보다는 다선량 치료에서 발생 비율이 더 높다. 방사선 치료 부위가 여러 곳일 경우 골수기능의 손상을 가져올 수 있고 이는 항암화학 치료에 영향을 주게 된다. 방사선 치료 동안에 골 통증이 간혹 악화되는 경우가 있는데, 이러한 통증이 자연적으로 소실 된다면 pain flare라고 진단할 수 있다. 자연적인 소실이 발생하지 않는다면 방사선 치료가 실패한 것이다. Pain flare는 14-44% 발생하는데, 예방적 dexamethasone의 사용으로 현저히 줄어들 수 있다[31].
Vertebroplasty and kyphoplasty
이는 척추전이로 인한 압박골절 발생 시 척추의 안정화유지와 통증을 완화하기 위해 수술의나, 마취 통증전문의 등에 의해 시행되는 중재술이다[32,33]. 척추 성형술은 polymethylmethacrylate라는 bone cement를 척추 몸체에 주입하는 것이고, kyphoplasty는 먼저 풍선을 척추몸체에 삽입한 다음 공기를 주입하고 빼낸 후 시멘트를 주입하는 것이다. 이러한 시술은 빠르게 통증을 완화하고 기능을 개선하며, 삶의 질을 높일 수 있다고 보고되었다[34].
Radiopharmaceuticals for bone pain
방사성 물질은 종양에 직접적으로 작용하는 것이 아니고 정상 골세포에서 통증 물질을 억제시켜서 통증을 완화시키는 것으로 phosphorous-32는 과거 50년 동안 골형성 전이에 80%의 통증 완화의 효과가 있었으나, 심각한 골수 기능 억제 등으로 인해 현재는 거의 쓰이지 않고 있다. Strontium chloride (89Sr)과 Samarium 153-lexidronam이 골 전이의 치료에 효과적이다. 전립선 암과 유방암의 통증을 동반하는 골형성 골전이가 있는 환자의 80%까지 Sr주입으로 통증 감소를 경험하며, 10% 이상은 완전한 통증 소멸을 보이고 있다[35]. 현재까지 이러한 방사선 동위원소의 치료는 여러 곳에 통증이 있는 골 전이 환자에서 방사선 치료나 bisphosphonate 등의 치료에 실패했을 때 이차적인 선택으로 고려된다[36]. 특히 백혈구 감소나 혈소판 감소 등 골수기능 손상이 있는 환자는 이러한 치료에 금기이며, 간이나 폐전이 등으로 항암치료 등 전신치료가 고려되는 사람은 방사선 치료가 더 좋은 선택이 될 수 있겠다.
합병증을 동반하는 골 전이의 치료
병적 골절(pathological and impending fracture)
병적 골절과 전이성 척추압박 등 골 전이로 인한 합병증은 치료 방법의 선택에 영향을 준다. 병적 골절발생 시 치료의 일차적인 목적은 통증 완화이고 이차적인 목표는 안정화의 유지와 기능의 회복이다. 병적 골절이 발생하였거나, 병적 골절의 위험이 있는 경우 가능하면 안정화를 위해, 수술이 내과적인 금기가 아니고, 기대 여명이 극히 짧은 환자가 아니라면 대개는 수술이 시행되어야 한다. 수술은 통증을 빠르게 회복하고, 움직일 수 있게 한다. Elective orthopedic stabilization은 통증완화의 결과도 좋고, 환자의 90%에서 안정화유지에 효과가 있다. 병적골절의 고위험군 환자를 미리 발견하는 일은 매우 중요하다. 체중을 지지하는 장골에 전이가 있을 때에 예방적 수술(orthopedic fixation)은 가벼운 외상으로도 생길 수 있는 골절을 피하기 위하여 필요하다.
수술이 종양조직을 완전히 제거하지 못하기 때문에 수술 후 방사선 치료가 필요하다. 방사선 치료의 주된 목적은 융해성 골 조직의 remineralization이다. Remineralization은 단기간보다는 장기간의 방사선 치료에서 더 효과적이나 의미 있는 remineralization은 방사선 치료가 끝나고 수 개월 지나 기대되기 때문에 여명이 짧은 환자의 경우는 단기간의 방사선 치료나 심지어 1회의 방사선 치료를 시행하기도 한다.
대퇴골의 30 mm 미만의 axial cortical metastasis의 경우는 통증 완화를 위해 1회의 8 Gy 방사선 요법을 추천한다. 30 mm 이상이면 병적 골절을 피하기 위해 예방적 수술이 추천된다. 방사선 치료는 통증 완화와 암의 성장을 조절할 수 있으나, stability 유지는 어렵기 때문에, 병적 골절발생 시 surgical stabilization 후 방사선 치료를 추가하는 것이 추천된다.
전이성 척수 압박
전이성 척수 압박은 허리 통증이 선행되고 점차 하지의 운동신경 마비와 자율신경 마비로 이어진다. 가장 민감하고 특이적인 검사는 MRI이며 초기에 dexamethazone의 스테로이드 투여로 일시적 호전을 보일 수 있으나 방사선 치료가 주된 치료이다.
전이성 척수압박은 단선량과 다선량 방사선 치료 모두 비슷한 운동기능을 보이고 반응률은 약 85%로 보고된다[37]. 그러나 방사선 조사 부위에 다시 척수 압박이 발생하는 경우는 고용량(30-40 Gy)의 장기간 방사선 치료보다는 저용량(8-20 Gy)의 단선량과 단기간의 다선량 방사선 치료에서 더 흔하게 발생한다. 따라서 상대적으로 예후가 좋은 환자는 10 × 3 Gy 또는 20 × 2 Gy의 장기간 방사선 치료를 받도록 되어있다[38,39]. 방사선 치료에도 신경마비가 진행되는 방사선 내성을 보이는 경우나, 병적 골절이 동반되어 안정화 유지가 필요한 경우, 그리고 조직학적 진단이 이루어 지지 않은 경우 등에서는 수술적 치료를 먼저하고 방사선 치료를 추가하기도 한다.
고 칼슘혈증
고 칼슘혈증은 암 환자의 20-30% 정도 발생하며, 신장애와 더불어 점차 의식의 저하로 나타나며, 환자의 50% 정도는 한 달 이내에 사망을 하게 되는 매우 나쁜 예후를 보인다[40]. 고 칼슘혈증의 환자에서 가장 중요한 치료는 충분한 수액주입인데, 보통 생리식염수 200-500 mL/hr를 loop diuretics와 함께 투여하여 체내에 수분을 적절히 유지하면서 칼슘 배출을 유도한다. 또 고 칼슘혈증이 발견되는 즉시 가능하면 빠른 시간 내에 bisphosphonate를 정맥주입 한다. Bisphosphonate는 골 흡수를 방지하여 혈청 칼슘농도를 떨어뜨리며, 대개 pamidronate 60-90 mg을 2시간에 주입하거나, zoledronate 4 mg을 15분 동안 정맥 주입한다. 대개 혈청 칼슘농도는 주입 후 12시간 내에 떨어지기 시작하여 4-7일에 가장 낮은 농도에 도달한다. 이외에 glucocorticoids, calcitonin, mithramycin 등이 bisphosphonate가 나오기 전에 쓰이는 약제이었으나 최근에는 거의 쓰이고 있지 않다. 급성 또는 만성 신장애가 동반되어 충분한 수액주입이 어려운 일부 환자에서는 칼슘이 포함되어있지 않는 수액으로 혈액투석을 하여 칼슘 농도를 떨어뜨리는 치료를 할 수 있다.
결 론
골 전이의 치료는 통증, 병적 골절, 척수 신경압박, 고칼슘 혈증 등의 합병증을 줄여서 삶의 질을 높이는 것이 중요하다. 통증이 있는 골 전이는 항암화학 치료와 호르몬 치료 등의 내분비 치료 등으로 종양 종괴를 줄이고, 중등도 이상의 심한 통증을 동반한 골 전이는 마약성과 비마약성 진통제를 적극적으로 사용하면서 변비나 오심 등의 부작용을 예방하고 치료하는 약이 동시에 처방되어야 한다. 골 전이의 합병증을 줄이면서 환자의 삶의 질을 높이기 위해서는 bisphosphonate가 유용한데, denosumab은 차세대 약제로 의미 있는 골 흡수 표지자를 감소시키는 결과를 보이고 있다. 방사선 치료는 골전이의 주된 치료 중 하나로, 50-90%에서 통증의 감소 효과를 보이고, 병적 골절 등의 합병증 동반 시 수술적 안정화 치료 후 추가적인 치료에 이용된다. 단선량 방사선 치료가 다선량 방사선 치료와 효과면에서 열등하지 않아 합병증이 없는 골 전이 시 단선량 치료를 권하며, 합병증이 동반된 골 전이에서는 장기간의 다선량 방사선 치료가 고려된다. 골 전이가 있는 환자 개개인의 보다 효과적인 치료를 위해서는 bisphosphonate, 새로운 전신 치료 약제의 개발, 수술적 기법, 고정밀 방사선기술 등과 이들의 복합 치료 등을 평가하는 무작위 비교 연구가 시행되어야 할 것이다.