폐 전이 병변의 치료
Management of Pulmonary Metastasis
Article information
Trans Abstract
The lung is a common site for metastasis of malignant tumors from other organs. The metastatic cascade is a complex process that involves a series of events. Tumors can spread to the lung through hematogenous or lymphangitic routes. In the absence of extrathoracic metastasis, complete resection is associated with increased survival, regardless of histology. With appropriate patient selection, life expectancy is often improved with pulmonary metastasectomy. Stereotactic body radiation therapy (SBRT) and radiofrequency ablation (RFA) are 2 approaches that have been increasingly reported for pulmonary tumors. Although these new therapies have yet to match the long-term success rates of surgical therapy, the techniques demonstrate good results in treating high-risk surgical candidates with metastatic lesions to the lungs that would otherwise be considered with resection. This review will focus on the role of local therapy in oligometastasis that arise in the lung. (Korean J Med 2011;81:289-299)
서 론
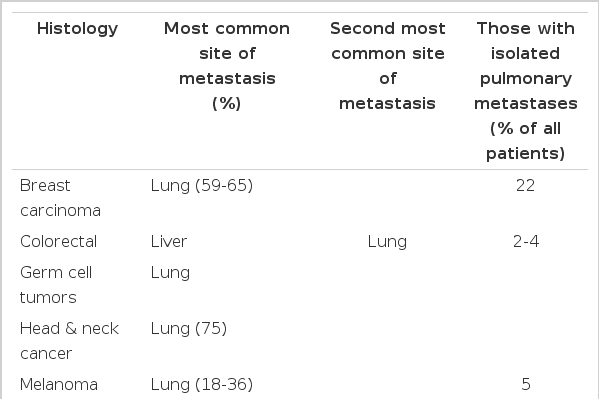
전이성 악성종양은 암사망의 가장 중요한 원인이고 그중 폐는 가장 흔한 전이부위이다. 폐로 주로 전이되는 원발성 종양은 골육종, 대장암, 유방암, 흑색종, 두경부종양 등이다(Tables 1 and 2). 폐는 혈관이 풍부하고 고농도의 산소가 항상 유지되어 전이에 유리한 환경을 제공하고 암성장을 위한 풍부한 영양을 공급하는 해부학적인 그리고 기능적인 구조상 원인으로 인해 각종 종양의 중요한 전이 부위가 된다[1].
단독 폐전이암의 표준치료는 수술적 치료이다. 폐전이암의 수술적 치료를 시행한 5,206명의 환자들을 대상으로 International Registry of Lung Metastases에서 시행한 대규모 연구에서 전체 5년 생존율은 20-40%였고, 가장 중요한 예후인자는 원발성 종양의 진단부터 전이암의 진단까지 무병기간(disease-free interval, DFI), 종양의 조직학적 분류, 전이암의 수 등이며, DFI이 36개월 이상인 경우, germ cell histology, 전이암이 한 개인 경우 가장 좋은 예후를 보였다[2].
최근 stereotactic body radiation therapy (SBRT), radiofrequency ablation (RFA) 등의 새로운 치료방법들이 소개되고 있으며, 비록 이런 치료들의 장기 생존율이 수술적 치료와 직접 비교해서 연구되지는 않았으나 수술적 치료의 적응증이 되지 않는 고위험군 환자들에게는 좋은 결과를 보여주고 있다. 두 치료법 모두 1년 생존율은 85%, RFA의 3년 생존율은 46%, SBRT의 3년 생존율은 25%을 보여주고 있다[3-5].
본 review에서는 폐전이 병변의 증상 조절과 치료 전략에 대해서 알아보고자 한다.
병태 생리(Biology)
대부분의 악성 종양은 병의 진행경과 중 드물게 신체의 다른 부위로 전이되어 절제가 불가능하게 되며, 이 경우 완치의 가능성은 낮지만 항암제를 사용하게 되며, 폐는 모든 원발성 악성종양에서 가장 흔한 전이장소이다.
악성 종양의 전이 과정은 종양의 성장, 혈관 신생, 주변조직으로의 침범, 종양세포의 혈류내 유리의 과정을 거치게 된다.
원발성 악성종양에서 폐전이가 생기는 데는 원발성 종양의 악성세포가 혈관으로 유리되는 침입기(invasion stage), 악성세포가 혈관을 따라 이동하는 색전형성기(embolization stage), 악성세포가 폐에서 조직침투를 일으키는 착상기(implantation stage)와 같은 세 가지 단계를 거친다. 색전 형성기 때 약 99%의 세포들이 여러 가지 원인에 의해 파괴되거나 제거되는 것으로 추정하고 있다[6,7].
폐전이암의 전이 기전과 전이 장소 그리고 발현 정도는 원발 종양의 생물학적 특성과 전이되는 세포 숫자, 환자의 저항력 등에 의해 좌우된다. 폐전이암의 호발부위는 없으나 폐모세혈관의 분포 및 폐혈류의 분포 양상 때문에 대부분의 경우 폐의 하엽에 위치하고, 전이된 결절의 80-90%는 폐 주변부에서 주로 발생한다[8].
전이된 결절의 수와 형태학적인 특징은 폐전이의 원인을 규명하는 데 중요한 역할을 한다. 원발 암종이 편평세포암인 경우에는 단일 폐결절은 대개 이차 원발성 종양이며, 원발 암종이 선암종인 경우는 폐결절의 전이 또는 이차 원발성 종양이고, 원발 암종이 흑색종 또는 육종인 경우는 거의 모두 전이에 의한 폐결절이다(Table 3).
혈행성 전이
폐전이암의 대부분은 혈행성 전이에 의해서 발생하고, 원발 종괴의 얇은 모세혈관벽을 침범한 악성세포의 파급에 의해서 일어나고 이들 세포의 상당수는 혈류 내에서 파괴된다.
림프성 전이
유방암이나 선암은 림프관을 따라 퍼지는 림프성 전이를 일으킨다. 복강내 림프절에서 폐문 또는 종격동 내 림프절로 전이된다.
기관지 내 전이
폐실질 또는 종격동 림프절의 기관지 침범으로 기관지를 통해 전이될 수도 있다.
증상과 징후
대부분의 폐전이 환자들은 증상이 없고, 이전에 방사선학적 검사가 시행되었기 때문에 새로운 폐병변이 보일 때 폐전이를 의심할 수 있다.
폐전이 종양의 크기가 매우 크거나 폐문부에 위치할 경우 호흡곤란, 기침, 객혈 등의 증상이 동반될 수 있다. 기관지내 전이가 있는 경우 기관지 폐쇄 부위와 그 정도에 따라 협착음, 천명, 폐확장부전(atelectasis), 폐렴 등을 야기할 수 있다. 대장암, 신장암, 유방암, 육종 등이 흔히 기관지내 전이를 일으킨다[11]. 다수의 전이성 결절에 의한 폐실질의 감소 등이 있는 경우는 호흡곤란이 서서히 발생할 수 있다. 벽측흉막 또는 흉벽으로의 종양 침범은 심한 흉통을 유발한다. 육종의 병력이 있는 환자가 자발성 기흉이나 혈흉이 발생하는 것은 폐전이를 의심할 수 있는 증상이다.
방사선학적 소견
흉부 X-선 사진
다른 영상검사와 같이 민감한 검사는 아니지만 폐전이암의 진단에 매우 특이성이 높은 검사이고 가장 쉽게 사용될 수 있다. 초기 흉부사진은 환자의 흉부상태에 대한 기준이 되며, 또한 동반되는 심폐기 질환을 파악할 수 있다. 또한 이전의 방사선 사진과 비교하면 비정상적 부위의 형태학적인 특징이나 모양의 변화를 발견할 수 있다.
그리고 폐결절의 확인뿐만 아니라 기관지내 전이를 나타내는 폐엽 또는 폐분절의 허탈을 확인할 수 있고 폐문 또는 종격동 임파선 전이, 림프성전이, 흉막삼출 등도 확인할 수 있다.
흉부 후전 및 측면방사선검사로 추적관찰하는 것이 가장 좋은 선별검사법이다. 폐외 악성종양의 병력이 있는 환자에서 다발성 폐병변이 나타나는 경우에는 거의 모든 경우에서 전이암일 가능성이 매우 높다. 그러나 만일 고립결절이 나타난 경우에는 새로운 일차성 폐암일 가능성도 있다[12].
전산화단층촬영술
조영증강 CT는 폐전이암의 확인에 가장 특이적인 검사 방법이고, 나선형 CT 및 고해상도 CT는 매우 민감한 방법으로 5 mm 이하의 작은 결절까지 발견할 수 있다[13]. 특히 폐결절의 개수와 형태학적 특징을 가장 잘 파악할 수 있는 검사이며, 수술 계획과 폐전이의 가능성이 높은 환자의 추적에 있어 가장 중요한 검사이다. 주기적인 CT촬영을 통하여 새로운 결절의 출현 또는 기존 결절의 성장을 판별하여 악성 여부를 판정하는 데 도움을 줄 수 있으며, 치료 효과를 판정하는 데도 도움이 된다.
MRI
MRI는 폐전이암의 진단에는 민감도가 많이 떨어지나 종양의 종격동 및 흉벽구조의 침범을 확인하는 데는 매우 유용한 검사이다. 특히 종양절제술을 고려하는 경우에는 매우 중요하다.
PET
폐전이암의 진단 시 PET의 유용성은 많지 않으나 신체의 다른 부위로의 전이 및 재발을 진단하는 데는 매우 유용한 검사이다.
치 료
폐전이암의 비수술적 국소 치료
폐전이암의 local ablative therapy로 RFA와 SBRT가 사용되고 있으며 그 치료법을 이용한 임상연구는 상대적으로 미미하여 수술과 직접 비교하기는 어렵다.
방사선 요법(Radiation therapy)
폐의 미세전이를 전폐 방사선조사(whole-lung radiation)하는 방법은 폐전이의 고위험군에서 20 Gy의 저용량으로 이미 30년 전에 시행되었다. 또한 동시에 폐전이가 있는 암환자에게 완결(definitive) 치료 또는 수술절제를 할 수 없는 경우에 사용되었고 간혹 수술 절제 후 재발의 위험이 높은 경우 보조요법으로 사용되기도 하였다.
1970-1980년대에 시행된 대부분의 전폐방사선조사 치료법은 골육종 또는 Ewing's sarcoma에서 주로 이용되었다[14]. EORTC에서 203명의 골육종 환자를 무작위 배정한 후 시행한 임상시험에서 원발성 종양의 완결 치료 후 항암치료만 시행한 군, 20 Gy 전폐방사선조사만 시행한 군, 3개월간의 항암치료와 방사선치료를 시행한 세 군에서 4년 무질병 생존율 또는 전체생존율에서 차이는 없었다[15].
전폐 방사선조사는 미세 폐전이의 증명된 치료법은 아니며 15 Gy의 낮은 방사선용량에서도 방사선 폐렴이 발생할 수도 있다[16].
정위 조사(stereotactic radiation)는 single dose (stereotactic radiosurgery) 또는 multiple doses (stereotactic radiotherapy)를 사용하며 원발성 폐암 또는 전이성 폐암의 치료로 많이 연구되고 있다. 대부분의 연구는 phase 1 escalating-dose 시험이고 매우 낮은 독성을 보여주고 있으나, 많은 수의 환자들이 동반되는 다른 질환으로 인해 수술의 적응증이 되지 않는 경우로 정확하게 수술과 생존율을 비교하기는 어렵다[8].
SBRT는 고용량의 방사선을 조사하는 치료로 국소 종양치료의 좋은 방법 중 하나이다. 고용량의 방사선을 사용하므로 fraction 횟수가 줄어 BED (biologically equivalent dose)가 고식적인 방사선 치료 방법보다 상당히 높다. 이 방법은 1950년대부터 뇌나 척추의 종양에 사용되었으나 폐종양에 사용되기 시작한 것은 10여 년 전부터이다. 과거에는 호흡 시 움직임과 신체 중요부위의 근접성 때문에 어려움이 많았다[17,18].
폐의 움직임은 횡격막 근처에서 가장 크고 폐첨부(apices)나 용골(carina) 근처에서 가장 적다. 호흡 시 폐의 움직임을 최소화 하는 방법 중 하나가 breath holding과 복부 압박 기구를 동시에 사용하는 것이고, CT scanner를 이용하여 계속적인 영상을 얻어 호흡 cycle에 따라서 방사선량을 조절하여 투여하는 respiratory gating도 흔히 사용된다. 마지막으로 gold fiducial을 피부를 통해 종양 근처로 삽입하여 호흡 cycle에 따라서 방사선을 조사하는 방법으로 breath holding 방법보다 소요시간이 짧은 장점이 있다[19].
SBRT의 적응증도 일반적인 RFA의 적응증과 동일하나 방사선량만 적절하게 감소시킨다면 종격동에 가까운 부위도 치료를 할 수 있다는 장점이 있다. 30명의 폐전이암 환자를 치료한 연구에서 1-, 2-, 3년 전체 생존율을 71%, 38%와 25%로 보고하고 있고 처음 폐전이의 진단부터 SBRT까지의 평균기간은 14.8개월이었다. 가장 흔한 부작용은 방사선에 의한 폐염이며 특히 고위험군 환자에서 흔하다[4,5].
RFA (고주파열치료)
RFA는 이전에는 주로 간세포암의 국소치료로서 주로 사용되었으나 최근 폐전이암의 치료로도 많이 사용되고 있다[20,21]. 정상세포를 사멸시키기 위해서는 60℃ 이상의 고열이 필요하나 종양세포는 고열에 민감하여 41℃ 정도의 열로도 세포사멸을 유도할 수 있다[22]. 미국 FDA는 세 가지 다른 RFA system을 승인하여 사용 중이다. RFA는 주로 병기 1기 또는 2기의 비소세포폐암의 치료에 효과적이고 크기가 작은 종양일수록 좋은 결과를 보인다. 간혹 다량의 객혈 등이 발생할 수 있으므로 종격동의 혈관과 가까운 종양일 경우는 주의를 요한다. RFA의 적응증은 수술을 시행하기 어려운 경우, 종양의 크기가 작은 경우, 종격동 구조와 근접하지 않은 종양인 경우, 원발성 종양이 조절 가능한 경우, 종양의 숫자가 많지 않은 경우 등으로 절제수술의 적응증과 대체로 비슷하나, 조직의 상태를 정확히 알 수 없으므로 가장자리(margin)의 침범유무를 정확히 알기는 어렵다. RFA의 목적은 100% 절제(ablation)하는 것이고 1 cm 이상의 ablation zone을 확보하는 것이 중요하다. Ablation 후 종양세포는 수일 이상 생존할 수 있으므로 너무 일찍 조직검사를 시행하여 잔존 종양을 확인하는 것은 바람직하지 않다[19].
원발부위가 대장암인 폐전이암 환자 55명을 대상으로 시행한 전향적 연구에서 RFA 후 1년 생존율은 85%, 3년 생존율은 46%로서 폐전이암의 수술 후 성적인 5년 생존율 40%보다는 높지 않지만, 수술 고위험군이나 적응증이 안되는 환자의 경우 좋은 선택이 될 수 있다[3].
시술 후 가장 흔한 부작용은 기흉이고 발생 시 흉관을 삽입해야 하는 경우도 있으나, 폐 절제 수술 후 모든 환자들이 흉관을 삽입해야 하는 것과 비교하면 대체로 안전한 시술이다.
폐전이암의 수술적 치료
수술적 절제의 적응 기준
폐전이암은 절제술을 시행 받은 환자 중 일부만이 완치되고, 또한 일부 환자만이 절제가 불가능한 환자보다 장기생존율이 높으므로, 절제술로 이득을 받을 수 있는 환자를 선택하는 것은 중요하다. 현재까지 전이암의 절제술 후 생존율을 예측할 수 있는 판단 기준은 없으나, 폐전이만 있는 환자의 대부분은 수술 이외의 다른 치료방법이 없기 때문에 수술에 대한 적절한 기준을 정하는 것이 좋을 것으로 보이며, 수술 전 기본적인 기준은 반드시 부합되어야 한다. 폐전이에 대한 폐절제술의 전향적 무작위 연구는 거의 없으며 그동안 출판된 많은 수의 후향적 연구 결과에 근거한 최소한의 환자의 선택 기준은 다음과 같다(Table 4).
① 전이의 원인이 되는 원발성 종양은 조절되었거나 또는 폐수술 후 조절될 수 있어야 한다.
② 폐 이외의 다른 장기에 전이가 없어야 한다. 전이가 있더라도 수술로 제거할 수 있거나 다른 방법으로 제거할 수 있어야 한다.
③ 전이에 합당한 방사선적 소견을 보여야 한다.
④ 환자의 전신상태가 계획된 폐절제술을 감당할 수 있으며, 폐절제술 후 적절한 폐기능이 유지되어야 한다.
⑤ 폐전이암의 완전 제거가 가능해야 한다.
⑥ 비수술적 방법으로 수술과 같거나 보다 좋은 치료 효과를 기대할 수 있을 때는 수술을 시행하지 않고, 수술 이외에 다른 효과적인 치료방법이 없는 경우에만 수술을 시행한다.
그 밖에 참고해야 하는 사항들은 폐전이 병소의 숫자, 원발암과 폐전이 사이의 무병생존기간, 암의 성장속도, 종격동 림프절 전이여부, 원발암의 조직형과 분화도, 혈중 암표지자 수치 등을 고려하여 폐절제 수술을 결정하게 되며, 이들은 개별 환자의 예후를 판단하는 데 큰 영향을 미칠 수 있으며, 폐전이가 있는 암 환자의 약 30% 정도가 위 조건에 합당한 수술대상자가 된다[23-25].
그러나 아직도 많은 부분에서 논란의 여지가 많은 상태로
① 수술 전 적절한 영상검사는 무엇인지?
② 종격동 림프절 전이 여부를 수술 전 검사하여야 하는지, 수술 중에 하면 되는지, 아니면 하지 않아도 되는지?
③ 개흉술로 수술해야 하는지 아니면 비디오 흉부수술로도 가능한지?
④ 폐전이가 재발하였을 때 어떠한 적응증으로 재수술을 시행하는 것이 좋은지?
⑤ 항암화학치료와 폐절제수술을 어떻게 조합하여야 효과적인지?
⑥ 고주파 소작이나 사이버나이프와 같은 다른 국소치료법의 효과는 어떤지?
⑦ 원발암의 종류에 따라 폐절제술의 효과는 어떻게 다른지?
등에 대한 명확한 근거는 없어 경험에 따라 다양한 형태로 치료를 하고 있는 실정이고 영상의학의 발전, 항암치료의 발전 등에 따라 계속 변화하고 있는 분야이다.
폐전이암의 제거에 영향을 미치는 예후 인자
폐전이 절제술 후 예후를 판정하는 기준, 즉 장기생존율에 영향을 미치는 인자들에 대한 보고는 많이 발표되었으며, 대부분의 보고에서 종양부재기간, 종양배가시간, 전이된 폐결절의 수 등이 예후에 중요한 영향을 미치는 것으로 인정되고 있고 또한 각각의 조직학적 특성도 중요한 인자이다(Table 5).
절제가능성
전이된 모든 결절을 완전히 절제할 수 있는 경우에 좋은 결과를 보일 수 있으며, 방사선검사의 민감도와 제거할 수 있는 결절의 제한성에 의해 예후는 상당한 차이를 보일 수 있다. 수술 시 직접 확인되는 결절의 약 50% 정도만이 방사선검사로 발견될 수 있으며, 늑막전이, 횡경막전이, 심낭전이, 악성세포가 포함된 늑막삼출, 림프절을 침범한 종양 등에 있어서는 절제가 불가능 한 것으로 판단되며, 환자의 폐기능에 따라 절제 범위가 제한될 수 있다[25].
절제된 전이암의 수
이론적으로는 전이된 결절의 수가 많을수록 환자의 예후는 안 좋을 것으로 보이나, 실제로는 단일 또는 다수의 폐전이와 생존율과는 연관성이 없는 것으로 보고되고 있으며, 전이된 결절의 수보다는 완벽한 절제가 이루어졌는지의 여부가 예후에 더 중요하다[25].
무병기간(disease free interval, DFI)
무병기간은 원발성암을 수술할 때부터 전이가 발견될 때까지의 기간을 말하며 종양의 생물학적 침략성에 의해 좌우된다. 일반적으로 골육종, 연조직 육종, 유방암, 대장암, 신장암에서는 종양부재기간이 예후와 밀접한 관련성을 가지고 있는 것으로 알려져 있으며, 종양부재기간이 1년 이하인 경우 생존율이 낮은 것으로 보고되고 있고, 5년 이상인 경우 환자의 예후에 좋은 영향을 미칠 수 있다는 보고가 있지만 조사 결과에 차이가 많아 아직 통계학적 유의성은 검증되지 못하고 있다. 그러나 Ewing's sarcoma는 생존율과 연관성이 없는 것으로 보고되고 있다[25].
종양배가시간(tumor doubling time)
종양의 크기가 배로 증가하는 시간을 말하며, 종양배가시간이 폐전이암의 절제술 후 예후에 미치는 영향을 증명하기 위하여 많은 노력이 이루어졌다.
일반적으로 종양배가시간이 길수록 예후가 좋으며, 한 연구에서는 40일 이하의 빠른 종양배가시간을 보이는 경우에는 치유가능성이 유의하게 감소하는 것으로 보고하고 있다.
그러나 종양배가시간을 측정하기 위해 전이암의 절제시기를 늦춘다는 것은 불필요한 일이며, 수술적 절제의 적응기준에 합당한 환자에 있어서는 절제술을 적극적으로 시행해야 할 것이다. 최근 문헌에 따르면 종양배가시간은 예후인자로서의 중요성이 감소되고 있다.
종양의 조직형
종양의 조직형은 폐전이암의 수술 후 예후에 큰 영향을 미치는 것으로 알려져 있다. 육종이나 신장암과 같이 다른 장기에 전이되기 전에 폐로 먼저 전이 되는 성향이 있는 종양에서는 폐전이암 절제수술로 좋은 결과를 기대할 수가 있으나, 흑색종의 경우는 폐전이가 있을 때는 이미 뇌 등 다른 장기로 전이가 있는 경우가 많아 예후가 대단히 불량하다(Table 6).
수술 전 방사선검사
수술 전 검사 시 발견된 결절의 수가 예후와 관련이 있다는 보고들이 있으나, 수술 전 검사로 판단된 결정의 수는 수술 시 발견되는 수의 50% 정도에 불과하며, 제거할 수 없는 부위의 결절을 포함하고 있기 때문에 예후를 판단하기에는 부족한 점이 많다.
기타 다른 예후 관련 인자
종격동 림프절이 침범된 폐전이 환자에서 절제술이 시행되는 경우가 매우 드물기 때문에 림프절의 상태가 절제술 후 예후에 미치는 영향에 대해서는 보고된 바가 거의 없다. 그러나 연조직 육종의 경우 폐문부 또는 종격동의 림프절이 침범된 경우 장기생존율이 낮은 것으로 알려져 있다[25].
일측 혹은 양측 병변의 경우는 전이된 종양의 완전 절제가 이루어진 경우에는 질병이 양측에 있더라도 생존율과 관련이 없는 것으로 보인다.
수술 전 또는 수술 후 보조항암화학요법을 받은 환자와 받지 않은 환자에서 수술 후 생존율에 대한 대단위 연구는 시행되지 않았으나 일부 보고에서는 수술 전 화학요법이 생존율에 영향을 미치지 않는 것으로 보고되고 있다.
수술적 절제 방법
폐전이암은 추후에도 계속 발생할 수 있는 가능성이 있기 때문에 한 번의 수술로 가능한 많은 정상폐를 남기고 전이암을 절제하는 것이 원칙이다. 다행히 폐전이암은 폐주변부 흉막하에 주로 위치하고 있기 때문에 대부분 쐐기절제술(wedge resection)이 가능하고, 드물게 너무 깊게 위치한 경우 구역절제술이나 엽절제술을 시행한다. 병변의 위치와 양측성 여부에 따라 개흉술 또는 정중흉골절개술(median sternotomy)로 접근한다. 폐가 부풀려져 있는 상태에서는 결절이 잘 촉진되지 않으며 적절한 안전 경계를 위한 충분한 폐조직을 절제하기가 어렵기 때문에 이중관 기관 내 튜브를 이용하여 일측폐를 완전히 허탈시켜 수술한다. 개흉 후 종격동, 흉벽, 폐문부 등을 완전하게 검사해야 하며, 촉진되는 모든 결절을 절제해야 한다[8,25].
접근방법에 따른 장기생존율, 이환율과 사망률의 차이는 없으나, 정중흉골절개술은 양측 폐를 동시에 검사할 수 있고 한 번에 양쪽 모두 수술할 수 있다는 장점이 있다. 그러나 이전에 흉부에 방사선치료를 받았거나, 좌하엽 중앙부 또는 뒤쪽 병변인 경우, 폐수상절제술이 필요한 경우, 심장이 크고 흉골후방 공간이 좁은 비만 환자에서는 개흉술로 접근하는 것이 용이하나 양쪽을 동시에 수술할 수 없다는 단점이 있다.
폐실질 속 깊은 곳에 위치한 결절은 정확한 병변 범위를 판정하기 어렵고 절제가 어려우며, 모든 결절을 다 확인하기 힘들기 때문에 폐전이암에서는 비디오 흉강경 수술의 효용성이 적다.
조직학적 특성에 따른 폐전이암의 치료 결과
일반적으로 폐전이의 폐절제 수술 성적은 5년 생존율이 30-40% 정도로 알려져 있는데 각 암에 대한 폐전이 수술의 성적은 다음과 같다.
골육종
골육종은 대부분 폐로 전이되며, 효과적인 항암치료가 시행되기 이전에는 5년 생존율이 10-20%에 불과하였으며 수술을 시행 받은 환자의 80%가 폐전이로 사망하였다. 수술치료만으로 치료 시 1년 사망률 50%, 2년 사망률 88%, 3년 사망률 95%, 5년 이후에는 생존자가 없을 정도로 예후가 불량하였으나 유도 또는 보조 항암치료가 등장한 이후에는 상당한 생존율의 증가가 있어 현재는 5년 생존율이 30-50%로 증가하였다. 진단 시 이미 폐전이가 있는 경우는 예후가 매우 불량하며, 술전 유도항암치료 후 수술 시 조직학적 반응은 장기 생존의 중요한 인자이다[26,27].
연조직 육종
연조직육종은 mesenchymal connective tissue에서 유래하는 악성종양으로 주로 사지에서 발생하며 가장 흔한 전이부위는 폐이나 절제술의 결과는 골육종과 같이 우수하지는 않다. 이런 종양은 항암치료에 덜 민감하고 선행항암치료가 수술적절제와 생존율을 향상시킨다는 보고는 없어 적응증에 해당하는 경우 절제술을 시행하는 것이 유리하다.
Momorial Sloan-Kettering Cancer Center (MSKCC)에서 1982년부터 1997년까지 3,149명의 연조직육종 환자를 대상으로 분석한 자료에서 폐전이는 719명의 환자에게 발생하였으며, 원발성 종양의 부위, grade, 조직소견에 따라 폐전이의 빈도가 다르게 나타났다. 폐전이의 빈도는 leiomyosarcoma 21%, malignant fibrous histiocytoma 18%, synovial sarcoma 14%, liposarcoma 12%였고, 사지의 육종이 내장(visceral) 육종보다는 폐전이가 흔하게 보였다. 완전 절제술 후 무병생존기간은 12개월이었고 저분화도의 조직소견일 경우 좋은 예후를 보였고, 50세 이상인 경우, liposarcoma, malignant peripheral nerve tumor인 경우 나쁜 예후를 보였다. 폐절제술을 시행한 213명의 환자들 중 161명이 완전절제되었고 이들은 3년 생존율 46%, 5년 생존율 37%였다[28].
255명의 환자를 메타분석한 EORTC 연구에서도 완전절제술 후 3년 생존율 54%, 5년 생존율은 38%였다[29].
M.D. Anderson Cancer Center (MDACC)와 National Cancer Institute (NCI) 등에서는 수술적 절제술 후 다시 폐전이가 재발 시에 재수술을 시행하여 중앙생존기간 20-28개월 정도의 좋은 결과를 보고하고 있다[30,31].
대장암
대장암은 주로 주변 임파선, 간, 폐로 전이되고 다른 부위의 전이 없이 폐로만 전이되는 경우는 드물다. 수술을 시행한 1,578명의 대장직장암을 대상으로 분석한 연구에서는 8.7%에서 폐전이가 생겼으며 이 중 1% 만이 절제술이 가능했다[32]. 대장암과 직장암 사이에 간전이의 빈도는 비슷했으나 폐전이는 직장암 수술 후에 더 흔했으며, 이는 직장암의 aggressive nature와 간문맥과 전신 혈관으로 바로 전이되는 경향 때문으로 보인다. 절제술과 관련된 사망률은 0-1.9% 정도로 매우 낮으며, 5년 생존율은 31-44%, 10년 생존율은 19-30%였으며 CEA 수치만이 생존율에 영향을 미치는 유일한 인자였다(Table 7) [33].
육종의 경우와 같이 폐절제술 후 다시 폐전이암의 재발 시 재수술도 생존율을 의미 있게 향상시켰다. 폐절제술 시 종격동 임파선이 양성인 경우 나쁜 예후를 보였고, 간전이와 폐전이가 동시에 있는 경우 수술적 적응증이 되는 경우는 드물고 수술을 시행하여도 예후는 불량하다.
유방암
유방암의 폐전이는 혈행성 전이보다는 internal mammary 또는 종격동 임파절을 통한 림프성 전이가 흔하다. 단독 폐전이암인 경우 폐절제술 시 결과가 우수하나 단지 1%의 환자들만이 폐에만 한정되어 전이된다. 수술 시 5년 생존율 38%, 10년 생존율 22%, 15년 생존율 20%이고 ER/PR 유무와 완전절제의 유무가 가장 중요한 예후인자로 알려져 있다[34].
특히 유방암은 최근 항암제 및 호르몬 치료 등 전신치료의 효과가 우수하고 estrogen receptor 등 더욱 큰 예후 예측인자들이 존재하여 장기 생존은 폐절제 수술 자체보다는 적절한 항암화학치료 또는 호르몬 치료가 더 중요할 것으로 생각되고 있다. 또한 폐전이의 완전절제와 더불어 전이의 진단 및 marker study의 목적도 수술을 결정하고 시행하는 과정에서 매우 큰 비중을 차지한다.
신세포암
신세포암 환자의 33%에서 전이암이 발생하며 주로 폐, 간, 뼈, 뇌, 부신 등으로 전이된다. 이 경우 수술적 절제술 후 5년 생존율은 44%이며, 예후인자로서 첫 재발 시 단일병변, 완전 절제 유무, 12개월 이상의 무병생존기간 등이 있다[35]. 그러나 이 수치는 폐 이외의 다른 장기에도 전이가 있었던 경우이며 이들에 대한 절제술을 받은 환자를 포함한 자료이다. 최근 표적치료제의 발달로 폐전이에 대한 수술의 효과가 재정립 되고 있으나 치료에 반응하지 않는 환자에서 폐절제 수술의 역할은 향후 더 연구가 필요하다.
생식세포종양(Germ cell tumors)
고환의 비정상피종 배세포암(nonseminomatous germ cell tumor)은 폐전이를 포함하여 신체 여러 부분에 광범위하게 전이되며 항암화학요법에 매우 민감하다. Cisplatin을 포함하는 항암화학요법을 시행하는 경우 90% 이상의 완치율을 보이며, 폐절제술 후 최대한 장기 생존을 기대할 수 있다[36].
그러나 항암화학요법에 잘 반응하지 않거나, 부분적 반응을 보이며 항암치료를 시행하는 중에도 재발하는 경우, 2차 또는 3차 항암치료 후에도 재발하는 경우, 종양표지자의 상승, 약물치료 후에도 종괴가 남아 있어 종양세포의 생존 여부를 판단할 필요가 있는 경우에는 개흉술의 적응증이 된다.
수술 시 CT에서 보이는 모든 종양이 제거되어야 하고, 절제한 전이암종이 모두 괴사되었거나 양성의 기형종만 남아 있는 경우 예후가 좋은 것으로 알려져 있다.
두경부 악성 종양
폐는 두경부 악성 종양이 흔히 재발되는 부위로, 두경부 종양 환자의 경우 대부분의 환자가 흡연력이 있고, 이차적인 원발성 폐암의 발생률도 높아 전이암과의 구별을 위한 절제술이 필요하며, 5년 생존율은 44% 정도로 보고되고 있다. 만약 단일 폐결절이고 두경부종양과 폐암이 모두 편평세포암일 경우 원발성 폐암과 전이암을 구분하는 것은 불가능하며, 그 병변이 수술 가능할 경우 원발성 폐암에 준해서 절제술을 시행하여야 하며, 다발성 폐결절일 경우 반드시 조직검사를 시행하여야 확인해야 한다. 현재 두경부종양의 폐절제술의 효과는 아직 불확실하며, 5년 생존율은 50% 정도 되며, 조직학적 세포형에 따라 예후가 차이가 있어 Liu 등은 편평세포암의 경우 34%, glandular tumor 64%, adenoid cystic carcinoma의 경우 84%의 5년 생존율을 보고하였다[37].
흑색종
흑색종이 원격전이를 한 경우 예후는 매우 불량하기 때문에 매우 신중하게 환자를 선정해야 한다. 원발 흑색종양이 완전히 치료되었고, 폐전이의 수가 많지 않으며, 폐 이외의 원격 장기로의 전이 병소가 없으며, 원발 흑색종 절제와 폐전이 진단 사이의 기간이 길고, 폐병변을 완전절제할 수 있으며, 흉부내 림프절 전이가 없어야 하며, 암 성장 속도가 늦은 암인 경우에 시행하는 것을 추천한다.
부인암
폐는 자궁암의 가장 흔한 전이장소이고, 폐전이만 있는 경우는 대략 6% 정도 발견된다. 자궁암의 폐전이암의 수술 성적은 5년 생존율이 53%이고, 중앙생존기간은 선암인 경우 46개월, leiomyosarcoma인 경우 25개월이다[38,39]. 완전 절제 유무, 무질병기간, 3개 이하의 전이 수 등이 중요한 예후인자이고, ER/PR 수용체 양성인 경우 80%의 반응률과 33개월의 중앙생존기간을 보이고 있다[25].
자궁경부암의 단독 폐전이는 1.5-6% 정도이고 수술 후 성적은 5년 생존율이 0-52% 정도이다[25].
간암
간암의 폐전이에 대한 수술은 많이 이루어지지 않고 있으나 환자 선택을 잘 하는 경우 장기 생존율을 기대할 수 있다.
결 론
폐에만 국한된 여러 가지 악성 종양의 폐전이암은 절제 가능하고 절제 후 적절한 폐기능의 유지가 가능하다면 폐절제술이 가장 좋은 방법이다. RFA와 SBRT는 덜 침습적이나, RFA와 SBRT만으로 모든 폐병변을 제거할 수는 없으므로, 비록 좋은 폐기능 상태를 가지고 있더라도 출혈이나 air leak 등의 합병증의 위험이 높은 수술 고위험군, 이전에 완전 수술적 절제술을 시행한 후 다시 재발한 경우에는 RFA 또는 SBRT 등이 좋은 대안이 될 수 있다(Fig. 1).
현재 이런 치료법들의 비교임상연구는 각각의 치료법들이 여러 가지 원발암들을 대상으로 시행했기 때문에 전무한 실정이고 그나마 대장암의 폐전이 경우가 가장 많이 보고되고 있다. 또한 폐전이암에 대한 치료의 성적은 대부분 후향적 연구 결과이기 때문에 여러 가지 바이어스(bias)가 있을 수 있음을 고려하여 평가하여야 하고, 각각의 치료에 대한 장기 생존이 가능한 환자를 선택할 수 있는 예후 예측인자에 대한전향적 무작위 연구가 필요할 것으로 보인다. 폐전이암의 치료로서 수술적 요법, RFA, SBRT를 적절하게 병용해서 사용하거나 병변의 수, 위치, 폐기능, 수술 위험도에 따라서 개별 환자를 적절하게 치료하는 tailor 치료가 향후 많이 이용될 수 있다.