간세포암종 환자에서 경동맥화학색전술 후 발생한 폐색전 사망 1예
A Fatal Case of Pulmonary Embolism after Transcatheter Arterial Chemoembolization for Hepatocellular Carcinoma
Article information
Abstract
경동맥화학색전술은 진행된 간암환자에서 가장 흔히 시행되는 고식적 치료이다. 경동맥화학색전술 시행 후 다양한 정도의 합병증이 발생할 수 있는데, 폐색전증은 매우 드문 합병증이다. 이에 우리는 3번째 경동맥화학색전술 시행 후 폐색전증으로 인한 사망한 환자 1예를 보고하는 바이다.
Trans Abstract
Transcatheter arterial chemoembolization (TACE) is one of the most common palliative treatment modalities for patients with advanced hepatocellular carcinoma (HCC). TACE is an invasive procedure associated with several potential complications of varying severity. A pulmonary embolism after TACE for HCC is a rare complication. We report a case of pulmonary Lipiodol embolism after a third TACE resulting in death. (Korean J Med 2011;81:236-240)
서 론
간세포암종은 만성 B형 간염으로 인한 간경변증 환자가 많은 우리나라에서 비교적 흔하다[1]. 간세포암종은 진단 당시 간기능 부전, 간문맥 침범 혹은 다발성과 같이 진행된 상태로 발견되어 절제 불가능한 경우가 많으며[2], 이와 같이 진행된 간세포암종에서 경동맥화학색전술이 고식적 치료로 가장 흔하게 사용되고 있다[3-7]. 경동맥화학색전술 시술의 합병증으로는 통증, 고열, 오심, 구토 등과 같은 색전술 후 증후군(postembolization syndrome)이 흔하고, 간농양, 패혈증, 폐렴, 간부전, 상부 위장관 출혈, 담즙종과 같은 비교적 심각한 합병증도 발생할 수 있다[7,8]. 암종이 간문맥이나 간정맥을 침범하는 경우 경동맥화학색전술 후 동-정맥 단락을 통한 혈전이 발생할 수 있는데, 이로 인한 치명적인 폐색전증이 보고된 사례는 매우 드물다[9,10]. 저자 등은 진행된 간암종 환자에서 경동맥화학색전술 후 폐색전증이 발생하였고 이후 사망에 이른 치명적인 합병증을 경험하여 보고하고자 한다.
증 례
환 자: 남자, 60세
주 소: 경동맥화학색전술 위해 입원했다.
현병력: 1년 전 간기능 이상 소견과 복부팽만, 전신부종 증상있어 입원하여 간암 진단되었으나 진단당시 절제불가능한 상태로 경동맥화학색전술 2차례 받았던 환자로 외래에서 추적검사에서 재발 소견 관찰되어 3번째 경동맥화학색전술 위해 입원했다.
과거력: 고혈압, 당뇨, 만성 B형 간염, 1년 전 간암 진단, 간경변증, 뇌경색
가족력: 특이 사항 없었다.
사회력: 특이 사항 없었다.
진찰 소견: 환자의 내원 당시 혈압은 130/90 mmHg, 맥박 88회/분, 호흡수 17회/분이었고 체온은 36℃였다. 외견에서 환자의 의식상태는 명료하였으나 만성병색을 보였고, 흉부청진에서 폐호흡음은 정상이었고 수포음은 들리지 않았으며 복부 신체검사에서 간은 촉지되지 않았고 비장의 비대 소견을 보였다.
검사 소견: 내원 당시 시행한 말초 혈액검사에서 혈색소 11.7 g/dL, 헤마토크리트 34.1%, 백혈구 수 4,500/mm3, 혈소판 수 100,000/mm3이었으며 α-태아 단백 수치는 950 ng/mL이었다. AST/ALT 65/44 IU/L, Alkaline phosphatase 267 IU/L로 다소 증가되어 있었고, 알부민 2.6 g/dL, 총 빌리루빈 1.1 mg/dL, 프로트롬빈 시간 15.7 sec (INR 1.27), 총 콜레스테롤 수치는 159 mg/dL이었다.
심전도 및 방사선학적 소견: 심전도에서는 경미한 빈맥 외에 특이소견 없었으며 단순 흉부 X-선 검사에서 결핵반흔과 이전 경동맥화학색전술 소견 외 특이 소견 없었다.
복부단층촬영 소견: 간암 재발과 간문맥 혈전증 소견 보였다. 간우엽 후방부에 4 cm 크기의 종괴가 관찰되었고, 좌측 측방엽에 1.5 cm 크기의 종괴가 관찰되었다(Fig. 1).
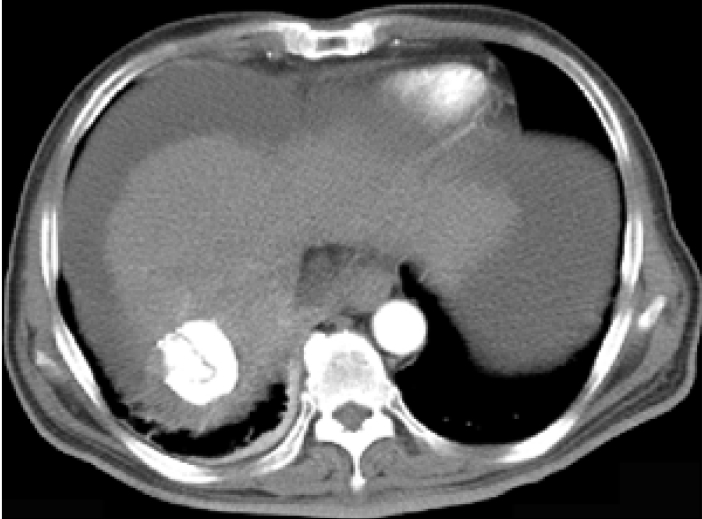
Computed tomography shows an ill-defined arterial enhancing segmental hypoattenuating lesion lateral to the hepatic nodule in the right lobe taking up Lipiodol.
치료 및 경과: 신체 검사 및 혈액 검사에서 환자의 간기능은 Child-Pugh class A이었고 간암종에 대한 수술은 불가능하다고 판단되었으며, 혈관 조영검사에서는 뚜렷한 간내 동-정맥 단락은 관찰되지 않았다. 우측 하부 가로막 동맥 혈관 조영에서 간우엽에 리피오돌로 착색된 부위 외측으로 조영증강되는 종괴가 관찰되어 아드리아마이신 15 mL과 리피오돌 3 mL을 혼합하여 서서히 주입하였다(Fig. 2). 시술 후 환자는 우상복부 통증을 호소하였으나 특별한 이상 징후는 나타내지 않았다. 시술 다음날 환자는 급작스런 호흡부전을 호소하였고, 말초 산소 포화도는 90% 이하로 감소하였다. D-dimer는 28.7 ug/mL로 증가하였다. 단순 가슴사진에서 우측폐에 망상의 흔적이 증가하였고(Fig. 3), 특히 흉부전산화단층촬영에서 우하엽에 다발성의 iodized-oil의 흔적이 관찰되었다(Fig. 4). 산소 투여 및 항생제 투여와 같은 보존적 치료에도 불구하고 호흡부전은 악화되었으며, 1주 후 환자는 사망하였다.
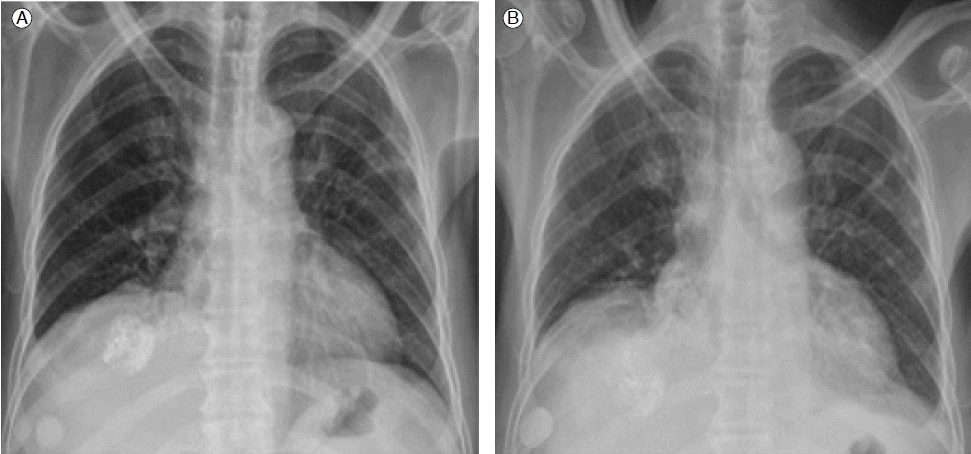
The chest X-ray taken the day after the angiography shows increased high intensity signals in the right lobe (B) compared with the chest X-ray at admission (A).
고 찰
경동맥화학색전술은 침습적인 시술로서 약 1% 이내에서 다양한 합병증을 일으킨다. 합병증으로는 통증, 고열, 오심, 구토 등과 같은 색전술 후 증후군(postembolization syndrome)이 비교적 흔하고, 급성 간부전, 간내 담즙종 형성, 가성 동맥류, 이소성 경색 등이 발생할 수 있다[8]. 폐색전증은 드문 합병증으로 Xia 등은 1,348명의 환자에서 시행된 2,012건의 경동맥화학색전술 예에서 폐색전은 단 한예에서 발생하였다고 보고하였다[9]. 본 증례의 경우 환자는 경동맥화학색전술 다음 날 갑작스런 호흡곤란을 호소하였고, 산소저하와 빈맥의 소견을 보였고, D-dimer가 28.7 ug/mL로 증가하였고, 단순 흉부 촬영에서 시술 후 생긴 우측의 고강도 신호와 흉부단층촬영사진을 종합하여 임상적으로 폐색전증으로 확인되었다.
경동맥화학색전술 시술 후 폐색전이 일어나는 기전에 대해서는 확실하게 알려지지 않았지만, 지금까지 보고된 증례를 검토한 결과, 우-좌 단락의 존재, 암종의 크기, 리피오돌의 과다 사용, 암종이 흉막이나 횡경막에 침범한 경우와 관련이 있을 것으로 언급되고 있다[11]. 또한 inferior phrenic artery를 통해 색전을 유발 할 경우 간 외 색전 발생이 증가하는 것으로 보고되었다[12-14]. 경동맥화학색전술 후 폐색전이 발생하면, 오일 색전이 폐 동-정맥 단락을 통해 전신 순환계로 퍼져 심각한 합병증을 일으킬 수 있다[8,12,13]. 본 증례의 경우 우측 하부 가로막 동맥을 통해 소량의 리피오돌이 주입되었음에도 불구하고 폐색전이 발생하였다. 경동맥화학색전술 후 발생한 간 외 색전의 증례에서 복부 혹은 흉부 단층 촬영, 심초음파와 같은 통상적인 시술 전 검사에서 우좌 단락은 대개 관찰되지 않는 것으로 보고되었다[11]. 본 증례에서 하부 가로막 동맥 단락을 뒷받침할 만한 증거는 발견되지 않았으나, 이전에 경동맥화학색전술 후 보고된 12건의 뇌색전 및 폐색전 증례 중 6건이 하부 가로막 동맥을 통한 리피오돌 주입이었음을 고려할 때[15], 본 증례의 폐색전이 하부 가로막 동맥을 통한 리피오돌 주입과 가장 큰 연관성을 내포하고 있다고 생각한다.
본 증례에서 환자는 경동맥화학색전술 후 마른 기침과 호흡곤란이 발생했으며, 상체 거상, 산소 투여, 이뇨제 투여와 항생제 투여와 같은 즉각적인 보존적 치료가 이루어졌지만 호흡부전이 점차 악화되어 경동맥화학색전술 시술 7일째 사망하였다.
진행된 간암종을 가진 환자에서 경동맥화학색전술 후 폐색전이나 폐경색은 비교적 드물지만 발생 가능하다는 점에 주의하고 시술 전 폐색전의 위험 요소로는 종괴의 크기가 클 때, 간정맥을 침범하였을 때, 간경변이 심한 경우, 선천성 심질환이나 만성 폐질환을 가졌을 때로 시술 전 이런 위험 요소에 대해 면밀히 확인해야 할 것이다. 또한 하부 가로막 동맥을 통해 암종에 색전을 유도할 때에는 폐색전의 가능성을 염두에 두고 리피오돌 양을 가능한 줄이고 경동맥화학색전술 시술 후 호흡곤란과 같은 증상에 주의를 기울여야 할 것으로 생각한다.
폐색전이 확인되면, 즉각적으로 기도확보, 산소 투여와 같은 적절한 보존적 치료가 이루어져야 하고 생체 징후, 혈중 산소 포화도, 의식 상태, 혈액 검사 등을 집중적으로 확인하고 환자가 호흡부전으로 진행할 가능성이 있으면 즉각적으로 중환자실 치료와 기계호흡이 이루어지고 스테로이드, 기관확장제와 예방적 항생제를 투여해야 한다.
요약하자면 비록 경동맥화학색전술 후 폐색전이 드문 합병증이나 경동맥화학색전술을 시행하기에 앞서 환자들이 고위험군인지 파악해야 하며, 아직 경동맥화학색전술 시술 시 적정량의 리피오돌에 대한 구체적인 지침은 없으나 몇몇 연구에서는 중요 기관의 색전 예방을 위해 0.1-0.3 mL/kg 정도를 적정량으로 제시하고 있는 바[16,17], 고위험군의 환자에서는 iodized oil의 양을 최소로 줄이고 시술 후 세심한 관찰과 색전의 징후가 관찰될 경우 신속한 치료가 이루어져야 할 것이다.

