누출성 흉수 대 삼출성 흉수
Transudates vs. Exudates Pleural Effusion
Article information
Trans Abstract
Pleural effusions are common and of highly diverse etiologies. These effusions can form based on disease of the pleural membranes themselves or of thoracic or abdominal organs. In initial approach, these effusions can be separated as exudates or transudates with Light's criteria. Exudative pleural effusions meet at least one of the following criteria, whereas transudative effusions meet none: pleural fluid protein-to-serum protein ratio of more than 0.5, pleural fluid lactate dehydrogenase (LDH)-to-serum LDH ratio of more than 0.6, and pleural fluid LDH more than two thirds of the upper normal limit for serum. If a patient appears to have clinically a transudative effusion, additional tests can be assessed to verify its transudative etiology. Congestive heart failure and cirrhosis are responsible for almost all transudative pleural effusions. However, it has been determined that the patient has an exudative pleural effusion, one should attempt to determine which of the diseases, remembering that pneumonia, malignancy, and tuberculosis account for the great majority of all exudative pleural effusions. In all patients with undiagnosed exudative pleural effusions, the appearance of the fluid should be noted, and the pleural fluid protein and LDH levels, glucose level, differential cell count, and microbiologic and cytologic studies should be obtained. In selected patients, other tests on the pleural fluid, such as pH, amylase level, antinuclear antibody level, rheumatoid factor level, adenosine deaminase, lipid analysis, and so forth, may be of value. (Korean J Med 2011;81:135-142)
서 론
흉막은 호흡할 때 움직임이 원활하도록 역할을 하는 폐를 싸고 있는 두 층의 막으로 이 공간에 비 정상적으로 액체가 차는 것을 흉수라고 한다. 흉수는 흔하게 접하는 임상 상황으로 여러 질병에서 발생할 수 있다. 누출성 흉수(transudate)는 심부전, 간경화 같은 질환의 동반이 많고, 삼출성 흉수(exudates)는 결핵성 늑막염, 악성 흉수, 부폐렴 흉수 등의 질환이 대표적이다. 흉수의 접근 방법에서 가장 중요한 것이 먼저 누출성과 삼출성으로 감별하는 것으로 그 방법을 알아보고 흉수 환자의 체계적인 접근법에 대하여 이야기하고자 한다.
본 론
해부적 구조 및 병태 생리
흉막은 폐를 감싸고 있는 막으로 두 층으로 이루어져 있고 장측흉막(visceral pleura)은 폐실질을 덮고 있고 벽측흉막(parietal pleura)은 흉벽과 횡경막을 덮고 있다. 두 흉막 사이 공간을 흉막공간(pleural surface)라 하며, 평상시 소량의 흉막액(pleural fluid)이 있으나 흉수(pleural effusion)는 비정상적으로 체액이 축적되는 것이다. 장측흉막과 벽측흉막의 표면적은 비슷하고 한 폐의 표면적이 거의 1,000 cm2이고 정상 흉막 공간은 18-20 µm 두께가 된다[1]. 흉막의 기능은 흉벽에 폐의 운동이 쉽도록 하여준다. 장측흉막은 폐의 모양을 유지하여 과팽창을 줄이고 기흉을 방지한다. 흉막 공간은 폐포부종을 예방하는 안전구역 역할을 한다. 흉막유출은 전신 순환으로부터 정상 체액과 단백질이 들어와서 벽측흉막 임프관(lymphatics)을 따라 제거된다. 흉막 압력은 음압으로 이루어져 폐의 팽창을 가능하게 한다. 인간의 흉막공간에 존재하는 흉막 압력(pleural pressure)은 기능성 잔기용량(functional residual capacity)에서 가슴 중간 위치에 -5 cm H2O되고 총폐용량(total lung capacity)인 경우 -30 cm H2O가 된다[2]. 비록 흉막 공간압은 음압이지만 가스 축적은 되지 않는다. 흉수는 흔한 질환이며 많은 원인들이 있다. 흉막, 가슴내 장기, 복부 장기의 질병에 따라 흉수는 발생할 수 있다. 단백질, lactate acetate dehydrogenase (LDH) 농도, 세포 성분에 따라 exudate 혹은 transudate로 나누어 원인 감별 및 치료에 이용한다. 흉수는 들어오는 속도와 나가는 속도의 균형이 맞지 않을 때 나타난다. 들어오는 속도만 보면 한계치는 속도가 30배 증가할 때까지 여유가 있다. 만일 배출양이 감소하면 정상 유입속도에서는 한 달이 지나야 흉부 방사선 사진에서 발견이 가능하다[3]. 임상에서 대부분 흉수는 유입과 유출 속도 모두의 변화에 따라 발생한다. 흉수가 증가되는 경우는 모세혈관의 투과가 증가되거나 chyle, CSF, 소변 등 다른 액체의 유입으로 발생한다. 감소된 배출능력은 임파선 기능의 손상에 기인하며 예로 벽측흉막 폐쇄, 임프관이나 임파선의 이상, 임프액이 배출되는 곳의 전신 정맥압이 증가할 때 발생한다[3]. 임파배출이 감소되는 것은 결핵과 악성 흉수에서 증명이 되었다[4]. Transudates는 수압(hydrostatic pressures)의 증가나 삼투압(osmotic pressures)의 감소에 따라 발생한다. Transudates는 일반적으로 흉막이 병이 들었다는 것은 아니다. Exudates는 증가된 투과력을 가진 모세혈관 벽을 지나는 액체와 단백질로 형성된다. Transudates는 손상 받지 않은 모세혈관총(capillary beds)에서 생성된다. 가장 흔한 원인은 울혈성 심부전이다. 이때 정상적 모세혈관에서 폐간질을 지나 벽측흉막을 지나 흉막공간으로 누출이 일어난다[5]. 콩팥증후군이나 폐허탈과 연관된 흉수는 흉막 모세관의 변화된 압력으로 발생한다. 이런 transudates는 배출 속도의 감소와 연관이 있다[6]. 간경화나 복막투석으로 인한 유출은 복막에서 압력이 낮은 횡경막의 구멍(macroscopic holes)을 통하여 발생하고 소변이나 CSF 등은 정상 주행코스가 장애를 받을 경우 발견된다. Exudates는 손상받은 모세혈관에서 생기며 폐 흉막, 주위 장기에서 생긴다. 폐렴이나 폐혈전증에 동반되는 등 대부분의 exudates는 폐염증에 따라 고농도의 폐부종이 가슴막내로 누출된다. 다른 부류는 염증, 감염, 종양으로 인하여 발생한다. Exudates는 종격동(식도파열, chylothorax)에 삼출성 액체가 생기거나, 복부 여러 원인으로 발생한 발생한 복수가 음압 상태인 흉막 내로 움직일 때 발생할 수 있고 임파선의 폐쇄로도 흉막유출이 발생할 수 있다.
흉막 유출 환자의 접근 방법
흉수 환자는 호흡곤란이나 흉통, 어깨로 전이되는 방사통을 주로 호소한다. 진찰소견은 타진 때 탁음과 청진 때 호흡음이 감소된다. Posterior costophrenic angle이 소실되었거나 황경막의 후반부가 보이지 않으면 의심한다. 더 확실하기 하기 위하여 초음파 검사를 실시한다. 간격이 10 mm 이상이면 흉수천자를 실시하여 원인감별을 한다. 흉막 삼출 원인으로 많은 질환이 있다(Table 1). 미국에서 가장 흔한 흉막 삼출의 원인은 울혈성 심부전이고, 폐렴, 악성 종양, 폐색전, 바이러스 감염증, bypass 술 후 등의 순서이다[7]. CHF와 간경화가 대부분 누출액의 원인이다. 폐렴, 악성 질환, 폐색전, 위장 질환이 흉막 삼출액의 최소한 90%를 차지한다. 한국의 경우 전국적인 조사가 없어 정확히 알 수 없으나 미국과는 질병군이 다를 것으로 생각한다. 2007년 부산지역 4개 의과대학의 결과[8]를 보면 transudates가 전체 18%로 다른 보고에 비하여 낮았고 누출액의 가장 흔한 원인은 간경화 환자이고 심장질환 환자는 그 다음 순서이었다. 이는 한국에서 심장병이 서구보다 낮고 간경화는 더 많기 때문으로 판단된다. Exudates의 경우 감염이 44%, 악성 흉수가 42%로 대부분을 차지하였고, 빈도는 폐암의 악성 흉수가 가장 많고, 부폐렴 흉수, 결핵성 흉수의 순서로 발생하였다. 부폐렴 흉수는 가을에서 겨울, 결핵성 흉수는 봄에서 여름에 많았고 악성 흉수는 계절에 따른 차이가 없었다. 악성 흉수가 가장 많았던 이유는 암환자가 대부분 대학병원에 주로 관리가 되기 때문으로 판단된다.
Exudates와 Transudates 감별 방법
진단적 흉수천자(thoracentesis)는 흉부 옆누움사진(decubitus)에서 10 mm 이상이 되거나 고여 있는 흉막 유출이 있는 경우 반드시 고려한다. 만일 확실하게 CHF가 의심이 되면 흉수천자는 심부전치료가 될 때까지 연기할 수 있다. 그러나 환자가 열이 나거나 흉막통증을 느끼거나 양쪽 흉수 양이 다른 경우 기다리지 말고 천자를 실시한다. 흉수천자는 경험있는 시술자가 시행하면 안전한 검사방법이다. 가는 바늘을 사용하기 때문에 응고장애가 있거나 혈소판 감소나 양압의 기계호흡을 실시하는 경우에도 가능하다. 진단적 흉수천자의 첫째 의문은 누출액이냐 삼출액이냐 하는 것이다. 혈청과 흉수의 단백질 농도가 3.1 gm/dL 이상인 경우 환자는 대부분 삼출액일 가능성이 높다[9]. 누출액과 삼출액은 한 가지 기준만을 분류할 때 10% 정도에서 잘못 분류될 수 있다. Exudates와 Transudates를 감별하는 가장 기준이 되는 것은 Light's criteria로 흉수와 혈청의 protein과 LDH 농도로 감별을 한다(Fig. 1). 이 기준을 사용하면 99%에서 정확하게 분류할 수 있다[10]. 삼출성 흉수는 Light's criteria (흉수 protein 대 혈청 protein 비가 0.5 이상, 흉수 LDH 대 혈청 LDH 비가 0.6 이상, 흉수 LDH가 혈청 정상치의 2/3 이상)의 최소한 한 개가 기준에 맞아야 하며, 누출성 흉수는 기준에 하나도 맞지 않는 경우이다[10]. 다른 방법은 흉수 cholesterol을 이용하여 기준이 60 mg/dL [11]이나, 45 mg/dL [12]을 경계로 분류를 하거나, 혈청과의 차이가 1.2 g/dL 이하인 경우[13], bilirubin이 혈청과 비가 0.6 이상인 경우[14], cholinesterase 비가 0.23 이상인 경우[15] 등의 기준을 적용하여 나누기도 한다. 그러나 Romeo 등[16]에 따르면 44명의 transudates와 253명의 exudates 환자 297명을 비교한 결과 cholesterol 기준보다 Light’s criteria가 98%의 exudates와 77% transudates를 정확히 분류하여 더 정확한 방법이라고 하였다. 또 Burgess 등[17]은 393명의 환자를 대상으로 한 연구에서 역시 Light’s criteria가 혈청과의 albumin 차이보다 더 우월함을 보고하였다. Light’s criteria의 문제점은 누츨액 환자를 삼출액 환자로 잘못 분류할 수 있다는 것이다. 환자가 삼출액 환자로 의심되나 삼출액의 기준을 만족하는 경우는 혈청-흉수 albumin gradient를 측정하는 것이 좋겠다. 그러나 이 기준만 사용하면 많은 삼출액을 누출액으로 오인할 수 있다. 누출액인 경우 원인 질환인 울혈성 심부전, 간경화, 혹은 신장질환 등을 치료한다. 드물게 악성 종양이 누출액과 연관이 있다. 만일 임상적으로 누출액으로 진단된 경우는 더 이상의 흉수의 진단적 검사가 필요 없다. 치료는 원인 질환을 치료하면 된다. 만일 흉수 N-terminal brain natriuretic peptide (NT-BNP)가 증가되면(> 1,300 pg/mL), 환자는 심장원인의 누출액일 가능성이 높다[18].
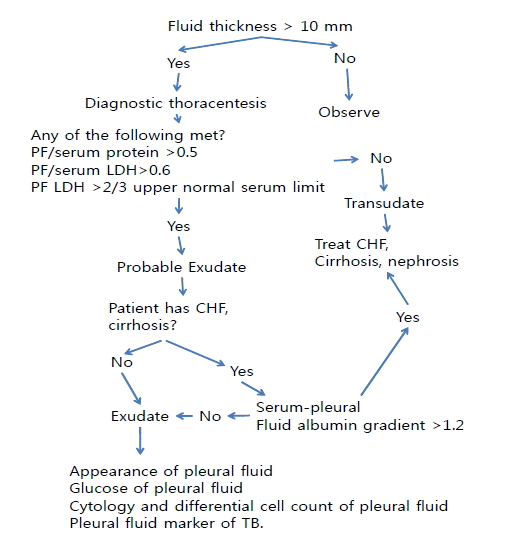
Algorithm for distinguishing transudates and exudates. PF, pleural effusion; LDH, lactate acetate dehydrogenase; CHF, congestive heart failure; TB, tuberculosis.
대부분의 연구가 하나의 기준치로 연구를 하여 이분법만으로 분류하면 오류 발생이 높다. 이런 경우 CHF에서 수치가 어중간한 경우 exudate로 잘못 판단할 수 있고 또 악성 흉수의 경우 1-10%에서 tansudates로 판단을 할 수 있다. 이런 경우 예민도는 높이는 반면 특이도는 낮아진다. 낮아진 예민도는 필요없는 검사를 유발할 수 있는 단점이 있다. 그래서 연속적인 숫자로 나타내는 연구가 있다. Heffner 등[19]은 Bayesian strategy를 적용하여 likelihood ratios를 산출하여 감별에 이용하였다. 값이 기하 급수적으로 올라가서 값이 높은 경우 삼출액일 가능성이 높고 값이 낮은 경우 가능성이 더 낮아진다. Logistic regression model에 따라 삼출액의 추정치 pretest probabilities (proPF)를 산출하여 가령 pleural fluid protein은 공식 = exp [1.68 (ProPF criterion result -3.263)]을 이용하여 수치를 산출한다. 이와 같이 형태로 각자 항목에 맞는 공식을 사용하여 pleural fluid-to-serum protein ratio, pleural fluid LDH, pleural fluid-to-serum LDH ratio, pleural fluid cholesterol, pleural fluid-to-serum cholesterol ratio, pleural fluid-to-serum albumin gradient 항목을 산출할 수 있다. 이것의 어려운 점은 pretest probabilities (proPF)의 추정치가 의사에 따라 변화가 많고, 더욱이 대부분의 의사는 수학이 응용된 것을 이해하지 못하여 사용하기 어렵다. 그럼에도 불구하고 이런 접근은 측정의 절대값을 고려한다는 데 중요성이 있다. 아주 높거나 아주 낮은 경우는 거의 삼출액이나 누출액임을 시사한다. 그래서 기준치 근처에 있는 경우는 불확실(indeterminate)로 간주할 수 있다.
삼출액을 취급할 때 가장 비용대비 효율적인 검사는 흉수의 protein과 LDH 수치이다. 한 연구[20]에서 320개의 흉수 검사에서 83개가 누출액에 부가적인 검사를 실시하여 비용과 가양성의 빈도만 높였다고 보고하였다.
삼출성 흉수(exudative pleural effusion)의 감별 방법
삼출액으로 결정이 되면 여러 질병들을 감별하기 위한 검사가 추가 되어야 한다. 먼저 삼출액의 모양을 알아야 한다. 당 수치, 세포 분획검사(differential cell count), 미생물 검사와 세포 검사들을 실시한다. 몇 환자에서 pH, amylase 수치, antinuclear antibody (ANA) 역가, rheumatoid factor 수치, adenosine deaminase (ADA), 지질 분석(lipid) 등이 가치가 있다. 이 검사들은 비용대비 효과는 낮지만 원인 감별에 반드시 필요하다.
흉막 삼출액의 모양
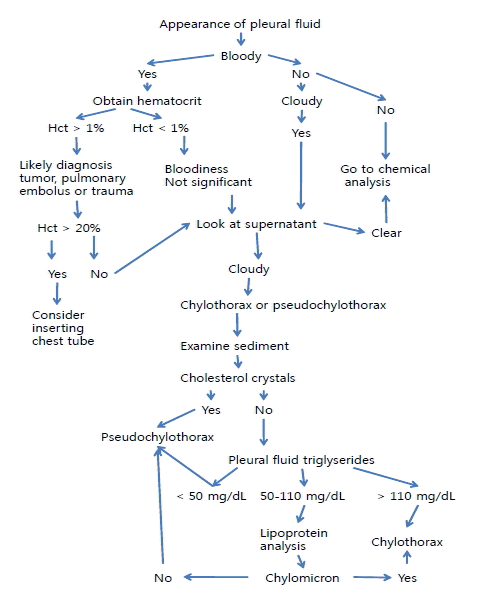
흉수의 보이는 모양을 기술하고 냄새를 맡는다. 만일 양이 적고 썩은 냄새가 나면 세균감염(혐기성 감염)이다. 만일 소변 같은 냄새가 나면 뇨흉(urinothorax)일 수 있다. 혈성이고 혈색소가 말초 혈액의 50% 이상이면 혈흉(hemothorax)이어서 흉관삽입을 고려한다. 혈색소가 1% 미만이면 임상적 의의는 없다. 1-50% 사이면 악성 종양, 폐색전, 외상 등을 고려한다[21]. 액이 혼탁하거나, 우유빛, 혹은 혈성이면 상층부(supernatant)를 검사한다. 처음부터 혼탁하였으나 원심분리에서 사라지면 혼탁의 원인은 세포나 그 찌꺼기(debris) 가능성이 높다. 원심분리 후에도 탁하면 chylothorax나 pseudochylothorax 가능성이 높다. 두 질병은 병력, cholesterol crystals 분석, 상층부 지질분석에 의해 감별한다. Chylothorax는 급성이고 흉막은 두꺼워지지 않고 cholesterol crystals이 없고 triglyceride 농도가 보통 110 mg/dL (1.24 mmol/L) 이상이다. Pseudochylothorax는 만성이고 흉막이 비후되어 있고 cholesterol crystals이 있고 triglyceride 농도는 증가되지 않는다(Fig. 2).
단백질
흉수 단백질은 대부분 삼출액에서 증가되어 있어 삼출성 흉수의 감별 질환에 유용하지 못하다. 그러나 단백질이 5.0 g/dL이상인 경우 결핵성 늑막염의 가능성이 증가한다. 만일 아주 낮은 경우(< 0.5 g/dL) 환자는 urinothorax, 복막 투석액의 이동액체, CSF의 가슴막내 누출 등으로 발생한다.
LDH
흉막 삼출액의 단백질과 LDH는 혈청에서 여과되어 발생하기 때문에 혈관 투과성의 지표가 되며 LDH는 세포내 효소로 세포 변동속도나 흉막내 염증의 정도를 반영한다. 흉수 LDH 농도는 대부분의 삼출액에서 증가되어 삼출액의 감별진단에는 유용성은 없다[10]. 같은 이유로 LDH isoenzymes도 감별진단에는 제한된 가치만 있다 그러나 천자시 마다 LDH 농도를 측정하는 것은 농도가 염증 정도를 반영하여 주기 때문이다. 만일 LDH의 농도가 증가추세를 보이면 흉막내 염증이 나빠지고 있어 진단에 더 적극적인 검사를 실시한다. 반대로 농도가 감소하면 질병이 좋아지는 경우이어서 지켜볼 수 있다[7].
당(glucose)
낮은 혈당은 두 가지 가능성이 있다: 비후되고 침범된 흉막은 당이 흉막으로 확산을 방해할 뿐만 아니라 흉막내의 당 사용을 증가시킨다. 당은 진단이 불확실한 삼출액에 반드시 검사한다. 이유는 흉막 당이 낮은 경우(< 60 mg/dL, 3.33 mmol/L) 진단 가능한 것은 부폐렴 흉수, 악성 흉수, 결핵성 늑막염, 류마티스 흉수, 혈흉, 폐흡충증, Churg-Strauss 증후군의 7개 정도로 좁힐 수 있다[7]. 만일 환자가 부폐렴 삼출액이고 흉막액 당 농도가 40 mg/dL (2.22 mmol/L) 이하인 경우 반드시 흉관 삽입을 고려한다. 류마티스 흉수 경우 많은 환자가 흉수 당 농도가 30 mg/dL (1.66 mmol/L) 이하이다. 반면 systemic lupus erythematosus (SLE) 환자의 흉수 당 농도는 80 mg/dL (4.44 mmol/L) 이상이다. 악성 흉수 환자에서 흉수의 당 농도가 낮은 경우 악성 세포의 양성율이 높다[20].
흉수 백혈구 수와 세포분획(differential count)
정상 흉수의 세포수는 1,700 cells/mm3까지 보고되었다[22]. 삼출액인 경우 세포 수만은 진단 가치로 한계가 있다. 흉수 백혈구 수를 주로 1,000/mm3을 기준으로 삼출액과 누출액으로 나눈다. 세포수가 10,000/mm3 이상은 농흉이나 부폐렴 흉수에서 흔하고 췌장염, 폐색전증, 교원성 질환, 악성종양, 결핵에도 보일 수 있다[21]. 세포 분획정보가 더 유용한 경우가 많다. 정상적인 경우 주로 macrophages (75%), lymphocytes(23%)가 주로 차지한다[22]. 정상 분포의 변화는 질병 변화의 근거를 제시한다. 세포는 다형핵 백혈구(polymorphonuclear leukocytes), 호산구(eosinophils), 소임파구(small lymphocytes), mesothelial cells, 기타 단핵세포(mononuclear cells)로 나눈다. 급성 질환인 경우 흉수에 주로 다형핵 백혈구가 나타난다. 만성 질환에 따른 경우는 단핵 세포(mononuclear cells)이 나타난다. 흉수 호산구 증다증(≥ 10% eosinophils)은 흔히 흉막에 공기나 혈액으로 인해 나타나다. 첫 천자에는 없다가 추가 천자 때 많은 호산구를 관찰할 수 있는데 이것은 당시 들어간 공기나 혈액 때문에 발생한다[23]. 외상성 혈흉인 경우 흉수 호산구 증다증은 2주 동안은 발생하지 않는다. 호산구 증다증의 이유는 IL-5가 CD4+ T cells에서 생성되기 때문이다. 말초 혈액의 호산구 증다증이 흉수의 호산구증다증을 만들 수 있다. 폐색전에 따른 흉수는 많은 호산구를 가지고 있다[24]. 기흉의 경우 호산구 증다증은 3일 이내에 나타나 6일에 최고조에 이른다. 공기와 혈액을 제외하면 그 다음 이유로 특발성 40%, 악성 종양 17%, 부폐렴흉수 13%, 결핵 6%, 폐색전 4%, transudates 8%, 기타 13%로 보고 하고 있다. 양성 석면증에도 종종 호산구가 증가하며 약제(nitrofurantoin 혹은 dantrolene)로 인하여도 발생한다[7]. 기생충의 경우는 호산구가 올라가 있고 낮은 당수치, 낮은 pH, 높은 LDH 수치를 보인다. Mesothelial cells은 결핵인 경우는 발견하기가 어렵다. 소임파구(small lymphocytes)가 50% 이상인 경우 악성이나 결핵을 시사한다[7]. 이런 경우 조직 검사로 확진을 해야 한다.
세포검사(cytology)
진단이 불확실한 모든 환자의 흉수는 세포진검사를 실시한다. 첫 번째 검사에서 나올 확률은 60% 정도이고[21], 3번에 걸쳐 실시하면 90%까지 양성이 나온다. 악성의 종류에 따라 검출률이 다르다. 가령 Hodgkin's disease는 25% 미만이고 대부분 선암은 양성으로 나온다. 양성률은 세포병리학자의 실력에 많이 의존된다.
pH와 PCO2
흉수 pH가 7.20 이하인 경우 열 가지 정도 질병 상태를 생각할 수 있다: 문제가 발생한 부폐렴흉수(complicated parapneumonic effusion), 식도 천공, 류마티스 흉막염, 결핵성 늑막염, 악성 질환, 혈흉, 전신 산성 상태(systemic acidosis), 폐흡충증, 루푸스 흉막염(lupus pleuritis), 뇨흉(urinothorax)이다. pH가 감소된 이유는 흉막 내 CO2가 축적되어 lactic acid가 생성되기 때문이다. 이 것은 부폐렴흉수 환자에서 흉관 삽입이 필요한지 결정할 때 유용하다[25]. pH가 감소하면 염증이 진행한 것이기 때문에 배액이 필요하다. 흉수 pH의 측정은 부폐렴흉수에 필요하다. 낮은 pH는 낮은 당 수치와 연관이 많다. 흉수 pH를 측정할 때 동맥혈 pH도 같이 측정한다. pH 반드시 동맥혈 가스 측정기로 측정하여야 한다.
Adenosine Deaminase (ADA)
ADA는 결핵성 삼출액의 감별에 중요한 검사법이다. 수치가 낮은 경우(< 40 U/L) 결핵성을 배제하는데 유용할 수 있다[26]. 흉수 IFN-γ는 거의 결핵성 삼출액일 때 증가된다[27]. 분자 생물학적 검사로 가슴막 누출액이나 조직검사에 Mycobaterial DNA sequences에 특이적인 PCR이용하거나, 배양에서 원인균을 찾기 위한 nucleic acid probes, 균주을 비교하기 위한 restriction fragment length polymorphism 방법, 약제 내성과 연관된 유전자를 찾는 감수성 연구들이 있다[28].
기타
흉수 amylase는 식도 천공, 췌장 질환, 악성 질환에서 2차적으로 발생한다. 그러나 빈도는 낮기 때문에 일반적 검사로 추천되지는 않는다. 교원성 질환과의 연관성을 찾아야 한다. 류마티스 관절염의 5% 환자와 SLE 50% 환자가 흉수가 발생하며, 흉수가 질병의 첫 증상일 수 있어 진단이 안된 환자에서 고려해야 한다. 흉수 ANA는 진단에 특이적이지 못 하다. 모든 환자가 흉수 ANA (> 1:40)이지만 다른 질병에도 11-27%가 양성이다. SLE가 아닌 환자에서 흉수 ANA 양성은 악성과 관련이 있다. 류마티스 흉수(rheumatoid pleural effusion)가 의심되면 흉수 rheumatoid factor를 측정한다. 류마티스 흉막염 환자는 흉수 rheumatoid factor 역가가 혈청에 비해 높거나 1:320 이상이다.
방사선학적 검사들
흉막액이 75 mL 이상이면 posterior costophrenic angle의 소실이 온다. 좀 더 정확한 방법은 lateral decubitus나 초음파 검사를 실시한다. 방이 생긴 흉막 삼출의 정확한 진단은 초음파나 computed tomography (CT)로 실시한다. 초음파의 장점은 빠르고 방사선 부작용이 없으며 천자 때 가이드를 할 수 있다. CT는 지금까지 검사 중 흉막을 볼 수 있는 가장 좋은 방법이다. 폐 내 농양과 농흉을 구분할 수 있는 가장 좋은 장비이다. CT angiography은 폐색전이 의심되는 경우 좋은 영상방법이다[29]. MRI는 초음파나 CT에 비하여 만족스럽지 못하여 널리 사용되지 않는다. Positron Emission Tomography/ Computed Tomography는 악성과 양성의 감별에 사용되며 주위 정상 조직과 악성의 감별에 사용한다.
침습적 방법
삼출액이 진단이 어려운 경우 여러 방법으로 흉막 조직검사를 실시한다. 진단이 불확실한 경우 침습적 방법을 사용할 때 고려할 요소가 있다. 첫째 증상이나 임상 경과가 심하지 않아 시간이 지남에 따라 좋아 지면 덜 적극적인 치료를 고려한다. 둘째 흉수 LDH 농도가 시간이 지남에 따라 증가하면 적극적인 접근을 실시한다. 셋째 환자의 태도로 환자가 원인에 신경이 예민하면 더 적극적인 치료를 한다. 방법은 침생검, pleuroscopy, video-assisted thoracoscopic surgery (VATS), 개흉생검이 있다. 여러 방법으로도 20% 정도가 진단이 안되며 이런 경우 많은 수가 후유증 없이 저절로 사라진다는 것을 기억할 필요가 있다[27]. 흉막 침생검(needle biopsy)은 악성 질환이나 결핵이 의심되는 경우 실시한다. 주로 사용하는 바늘은 Cope needle이나 Abrams needle이다. 이렇게 하여도 진단이 불확실한 경우 영상유도 흉막생검이나 흉강경(thoracoscopy)을 실시한다. 영상유도 흉막생검은 87%의 예민도가 있는 반면 blind pleural biopsy는 47% 정도 된다[30]. 기관지경검사는 폐 실질 내 병변이 있거나 객혈이 있는 경우 약 75%의 진단율을 보인다. 반대로 이런 것이 없는 경우는 10% 미만이다. CT에서 폐실질 내 병변이 보이거나 객혈이 있는 경우 실시를 한다. Pleuroscopy와 VATS는 진단되지 않은 흉수 환자들의 검사에 중요한 방법으로 높은 진단율과 흉막유착술을 같이 실시할 수 있는 장점이 있다. 중피종을 포함하는 악성 종양으로 80% 이상에서 진단된다[31]. 개흉생검은 대부분 흉강 절개술(thoracotomy)로 대치되었으나 흉강경으로 진단에 실패하거나 접근이 어려운 경우에 한다. Ryan 등[32]은 1962-1972년까지 11년간 51명의 환자가 흉강 절개술 후에도 진단이 불확실하여 추적관찰한 것을 보고하였다. 이 중 31명(61%)에서 1.5-15년 추적 경과에서 재발이나 원인을 발견하지 못하였다. 2명의 원인불명 사망이 있었고 18명(35.3%)에서 12일-6년 내에 원인이 규명되었다. 13명이 종양으로 6명 악성 임파종, 4명이 악성 중피종, 3명이 기타 종양으로 밝혀졌다. 각각 1명씩 교원성질환, yellow nail 증후군, 승모판 협착증 환자가 밝혀졌다. 이와 같이 흉강 절개술 후에도 진단이 안 되는 경우 1/3에서 질환이 나중에 규명되기 때문에 추적관찰이 필요하다.
결 론
누출성 흉수와 삼출성 흉수의 감별에 Light’s criteria가 가장 중요하며 누출성 병변은 기저 질환의 치료가 중요하고,삼출성 병변은 흉수의 모양, 세포수, 세포 분획, 미생물, 세포 검사, 당 농도, pH, 지질 분석, ADA 수치, 흉막 생검을 통하여 원인 질환의 감별과 치료에 이용한다.