조기위암의 내시경치료
Endoscopic Resection of Early Gastric Cancer
Article information
Trans Abstract
Endoscopic resection has become accepted as a standard treatment in selected patients with early gastric cancer (EGC) with negligible risk of lymph node metastasis. Endoscopic resection preserves the stomach and therefore improves quality of life compared with surgery. And it allows accurate histological staging of the tumor, which is critical in deciding whether additional treatment is necessary. The endoscopic submucosal dissection (ESD) method has been widely used with higher en bloc resection and complete resection rates than conventional endoscopic mucosal resection (EMR) with acceptable complication rates. Long-term clinical outcomes of these techniques are promising in terms of disease-free and overall survival. Recently, the expanded indication of endoscopic resection for early gastric cancer has been proposed because of technical advances of ESD. Long-term outcome data of the expanded indication are needed for the clinical application of the expanded criteria of ESD. (Korean J Med 2011;81:40-46)
서 론
내시경 검사에 대한 관심 증가와 내시경 기기의 발달로 인해 조기 위암의 발견이 증가하고 있다. 위암의 치료는 위절제술과 림프절 절제술이 표준 치료이다. 하지만 수술 후 합병증과 이로 인한 삶의 질 감소로 인해, 림프절 전이의 가능성이 없는 일부의 조기 위암에 대해 내시경 치료가 시도되어 왔으며, 조기위암의 림프절 전이에 대한 자료 축적, 내시경 기기 및 술기의 발달로 인해 최근 내시경을 이용한 치료가 늘고 있는 추세이다[1,2].
조기 위암에 대한 내시경 치료는 대부분의 경우 시술 시간과 입원 기간이 짧고, 시술 후 위의 기능이 보존될 수 있다는 장점이 있다. 이로 인해 내시경 점막절제술(endoscopic mucosal resection, EMR)은 여러 위장관 종양의 치료에 있어 중요한 수단으로 정착되었다. 또한 1990년대 후반부터 점막하 박리법(endoscopic submucosal dissection, ESD)이 소개되어, 기존의 방법으로 일괄 절제가 불가능하였던 큰 병변은 물론, 궤양 반흔이 있는 병변에서도 기술적으로 일괄절제가 가능하게 되었다.
내시경 치료의 방법
조기암에 대한 내시경 치료 방법은 크게 조직 파괴법과 조직 절제법으로 나뉜다. 레이저, 광역동 치료법, 고주파 등을 통해 병변을 괴사시키는 조직파괴법은 시술 후 병리조직학적 평가가 불가능하여 완전 치료여부를 파악하기 힘들고, 국소 재발이 높은 단점이 있다. 조직 절제법은 절제 조직을 회수하여 완전 절제여부를 확인하고, 이를 바탕으로 향후 치료방침을 결정할 수 있어, 근치적 치료법으로 인정받고 있다[1].
고전적인 내시경 점막 절제술
내시경적 조직 절제법은 크게 고전적인 점막 절제술과 점막하 박리술로 구분할 수 있으며, 고전적인 점막 절제술에는 박리생검술, Cap assisted EMR (EMR-C), Ligation assisted EMR (EMR-L), EMR after precutting (EMR-P) 등이 포함된다.
1984년 Tada 등에 의해 보고된 박리생검술(Strip biopsy)은 큰 조직 절편을 얻기 위한 조직검사의 한 수단으로 시작되었으나, 조기 위암의 내시경 치료에 적용되었고, 조기위암의 내시경절제술에 최초로 적용된 술식이라는 역사적 의미를 갖게 되었다. 박리 생검술로 인해 융기성 병변은 물론 함몰성 병변의 절제도 가능해졌고, 시술 과정이 비교적 간단하여 내시경 점막 절제술의 기본 수기로 널리 보급되어 1990년대 후반까지 가장 널리 사용된 내시경 점막 절제술이다[3]. 박리 생검술은 2 channel 내시경을 사용하며, 한쪽 겸자공에는 조직을 잡는 겸자를 삽입하고, 다른 한쪽 겸자공에는 올가미를 삽입한다. 병변부를 겸자로 잡고 견인한 상태에서 올가미를 조인 후 고주파 절개 전류를 통전시켜 절제한다.
1990년 초반 내시경 선단부에 투명 캡을 장착하여 투명 캡 내로 병변을 흡인하여 올가미로 조이면서 절제하는 EMR-C 방법이 고안되었다. 내시경 선단부에 장착하는 투명 캡은 모양과 직경에 따라 다양하게 선택할 수 있다[4].
EMR-L은 식도정맥류 결찰술을 목적으로 개발된 고무 밴드를 이용하여 병변을 흡인하여 용종형태로 묶은 다음 고무밴드가 결찰된 하부에 snare를 걸어서 통전, 절제하는 점막 절제술의 한 형태이다[5]. EMR-C와 EMR-L 방법은 융기가 없는 편평한 병변에서 직접적인 융기를 만들어 절제할 수 있다는 점에서 strip biopsy 법의 단점을 보완한다.
EMR-P는 충분한 양의 생리 식염수를 점막하에 주입한 후 전기절개도를 이용하여, 미리 표시한 절제면을 360도로 절개한 후 올가미로 조이면서 절제하는 방법이다. EMR-P 방법은 점막하층의 박리를 하지 않고 올가미로 조여 병변을 절제한다는 점에서 점막하 박리술과 구분되며, 고전적인 EMR의 한 방법으로 분류된다. 하지만 EMR-P 방법은 침형 절개도 등을 이용하여 병변 주변을 절개한다는 점에서 점막하 박리술과 유사한 점이 있으며, 병변 절개 후 점막하층을 일부 박리한 후 올가미를 사용하여 병변을 절제하는 혼합형 방법도 많이 사용되고 있다. 따라서 EMR-P 방법은 고전적인 EMR 방법에서 점막하 박리술로 이행되는 중간 정도의 위치에 해당된다. EMR-P 방법은 박리 생검술 등의 EMR 방법에 비해 큰 병변을 충분한 크기로 절제할 수 있으며, 일괄 절제율이 높다는 장점이 있다. 하지만 박리생검술, EMR-C, EMR-L 등의 방법에 비해 숙련에 이르는 시간이 필요하며, 천공이나 출혈의 합병증이 높다는 단점이 있다.
내시경 점막하 박리술
내시경 점막하 박리술(ESD) 방법은 크기가 큰 병변을 일괄 완전절제하기에 적합한 시술법이다. 시술 방법은 병변의 확인, 병변 주변 표시, 점막하 국소주입(submucosal injection), 점막 절개, 점막하층 박리, 조직 회수의 순서로 진행된다.
병변을 완전 절제하기 위해서는 병변의 경계를 명확히 확인하는 것이 가장 중요하다. 기존의 내시경으로 병변의 경계가 명확하지 않은 경우 색소내시경, 협대역 내시경 또는 확대내시경 등으로 관찰하면 병변의 경계를 확실히 결정하는 데 도움을 받을 수 있다. 병변의 경계를 확인한 후 병변의 경계로부터 최소 5 mm 이상 떨어진 정상 점막에 표시한다. 표시하는 방법으로는 올가미 선단을 이용한 응고법 또는 아르곤 플라즈마 응고법을 이용하여 표시하며, 병변의 주변부를 돌아가면서 적절한 간격으로 표시한다. 점막하 국소 주입이란 점막하층 내로 생리식염수 등의 국소 주입액을 주입하여 병변을 융기시키는 것을 말한다. 국소 주입은 점막하층에 위치하는 knife가 직접적으로 고유근층을 손상시키는 것을 예방하여 천공을 최소화할 목적으로 시행한다. 주로 사용되는 국소 주입액으로는 생리식염수, sodium hyaluronate액, 글리세린 혼합액 등이 있다. 국소 주입액은 융기지속시간, 조직상해성, 가격 등의 요인을 감안하여 선택하는 것이 좋다. 생리식염수는 등장액으로 저렴하고, 조직 상해성이 없으나 융기 유지성이 떨어지며, 지혈능력이 없기 때문에 에피네프린(1:10,000)과 인디고칼민 희석액을 혼합하여 사용한다. 글리세린 혼합액은 고장액이나, 생리적인 삼투압은 2배밖에 되지 않아 조직상해성이 적고, 비교적 양호한 융기 유지성을 보이며 저렴하다는 장점이 있다. 에피네프린을 혼합하여 사용한다. Sodium hyaluronate액은 점탄성이 매우 높아 융기 유지성이 다른 국소주입액에 비해 뛰어나 이상적인 국소주입액의 요건을 가지나 가격이 비싼 단점이 있다[6]. 국소 주입액 주입시에는 천공의 위험성을 줄이고, 혈관 압박효과와 수축효과를 얻기 위해 충분한 양을 주입하는 것이 중요하다.
점막 절개와 점막하층 박리에는 다양한 knife가 개발되어 사용되고 있다. 현재 국내에서 가장 많이 사용되는 knife는 insulation-tipped knife (IT-knife), hook knife, flex knife 등이다. 점막하 국소 주입으로 충분한 융기가 형성된 후 knife를 이용하여 병변 주위로 점막 절개를 시행한다. 점막 절개 시 점막근층을 포함하여 점막층을 완전히 절개하여야 추가적인 점막하 박리시술이 용이하다. 내시경 선단에 투명 캡을 장착하면 시야확보에 도움이 되며, 내시경의 의도되지 않은 움직임을 줄여 안전성 확보에 도움이 된다. 점막 절개를 마친 후에는 knife를 이용한 점막하층 박리를 시행한다. 점막하층 박리시에는 knife를 고유근층과 수평인 방향으로 유지하면서 절개하여야 고유근층의 손상을 방지하여 천공을 예방할 수 있다. 가능한 점막하층을 직시하면서 절개를 시행하는 것이 중요하며, 앞에서 언급한 투명 캡을 장착하면 점막하층이 잘 노출되어 맹점 없이 박리하는 데 도움이 될 수 있다. 점막하층을 직시하면서 절개하는 것은 천공 예방뿐만 아니라, 점막하층의 큰 혈관들을 절개하기 전에 응고함으로써 시술 중 출혈을 감소시키는 데 중요하다. 절제된 조직은 잘 펴서 핀으로 고정하며, 절제 전 표시한 부위가 모두 절제되었는지 확인한다. 10% 포르말린 용액에 넣어 병리과로 보낸다. 절제된 조직과 종양 부분을 병리 기록지에 그림을 그려 가장 변연부에 가깝다고 생각되는 부위에 대한 정보를 병리의사에게 전달한다.
고전적인 내시경 점막 절제술과 내시경 점막하 박리술의 비교
박리생검술을 포함한 고전적인 EMR 방법은 시술이 간편하고, 합병증이 드물며, 크기가 작은 병변에 대해서는 양호한 치료효과가 보고되고 있지만, 병변의 크기에 따라 일괄 절제율, 완전 절제율이 크게 떨어진다는 한계점이 있다.
고전적인 EMR 방법으로 치료하였을 때, 병변의 크기가 10 mm 이하 병변에서는 완전 절제율이 60% 내외로 비교적 높게 유지되는 반면, 20 mm 이상의 병변의 완전 절제율은 20-30%로 낮으며, 30 mm 이상의 병변에서는 완전 절제를 기대하기 어렵다[7,8].
반면 ESD 방법은 20-30 mm 크기의 병변에서 약 90%, 30 mm 이상의 병변에서 80% 이상의 완전 일괄 절제율을 보여, EMR 방법에 비해 우수한 치료 성적을 보인다[9].
일괄 절제가 중요한 이유는 분할 절제로 조직을 회수하게 되면 병변의 재구축이 어려워 완전 절제여부를 확인하기 힘들며, 분할 절제된 경우 국소 재발의 위험이 높기 때문이다. EMR 방법으로 치료한 50 병변과 ESD 방법으로 치료한 189 병변을 평균 30.3개월 추적관찰한 결과, EMR 군에서 ESD 군에 비해 유의하게 높은 국소재발(18% vs. 3.7%)률이 보고되었다[10].
ESD 방법을 사용하면 기존 EMR 방법으로는 치료가 불가능하던 병변도 치료 가능하다. 종양 내부에 궤양 반흔이 동반된 경우와 이전에 내시경 절제술 반흔에서 재발한 경우는 고전적인 EMR 방법으로 치료가 불가능하였으나, ESD 방법으로는 치료가 가능하다.
하지만 EMR 방법에 비해 ESD 방법은 시술에 숙련이 많이 필요하고, 시술 시간이 길며, 출혈이나 천공 등의 합병증이 높다는 단점이 있다. 특히 시술 시간이 길수록 시술과 연관된 합병증의 가능성이 높다. 병변의 위치가 근위부에 위치할수록, 병변의 크기가 클수록, 점막하층의 섬유화가 동반된 경우 시술 시간이 유의하게 증가한다[11]. 따라서 병변의 특성 및 시술자의 경험 등을 고려하여 시술 방법을 선택하여야 한다.
내시경 치료의 적응증
조기위암에 대한 내시경 절제술의 절대적인 적응증은 분화암으로 IIa형인 경우 2 cm 이하, IIc형인 경우 궤양이 없으면서 1 cm 이하인 경우가 해당된다. 병변의 크기가 2 cm 이하로 규정된 것은 당시 내시경 점막절제술로 일괄 절제가 가능했던 크기를 고려하여 2 cm 이하로 결정되었던 것이다. 앞에서 언급한 대로 ESD 방법이 소개되어 보급됨으로써 2 cm 이상의 병변은 물론, 궤양 반흔이 있는 병변에서도 기술적으로 일괄절제가 가능하게 되었다.
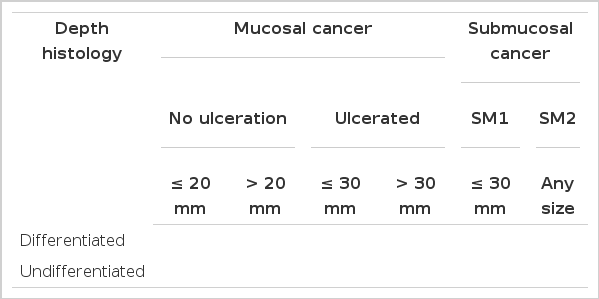
Gotoda 등[12]은 조기위암으로 수술 받은 5,265예를 림프절 전이여부에 대해 분석한 결과, 분화암이면서 크기가 3 cm 이하, 점막층에 국한, 림프-혈관계 침범이 없는 경우는 궤양 여부와 관계 없이 림프절 전이가 관찰되지 않았고, 분화암 이면서 점막층에 국한, 림프-혈관계 침범이 없고, 궤양이 없는 경우는 크기와 관계 없이 림프절 전이가 관찰되지 않았으며, 점막하층 침범이 SM1에 국한된 경우, 분화암이면서, 림프-혈관계 침범이 없고, 크기가 3 cm 이하인 경우 림프절 전이가 관찰되지 않았고, 미분화암인 경우도 점막층에 국한, 림프-혈관계 침범이 없고, 궤양이 없는 경우, 크기가 3 cm 이하인 경우 림프절 전이가 관찰되지 않아 내시경 절제술의 적응증을 확장할 수 있음을 시사하였다(Table 1).
1,721명의 점막암 환자의 수술결과를 분석한 국내의 연구결과에서도, 궤양소견이 없는 분화형 점막암의 경우 크기와 관계 없이 림프절 전이율이 0.23% (95% CI, 0-0.54%)로 고전적인 적응증 병변의 림프절 전이율 0.28% (95% 신뢰구간, 0-0.66%)와 유의한 차이가 없는 결과를 보고하였다[13]. 하지만 669명의 조기위암 환자 수술 후 병리결과를 분석한 연구에서는 확대적응증에 해당하는 점막암 129병변 중 3예(2.3%)에서 확대적응증에 해당하는 점막하암 52병변 중 2예(4%)에서 림프절 전이가 있었음을 보고하여, 확대적응증을 적용하였을 때 일부 환자에서는 내시경 절제술로 완치되지 않을 가능성을 시사하였다[14].
일반적으로 미분화암은 분화암에 비해 림프절 전이율이 높고, 병변의 경계가 불분명한 경우가 많아 내시경 절제술의 적응증에 해당되지 않는다[2]. 1,520명의 조기 위암 수술 환자를 대상으로 시행한 분석에서 signet ring cell cancer가 mucinous 또는 poorly differentiated cancer에 비해 림프절 전이율이 낮고, 예후가 좋다는 결과가 보고되었다. 이 연구에서 저자들은 크기가 2 cm 미만이면서, 점막에 국한된 signet ring cell cancer는 내시경 절제술의 대상에 포함될 수 있을 것으로 제안하였다[15]. 이외의 몇몇 연구들에서도 미분화암에 대한 내시경 절제술이 효과적임을 보고하였지만, 대부분 대상 환자의 수가 작고, 추적 기간이 짧은 제한점이 있다[16,17]. 미분화 암에 대한 내시경절제술 후 동시성 또는 이시성 재발이 증가한다는 보고와[18], 확대 적응증에 포함되는 미분화 암의 경우에도 림프절 전이의 위험이 있다는 보고들이 있어[19], 향후 추시가 필요하다.
결론적으로, 아직 확대된 적응증에 대한 내시경 절제술 후 장기성적은 드문 실정으로, 현 시점에서 적응증을 확대 적용하는 것에 대해서는 신중하게 접근해야 하며 이에 대한 추시가 필요한 상황이다.
내시경 치료 전 평가
초음파 내시경
내시경 시술 전 병변의 평가에 있어 가장 중요한 요소 중 하나는 병변의 침윤 깊이이다. 이는 조기 위암의 림프절 전이를 예측할 수 있는 요소 중 병변의 침윤 깊이가 중요하기 때문이다. 병변의 침윤 깊이를 평가하기 위한 중요한 검사 중 하나는 내시경 초음파검사(endoscopic ultrasonography, EUS)이다. 내시경 초음파는 주사방식에 따라 방사형 내시경 초음파(radial echoendoscope, radial EUS)와 선형 내시경 초음파 (linear array echoendoscope, linear EUS)로 분류된다. Radial EUS는 CT와 유사한 영상을 얻을 수 있어 해부학적으로 이해하기 쉬우며, 검사 습득이 비교적 쉬운 장점이 있어 병변의 진단을 위해 일반적으로 사용되나 중재적 시술은 불가능한 단점이 있다. 이에 반해 linear EUS는 해부학적 구조를 이해하고 관찰하기 어려운 단점이 있으나, 병변에 대한 세침흡인검사 등 병변에 대한 조작이 가능하다는 장점이 있다.
이외에 내시경의 겸자공을 통해 삽입할 수 있는 세경 초음파 탐촉자(miniprobe)가 있는데, miniprobe는 병변이 위 분문부와 같이 내시경 초음파가 접근하기 힘든 부위나 작은 병변의 진단에 용이하게 이용될 수 있다. Miniprobe는 주로 12-30 MHz의 고주파(대부분 20 MHz 이상)를 이용하여 점막에 가까이 위치한 병변은 해상력이 좋은 영상을 얻을 수 있으나 투과력이 떨어지므로 크기가 큰 종양의 경우는 후면의 관찰이 어렵다[20].
위암의 내시경초음파소견은 저에코의 불규칙한 종괴로 관찰된다. 초음파내시경의 위암의 침윤도판정의 정확성은 71-92%로 보고되며, 평균 83% 정도로 알려져 있다[20-23]. 병변의 형태, 크기, 분화도 등 병변의 특성에 따라 정확도의 차이를 보이며, 궤양을 동반한 함몰형 병변, 크기가 큰 병변, 분화도가 나쁜 병변인 경우 정확도가 감소하는 경향을 보인다. 특히 궤양을 동반한 함몰형 병변인 경우 주변 조직의 부종, 염증 및 섬유화 등으로 인해 병변이 과대평가되어 한 연구에서는 함몰형 병변인 경우 정확도가 56%로 낮았다[21].
최근, 병변의 침윤깊이 평가에 있어 내시경 검사의 전반적인 정확도가 78%로 높고, 점막층 또는 점막하층 침윤의 구별에도 정확도가 높아, 내시경 초음파 검사에 비해 정확도가 낮지 않음이 보고되었다[24,25].
내시경 초음파가 병변의 침윤 정도를 확인하는 데 가장 정확한 검사이기는 하지만, 한계가 있으므로, 내시경 소견과 종합적으로 판단하여 평가가 필요하다. 미세 병변의 경우에는 정확한 위치파악이 힘든 경우가 많아 고주파 miniprobe 검사가 유용하다.
내시경 치료의 합병증
출혈은 내시경 절제술과 연관된 가장 흔한 합병증이다. 출혈의 정의는 연구자에 따라 차이가 있어 출혈의 빈도는 1-45%까지 다양하게 보고되고 있으나, 대규모 연구들에서는 평균적으로 약 10% 내외이다. 출혈은 일반적으로 시술 도중 발생하는 급성 출혈과 시술 후 발생하는 지연 출혈로 나뉜다. 지연 출혈의 발생 빈도는 3.3-13.9%로 보고되었다[26,27]. 대부분의 출혈은 시술 후 24시간 이내에 발생한다고 알려져 있다[28]. 시술 도중 발생하는 출혈은 대부분 내시경 지혈술로 지혈 가능하여 임상적으로 큰 문제가 되지 않으나, 시술 후 발생하는 출혈은 추가적인 시술이나 수혈이 필요한 경우가 많아 임상적으로 중요한 문제가 될 수 있다. 특히 퇴원 후 발생하는 지연 출혈의 경우 출혈 양이 많거나, 환자의 동반 질환이 있는 경우, 고령의 환자 등에서 심각한 상태를 초래할 수 있기 때문에 임상적으로 중요한 문제이다. 출혈을 예방하기 위해 출혈 경향이 있는 경우 사전에 교정하며, 시술 중 충분한 혈관의 응고처리가 중요하다. 출혈이 발생한 경우에는 전기응고술, 아르곤플라즈마 응고술, 헤모클립 등의 내시경 지혈술을 이용하여 지혈한다.
천공은 고전적인 EMR 방법에서는 드물게 발생하지만, ESD 방법의 경우 대부분의 보고에서는 약 4%의 발생을 보고하고 있다[29]. 천공은 병변 주위 절개, 점막하층 박리, 지혈과정 모두에서 발생할 수 있다. 병변의 위치가 체부, 위저부인 경우가 발생빈도가 높으며, 크기가 큰경우, 궤양반흔을 동반한 경우 천공의 위험이 높다[29]. 내시경절제술 도중 발생하는 위천공은 시술 전 금식상태로 인해 위내 음식물이 없이 깨끗하며, 시술 도중 천공이 바로 인지되어 바로 처치되는 경우가 대부분으로, 내시경을 이용한 클립봉합술 후 내과적인 치료로 대부분 회복 가능하다[30]. 내과적 치료를 하는 경우는 금식, 항생제 투여를 이용한 보존적 치료와 더불어 자세히 환자를 관찰하는 것이 필수적이다. 2-4일 후 백혈구 수와 CRP 수치가 감소하며, 복막 자극 증상이 사라지는데, 이때 식사를 시작할 수 있다. 천공의 크기가 커서 클립을 이용한 봉합에 실패하거나 보존적 치료에도 불구하고 복막염 증상이 진행하는 경우 수술적인 치료가 필요하다.
출혈과 천공 외에 내시경 절제술의 합병증으로는 유문협착, 흡인성 폐렴 등이 드물게 발생할 수 있다.
내시경 치료의 장기 성적
EMR 치료 후 장기 성적에 대한 결과는 여러 기관에서 보고되었으나, ESD 치료 후 장기성적에 대한 결과는 아직 충분하지 않은 실정이다.
일본의 12개 기관에서 시행된 1,832예를 분석한 결과, 이 중 10개 기관에서는 절대적인 적응증에 해당되는 분화암으로 IIa형인 경우 2 cm 이하, IIc 형인 경우 궤양이 없으면서 1 cm 이하인 경우에 시행하였고, 나머지 2개 기관에서는 융기형 병변의 경우 3 cm 이하, 함몰형 병변의 경우 2 cm 이하, 궤양형 병변의 경우 1 cm 이하인 경우에 내시경 점막절제술을 시행하였다. 다양한 EMR 방법을 사용하여, 1,353예(76%)에서 완전 절제가 가능하였고, 불완전 절제로 판명된 경우, 잔존 암에 대해 추가로 내시경 점막절제술을 시행하거나, 외과적 수술을 시행하였다. 완전 절제가 시행된 경우, 4개월에서 11년까지 추적관찰한 결과, 1.9%에서 재발하였으며, 이 중 한 명이 위암의 전이로 사망하여, 99%의 질병 특이 생존율을 보여주었다[31].
Ono 등[32]은 내시경 절제술로 치료한 479예의 조기위암에 대한 장기 추적 결과를 발표하였다. EMR의 적응증으로는 (1) 분화형 선암 (2) 육안형으로 I, IIa, IIc 병변인 경우 (3) 궤양이 없는 경우 (4) 직경이 30 mm 이하인 경우가 적응증에 포함되었다. 내시경 절제술 후 점막하 침윤이 확인된 74예를 제외한 405예를 추적관찰하였다. 내시경 점막 절제술의 방법은 대부분 strip biopsy 방법이 사용되었고, 1990년대 후반부터 insulated tip knife (IT knife)를 이용한 점막하 박리법을 사용하였다. 점막에 국한된 조기위암 405예 중, 278예(69%)에서 완전 절제되었고, 127예(31%)는 불완전 절제 또는 변연의 열응고 변성으로 인해 절제면을 확인할 수 없는 경우였다. 중앙 추적기간 45개월(3-125개월)간 추적관찰한 결과, 완전 절제된 경우 5명 (2%)에서 국소 재발하여 내시경 치료를 재시도한 후 재발 없이 관찰 중이며, 절제면을 확인할 수 없었던 환자 중 13%, 불완전 절제되었던 환자 중 37%가 국소 재발을 보여 추가로 외과적 수술을 시행 받았다. 모든 환자에서 치료와 연관된 사망 또는 위암으로 인한 사망은 없었다.
최근 EMR 후 장기 추적에 대한 국내 결과가 보고되었다. EMR 방법으로 치료한 215명의 조기위암 환자와 수술 치료를 받은 843명의 환자 중 propensity score matching 방법으로 matching된 551명 환자의 장기 추적결과를 비교 분석한 연구로, 추적기간의 중앙값은 EMR군이 81개월(interquartile range, IQR, 56-94), 수술군이 88개월(IQR, 63-117)이었다. EMR군에서의 5년, 10년 생존율은 93.6%, 81.9%, 수술군에서는 94.2%, 84.5%로 두 군간의 사망률과 재발률은 차이가 없었다. 수술군에 비해 EMR군에서 재원기간이 유의하게 짧았고, 시술 비용이 유의하게 낮았다[33].
ESD로 치료한 조기위암 환자의 장기성적이 보고되었다. 510개 병변을 가진 476명의 환자에서 481병변은 완전절제가 되었고, 29병변은 불완전절제가 되었다. 4명의 환자에서 국소 재발이 있었다. 완전 절제가 되었던 환자는 0.2%, 불완전절제가 되었던 환자는 10.3%에서 국소재발하여, 완전절제군에서 불완전 절제군보다 국소재발률이 낮았다. 3년 및 5년은 전체생존률은 98.4%, 97.1%였고, 3년, 5년 disease specific survival은 모두 100%이었다[34].
이와 같이 여러 연구에서 ESD가 EMR에 비해 완전 절제율이 높고, 재발률이 낮아 조기위암의 내시경 치료에 적절한 시술방법으로 확인되었다. 현재까지 발표된 ESD 치료 후 장기 성적은 수술적 치료에 못지 않은 결과를 보고하고 있으나, 앞으로 확대된 적응증에 대한 장기 성적이 필요한 상황이다.
결 론
내시경 절제술은 안전하고 효과적인 치료방법이며, 덜 침습적이고, 위의 기능을 보존할 수 있어 환자의 삶의 질이 우수하다는 장점이 있다. 내시경 절제술의 기술적 발전으로 인해 완전 절제 가능한 병변이 확대되고 있어, 조기 위암치료의 중요한 수단으로 역할을 담당하고 있으며, 향후 그 역할이 확대될 것으로 기대된다.