유방암 환자에서 방사선 조사 후 발생한 폐쇄성 세기관지 기질화 폐렴 1예
A Case of Bronchiolitis Obliterans Organizing Pneumonia after Radiation Therapy in Breast Cancer
Article information
Abstract
폐쇄성 세기관지 기질화 폐렴은 방사선 치료 후에 드물지만 발생할 수 있는 합병증이다. 종양으로 흉부 방사선 조사의 기왕력이 있는 환자에서 다발성 경결성 폐병변이 있는 경우, 특히 방사선에 노출되지 않은 부위라 하더라도 감염성 폐렴이나 방사선 폐렴, 종양의 재발 뿐만 아니라 본 증례와 같이 방사선 유도 BOOP의 가능성이 발생할 수 있음을 염두에 두고 접근하는 것이 필요하겠다.
Trans Abstract
Pulmonary toxicity can develop following radiation therapy during breast cancer treatment. Of the pulmonary toxicities that can develop, radiation-induced bronchiolitis obliterans organizing pneumonia (BOOP) is relatively rare. A 43-year-old woman who had previously undergone radiation therapy for right breast cancer presented with fever and cough for 4 days. Chest radiology findings demonstrated consolidations in the right middle and lower lobe. Initially, we assumed that her findings were consistent with pneumonia and started empirical antibiotics. However, even after 10 days of antibiotic treatment, the fever persisted, and the consolidations showed progression. A transbronchial lung biopsy of the right middle lobe via bronchoscopy revealed organizing pneumonia. We strongly suspected radiation-induced BOOP and began steroid treatment. The symptoms and consolidations rapidly disappeared. We tapered the steroids, and no relapse has occurred since then. Considering the clinical, radiological, and pathological findings, we diagnosed the patient with radiation-induced BOOP. To our knowledge, this is the first case of radiation-induced BOOP in Korea. (Korean J Med 2011;80:458-463)
서 론
폐쇄성 세기관지 기질화 폐렴(bronchiolitis obliterans organizing pneumonia, BOOP)은 임상적으로는 수주에서 수개월 동안의 기침, 발열 등의 감기 증상과 유사하고[1], 영상학적으로는 양측성 반점형 침윤(patchy infiltrates)이나 경화성 병변을 보이며[2], 조직학적으로는 폐포 내 공간과 소기도 내강이 기질성 육아 조직으로 채워지는 특징을 갖는 미만성 침윤성 폐질환이다[3,4]. 크게 원인이 없는 특발성 BOOP과 감염, 약물, 류마티스 질환, 독성물질 흡인 등의 원인에 의한 이차성 BOOP으로 나눌 수 있다[4]. 방사선 조사는 이차성 BOOP의 원인으로 알려져 있기는 하지만, 그 빈도가 높지 않아[5,6] 국내에서는 아직까지 방사선 조사와 관련되어 BOOP 발생한 보고가 없다.
저자들은 유방암으로 유방 보존 수술을 받고, 이후 흉부 방사선 조사를 받은 환자에서 방사선 치료 종료 3개월째 발생한 BOOP 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 김〇〇, 42세 여자
주 소: 4일간의 기침, 발열
현병력: 내원 4일 전부터 시작된 기침과 발열을 주소로 입원하였다.
과거력 및 사회력, 가족력: 환자는 6개월 전 오른쪽 유방관상피내암(ductal carcinoma in situ) 진단 받고, 유방 보존 수술 및 2개월간 총 33회 6,040 cGy의 방사선 접면 조사(tangential field radiation)를 받았던 기왕력 있으며 이후 타목시펜(tamoxifen) 복용 중이었다. 흡연력 및 가족력에서 특이 소견은 없었다.
진찰 소견: 내원 시 혈압 110/80 mmHg, 맥박 분당 97회, 호흡수 분당 20회, 체온 37.8℃이었다. 신장과 체중은 각각 161.2 cm, 51.9 kg이었다. 두경부 진찰 소견상 인후부 발적이나 편도 비대는 없었고, 두경부나 양측 액와부의 임파선 비대도 관찰되지 않았다. 흉부 청진상 수포음을 동반한 거친 호흡음이 오른쪽 폐 하부에서 들렸고, 심음은 정상이었다. 피부 발적, 말초 부종은 관찰되지 않았다.
검사실 소견: 내원 당시 말초 혈액 검사상 혈색소 11.7 g/dL, 백혈구 11,640/mm3, 호중구 분획 87.1%, 혈소판 267,000/mm3였으며, 혈청 생화학 검사상 특이소견 없었다. ESR 66 mm/h (정상범위 0~5), CRP 85.68 mg/L (정상범위 0~10)로 상승되어 있었고, 자가 면역 검사에서는 류마티스 인자 3.0 IU/mL (정상범위 0~15), C3 142.0 mg/dL (정상범위 90~180), C4 37.3 mg/dL (정상범위 10~40), 항 ds DNA 항체 2.9 IU/mL (정상범위 0~20)로 모두 정상 범위였고, 항핵항체 및 항호중구 세포질 항체는 음성이었다.
방사선학적 소견: 흉부 단순 방사선 촬영에서 우중엽 부위에 폐침윤이 관찰되었다(Fig. 1A). 흉부 전산화 단층 촬영에서는 우중엽 및 우하엽에 유리질 음영(ground-glass opacities)과 공기기관지 조영상(air-bronchogram)을 동반한 폐경화 소견을 보였다(Fig. 1B and Fig. 1C).
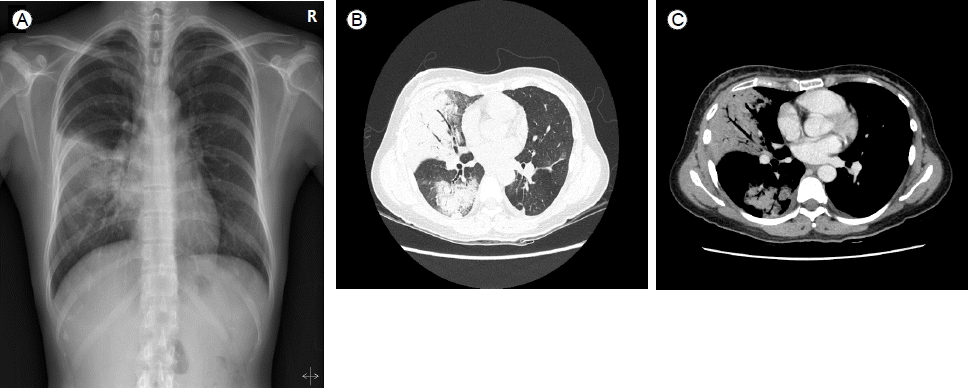
(A, B, C) The initial chest X-ray shows pneumonic infiltrations mainly in the right middle lung field, and chest computed-tomography shows a large consolidation in the right middle and lower lobe with an air bronchogram.
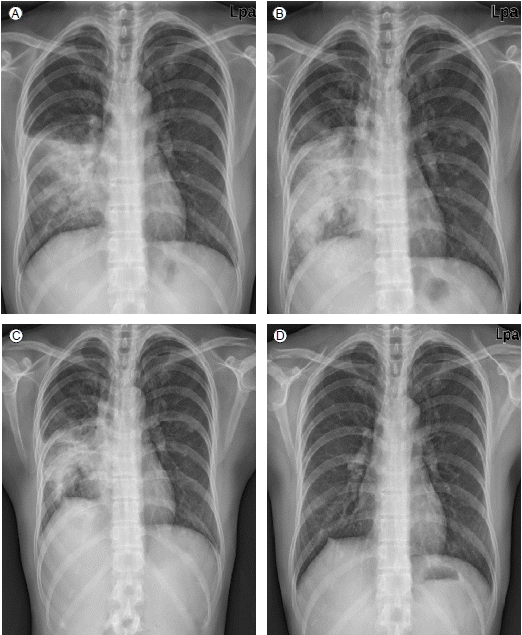
치료 및 경과: 환자는 감염성 폐렴 의심 하에 입원 11병일까지 경험적으로 항생제를 변경하며 사용하였으나 38℃ 이상의 고열이 지속되면서, 흉부 사진상의 우중엽 및 우하엽의 폐경화 소견은 점점 악화되었다. 내원 6병일에 시행한 기관지 내시경 검사에서 기관지내 특이 병변은 관찰되지 않았고 기관지 세척액으로 나간 세균, 항산균 도말 및 진균 배양 검사는 모두 음성 소견이었다. 우중엽에서 시행한 경기관지 폐생검에서 폐포내 공간과 말단 세기관지 내강이 증식된 섬유모세포전(fibrobastic plugs)으로 가득 차 있는 기질화 폐렴 (organizing pneumonia) 소견이 관찰되었다(Fig. 2). 입원 12병일째 방사선 조사 이후 발생한 BOOP의 가능성을 의심하여 프레드니솔론(prednisolone) 50 mg을 시작하였다. 이후 발열 및 검사실 소견을 포함한 임상양상은 급격히 호전되었고, 이와 더불어 흉부 방사선 병변도 소실되기 시작하였다(Fig. 3). 입원 16병일에 퇴원하였으며, 스테로이드 용량은 3주간 50 mg/day, 이후 한달 간격으로 각각 30 mg/day, 15 mg/day로 감량한 후 중단하였다. 퇴원 후 외래 추적 3개월 동안 특별한 재발 소견 없이 경과관찰 중이다.
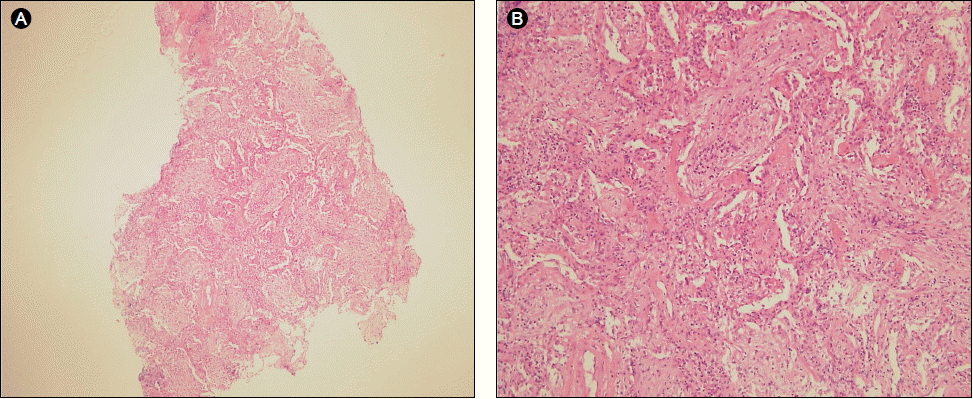
(A, B) Transbronchial lung biopsy revealed fibroblastic plugs and some lymphocytic infiltration in the alveolar space and interstitium (H&E, ×40, ×200).
고 찰
방사선에 의한 폐 독성은 주로 흉부에 발생한 종양 치료를 위해 방사선 조사를 받은 후 발생하며, 대표적인 질환으로 방사선 폐렴(radiation pneumonitis)과 방사선 폐섬유증(radiation fibrosis)이 있다[7]. 한편, 조기 유방암에서는 수술 후에 국소적인 재발을 방지할 목적으로 방사선 치료를 시행하는데, 위와 같은 방사선 폐 손상을 최소한으로 줄이면서 종양 병변에 효과적으로 도달하기 위해 접면 조사(tangential field-radiation therapy)가 도입되어 현재 널리 사용되고 있다[4]. 하지만 이와 같은 노력에도 불구하고 김 등[8]의 국내 조사에 따르면 유방암 수술 후 방사선 조사를 받은 261명의 환자 중 증상이 있는 방사선 폐렴(symptomatic radiation pneumonitis)의 빈도는 1.9% (5/261), 영상학적 폐손상(radiologic pulmonary toxicity)은 22.6% (59/261)가 발생한 것으로 나타났다.
한편, 1990년대부터 유방암 환자에서 방사선 접면 치료 후 직접 방사선을 조사받지 않은 부위에 BOOP의 조직학적 형태를 보이는 방사선 유도 BOOP (radiation-induced BOOP)에 대한 증례가 보고되고 있다[9-12]. 1998년 Crestani 등[13]은 이 질환에 대한 진단 기준을 제시하였는데, 1) 12개월 이내의 흉부 방사선 조사의 기왕력 2) 2주 이상의 호흡기 증상 3) 흉부 영상 소견상 방사선 조사 부위가 아닌 부위의 폐침윤 4) 다른 특별한 원인이 없음 등의 네 가지 항목을 만족하면서 조직학적으로 BOOP의 형태를 보이는 경우로 정의하였다. 연구에 따르면 이와 같은 방사선 유도 BOOP의 빈도는 1.8~2.4%로 높지 않은 것으로 알려져 있다[5,6]. 발생기전은 아직 정확하게 정립되지는 않았으나, 방사선 조사 후 활성화된 림프구에 의한 자가면역 반응이 중요한 역할을 할 것이라는 가설이 가장 보편적이다[14]. 실제로 유방암으로 방사선 조사 후 BOOP이 발생한 환자들의 기관지 폐포 세척액을 조사한 연구들에 따르면, 전체 세포 중 림프구가 가장 우세하게 상승되어 있음을 보여주었다[15,16].
본 증례에서 방사선 조사 이외의 이차성 BOOP을 유발할 수 있는 흔한 원인인 감염이나 류마티스 질환, 독성 가스 흡입 등에 대해서는 검사실 및 임상 소견으로 배제할 수 있었다. 약물과 관련하여 환자는 타목시펜을 지속적으로 복용하였으나, 현재까지 타목시펜이 단독으로 BOOP을 유발한 증례는 없으며 Takigawa 등[15]이 조사한 바에 따르면 유방암으로 방사선 치료를 받은 후 BOOP이 발생한 환자와 그렇지 않은 환자 간에 타목시펜의 사용 빈도는 차이가 없었다. 또한 환자는 입원 치료 및 이후에도 지속적으로 약물을 복용하였으나 경과가 호전된 것으로 미루어 타목시펜과의 연관성은 높지 않을 것으로 생각한다.
임상양상은 비특이적이고 다양하기 때문에 해당 과거력과 임상 소견만으로는 방사선 폐렴이나 감염성 폐렴 등 비교적 흔한 질환과 감별이 어려울 수 있다. 하지만 본 환자에서는 방사선 접면 조사를 받지 않은 부위에 병변이 발생하였고, 감염성 폐렴에 준해 항생제 치료를 일주일 이상 치료하였으나 반응이 없는 점 등은 방사선 유도 BOOP의 가능성을 간접적으로 시사하는 소견이라고 볼 수 있다. Nambu 등[14]은 이러한 방사선 유도 BOOP과 방사선 폐렴과의 임상적인 차이점으로, 첫째 방사선 폐렴이 조사 후 2~3개월 내에 발생하는 것에 반해 방사선 유도 BOOP은 수개월 이후에 발생하고, 둘째 방사선 폐렴은 주로 방사선 조사 부위를 침범하지만, 방사선 유도 BOOP은 조사 부위 이외의 반대쪽 폐까지 이동한다는 점을 제시하였다.
표준화된 치료 가이드라인은 없으나, 대부분의 경우 경구 스테로이드를 사용하면 급격한 호전을 보이는 것으로 알려져 있다[5,6,17]. 또한 증상이 심하지 않은 경우에 대증요법 및 경과관찰만으로도 효과가 있는 사례가 있어[6], 스테로이드 사용 여부는 신중하게 결정하는 것이 바람직하다. 치료 경과에 있어서도 Stover 등[17]의 연구에 따르면 방사선 유도 BOOP은 스테로이드 감량시 65%의 재발률을 보여, 다른 원인에 의한 이차성 BOOP의 재발률이 17%인 것에[18] 비해 매우 높은 특징을 보여 스테로이드를 감량하거나 중단할 경우 주의가 필요하겠다. 예후는 좋아서 아직까지는 본 질환에 의해 사망한 예는 보고된 바 없으며, 최근 Ogo 등[6]에 의해 방사선 유도 BOOP이 발생한 37명의 유방암 환자를 5년간 추적관찰한 조사에서도 본 질환으로 인해 사망한 환자는 없었다.
결론적으로, 본 증례는 방사선 치료의 기왕력이 있는 유방암 환자가 감기양 증상의 임상양상과 방사선에 직접 노출되지 않은 부위의 폐경결이 발생하여 방사선 폐렴 등 방사선과 연관 가능성을 배제하고 감염성 폐렴에 준해 치료하였으나 증상 및 병변이 점차 악화되고 경기관지 폐생검에서 소기도 내강에 섬유모세포 및 육아조직의 증식이 관찰되는 BOOP 소견을 보여 방사선 유도 BOOP의 가능성을 염두에 두고 스테로이드 치료 후 급격한 호전을 보인 경우이다.