비흡연가 폐암의 임상상
Clinical Features of Advanced Non-Small Cell Lung Cancer in Never-Smokers
Article information
Abstract
목적:
본 연구는 비흡연가에서의 진행성 폐암의 임상적 특성에 대해 알고 이를 토대로 적절한 치료 방향 설정하기 위함에 있다
방법:
본원에서 진단된 폐암환자들을 대상으로 의무기록을 통해 105명의 비흡연자를 선별하였으며 수술 가능한 병기의 환자를 제외하고 stage III, IV의 진행 병기 환자를 대상으로 성별, 나이, 신체활동도와 종양 표지자 수치, 생존 기간 등에 대해 조사하였으며 EGFR-TKI 치료반응성에 대해 알아보았다 .
결과:
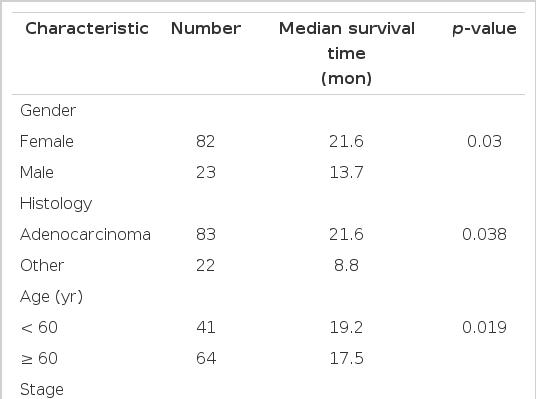
전체 비흡연가 중 여성이 많았고, 조직형상 선암이 많았으며 생존기간의 중앙값은 19.2개월이었으며 여성, 선암, 저연령층, NSE 값이 15이하인 환자들에서 생존기간이 길었다. 또한 EGFR-TKI로 치료받은 군에서 생존기간이 길었으며 관해 지속기간 역시 길게 나타났다.
결론:
비흡연가에서의 폐암 임상상에 대해 알아보았으며 향후 흡연가에서의 임상상과 비교를 통해 비흡연가에 적절한 치료에 대해 연구되어야 한다.
Trans Abstract
Background/Aims:
Smoking is major cause of lung cancer. However, the prevalence of lung cancer in never-smokers increasing recently. This study investigated the clinical characteristics of advanced lung cancer in never-smokers.
Methods:
We anlyzed the clinical characteristics including demographics, bronchoscopic features, stage, and serum tumor markers, of never smokers with lung cancer seen at Kosin University Hospital from January 2001 to December 2008.
Results:
There were 105 never smokers with lung cancer (mean age 61 years, 82 females), comprising 83 (79%) adenocarcinomas, 9 (8.6%) squamous carcinomas, and 13 (12.4%) undifferenciated carcinomas. The overall median survival time (MST) was 18.7 months. The MST was longer in females (21.6 vs. 13.7 months, p = 0.03), patients younger than 60 years (19.2 vs. 17.5 , p = 0.019), and those with adenocarcinoma (21.6 vs. 8.8 months, p = 0.038), and a neuron-specific enolase level of less than 15 ng/mL (22.4 vs. 13.4 months, p = 0.014).
Conclusions:
We analyzed the clinical characteristics of advanced lung cancer in never smokers. A more comprehensive study is need to compare never-smokers and smokers with lung cancer and to determine the appropriate treatment for non-smokers. (Korean J Med 2011;80:427-433)
서 론
전 세계적으로 폐암은 암으로 인한 사망 1위를 차지하는 질환으로 2007년 우리나라 통계청 자료에 따르면 폐암으로 인한 사망률은 29.1%로 높은 사망률을 보이고 있다[1]. 폐암의 발생과 흡연과의 관련성에 관한 역학적 조사는 1950년대 이후 지속적으로 보고되어 왔으며[2,3], 금연 교육, 담배 필터의 보급 등으로 남성, 흡연가에서 폐암 유병률은 다소 감소하는 추세이나 반면 여성, 비흡연가에서 폐암 유병률은 꾸준히 증가하는 추세이다. 최근 아시아 여러 국가에서 비흡연가에서의 폐암에 대한 연구들이 보고되고 있으며 이들은 흡연가와 비흡연가 사이에는 역학적, 조직학적 차이가 존재한다고 보고하였다[4,5]. 비흡연 관련 위험인자로 음식 연기(exposure to cooking fumes) [6], 호르몬(hormones) [7], 생리 주기(menstural cycle) [8] 그리고 바이러스 감염(viral infection) [9] 등이 고려된다. 또한 흡연가와 비흡연가에서 표피성장인자 수용체의 티록신 키나아제 억제제(epidermal growth factor receptor tyrosine kinase inhibitor, EGFRTKI)로 gefitinib (ZD1839, Iressa®, AstraZeneca, Pharmaceuticals, Wilmington, DE, USA)과 erlotinib (OS1774, Tarceva®, OSI Pharmaceuticals, Melville, NY, USA) 같은 특정 항암 약물에 반응을 달리하고 있어 두 군간 생물학적 차이가 있음이 제시되었다[10,11]. 이러한 연구들이 보고되고 있음에도 불구하고 비흡연가 폐암 발생의 병인과 임상적 특징에 대한 국내 보고들은 부족한 실정이다. 이에 본 연구는 단일 3차 의료 기관에서 원발성 폐암으로 진단된 환자들을 대상으로 의무기록의 후향적 분석을 통해 비흡연가에서 진행성 폐암의 임상적 특성에 대해 알아보고자 하였다.
대상 및 방법
대상 및 방법
2001년 1월부터 2008년 12월까지 고신대학교병원에서 진단된 원발성 폐암환자 3,626명 가운데 의무기록을 바탕으로 295명의 비흡연가를 조사하였고, 이들 중 진단 후 타 병원으로 전원간 자와, 개인사정으로 치료를 받지 않고 퇴원한 자를 제외한 105명을 대상으로 하였고, 이들의 성별, 나이, 신체 활동도(Eastern Cooperative Oncology Group performance status)에 대해 조사하였다. 기관지 내시경과 컴퓨터 단층촬영, 양전자 방출 단층촬영(PET-CT) 등의 방사선 검사를 통해 위치와 병기를 판정하고 진단 당시 혈액 검사를 통해 백혈구, 혈색소 및 혈소판의 전혈구 검사와 알부민, alkaline phosphatase (ALP), lactate dehydrogenase (LDH) 등을 측정하였고, 종양 표지자 검사로 carcinoembryonic antigen (CEA)와 neuron-specific enolase (NSE)를 검사하였다. 조직학적 검사결과에 따라 선암종(Adenocarcinoma), 편평상피암종(Squamous carcinoma), 대세포암종(Large cell carcinoma), 소세포암종(Small cell carcinoma), 기타 분류되지 않는 비소세포암종(Non-small cell carcinoma, unspecific)으로 분류하였다. 병기판정은 American Joint Committee for Cancer Staging (AJCC)에 기초하여 I에서 IV로 분류하였으며 수술한 환자군을 제외하고 stage III-IV의 진행성 폐암군을 대상으로 하였다. 항암치료를 시행한 군에서의 반응성 평가는 WHO (World Health Organization) 진단기준에 따라 완전관해(complete remission), 부분관해(partial remission), 불변(stable disease), 진행(progressive disease) 4단계로 판정하였다. 완전관해와 부분관해의 비율을 치료 반응률로 보았고 불변을 포함 후 질병 조절률을 판정하였다. 환자의 생존 기간은 조직학적 진단일로부터 사망일까지의 기간으로 하였고 관해 지속 기간은 항암치료를 시작한 일로부터 진행이 확인된 시점까지로 하였다.
통계 처리
통계 분석은 Window용 SPSS 통계처리 프로그램(SPSS Version 17.0, SPSS Inc., Chicago, IL, USA)을 이용하였다. 빈도 분석을 시행하여 각 항목의 빈도와 백분율을 구하였고 성별, 조직학적 차이, 병기에 따른 병소의 중앙 부위율 판정 및 항목별 치료 반응률 판정은 chi-square test를 활용하였다. 생존 기간은 Kaplan-Meier method를 이용하였고, p-value는 log-rank 검사법으로 확인하였다. 각 항목을 단변량으로 먼저 분석 후 유의한 값을 보이는 항목에 대해 Cox regression analysis하에 다변량 분석을 시행하여 독립변수에 의한 영향을 조사하였다. 통계적 유의성은 p < 0.05로 정했다.
결 과
연구 대상의 특성
본원에서 진행성 폐암으로 진단받은 3,626명의 환자에서 비흡연가는 295명으로 전체의 12.3%였으며 연구 대상이 되는 105명 중 남, 여 비율은 남자 23명(21.9%), 여자 82명(78.1%)이었으며 평균연령은 61세(30~86세)로 나타났다. 신체 활동도(ECOG) 0~1이 75명(71.5%), 2~3이 29명(27.7%), 4가 1명(0.8%)이었다. 조직학적으로 선암종 83명(79%), 편평상피암종 9명(8.6%), 그 밖의 조직형이 13명(12.4%)이었다. 진단 시 병기 IIIa-IIIb가 40명(38.1%), 병기 IV가 65명(61.9%)이었다. 항암 치료를 시행한 군에서 1차 항암 요법으로 가장 많이 사용한 약제는 gemcitabine-cisplatin으로 66예(66%)에서 사용되었고, 2차 항암 요법으로는 gefitinib 35예(56.5%)였다(Table 1).
치료 반응
1차 항암 요법을 3회 마친 후 반응성 평가 시 gemcitabinecisplatin 항암 치료 군에서 완전 관해 1예, 부분 관해 25예, 불변 18예로 치료 반응률은 39%였으며 질병 조절률은 66%였다. Paclitaxel 항암 치료군에서는 완전관해 0예, 부분 관해 5예, 불변 3예로 치료 반응률은 33%, 질병 조절률은 53%였고, docetaxel 항암 치료군에서는 완전 관해 1예, 부분 관해 6예, 불변 4예로 치료 반응률 44%, 질병 조절률은 68.7%였다(p = 0.845). 조직형에 따라 선암과 편평상피암에서 각각 42%, 22%의 치료 반응률을 보였고(p = 0.175), 60세 미만의 환자 군과 60세 이상의 환자 군에서 41%, 35%의 치료 반응률을 보였으며(p = 0.466), 여성에서 39%로 남성 31%보다 높은 치료 반응률을 보였다(p = 0.003).
생존 기간
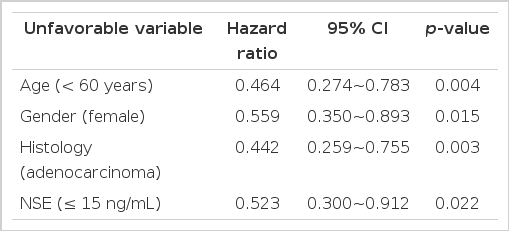
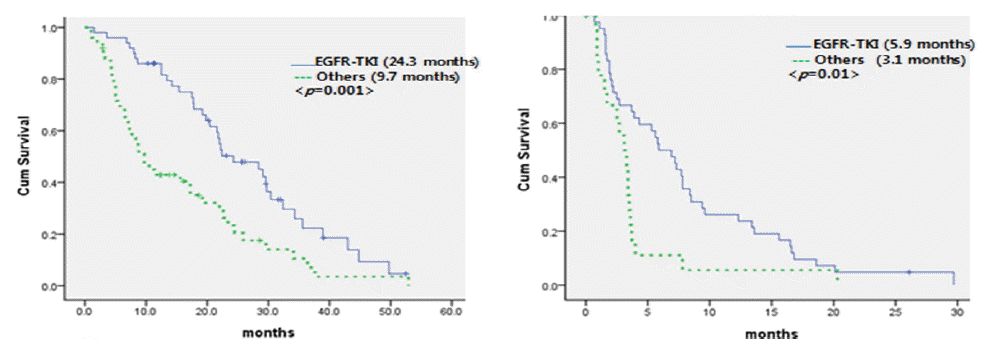
전체 비흡연가의 생존기간의 중앙값은 19.2개월이며, 여성에서는 21.6개월, 남성에서는 13.7개월로 여성에서 생존기간이 길었으며(p = 0.03), 선암과 기타 조직형군을 비교 시 각각 21.6개월, 8.8개월로 선암군에서 생존기간이 길었고(p = 0.038), 60세 미만의 저연령층과 60세 이상의 고연령층을 비교 시 생존기간의 중앙값은 19.2개월과 17.5개월로 저연령층에서 생존기간이 길었으며(p = 0.019), 본 연구에서 환자들 혈청 NSE의 평균값은 21.56이었으나 환자 분포를 고려 15 ng/mL 값을 기준으로 생존기간을 분석하였으며 NSE값이 15초과인 환자군에서 생존기간의 중앙값은 13.4개월, 15이하인 군에서 22.4개월로 NSE값이 낮은 군에서 생존기간이 길었다(p = 0.014, Table 2, Fig. 1). 단변량 분석 시 유의한 결과를 보이는 성별, 연령, 조직형, NSE 수치의 변수를 다변량 분석 시 여성, 60세미만, NSE 값이 15이하, 선암은 비흡연가 폐암의 생존에 영향을 미치는 독립인자임을 확인하였다(Table 3). 항암 약물치료를 시행한 환자를 대상으로 EGFR-TKI를 사용한 군과 한 번도 사용하지 않은 군을 대상으로 생존분석 시 EGFR-TKI를 사용한 군의 생존기간의 중앙값은 24.3개월이었고, 사용하지 않은 군에서의 중앙값은 9.7개월로 생존기간에 유의한 영향을 미친다고 볼 수 있었으며(p = 0.001), 1차 항암약제로 어떤 약제를 사용하였든 상관없이 2차 항암약제로 EGFR-TKI를 사용한 군과 나머지 약제군을 비교 시 각각 관해 지속기간의 중앙값은 5.9개월, 3.1개월로 EGFR-TKI군에서 관해 지속기간이 길게 나타났다(p = 0.01, Fig. 2).
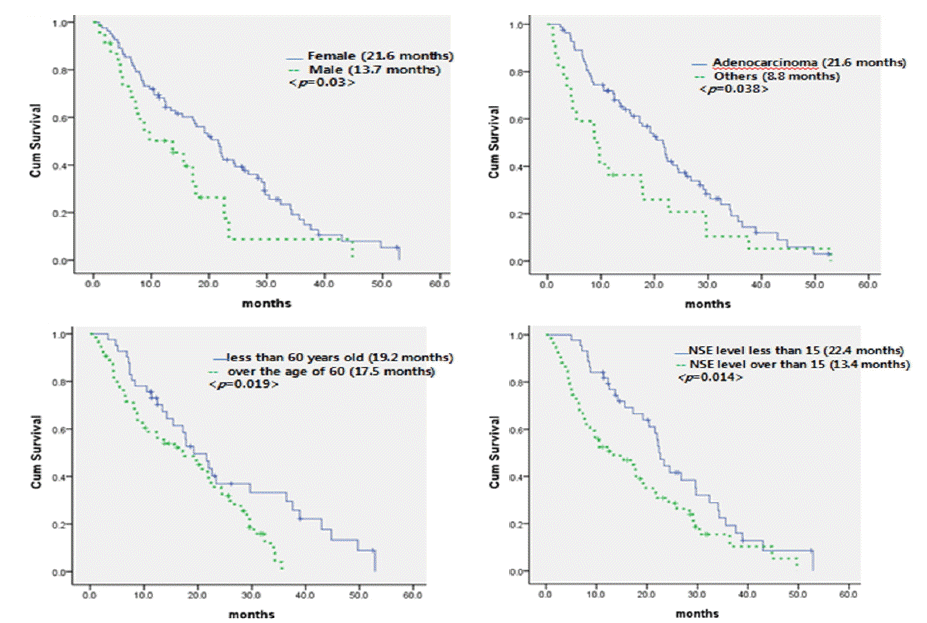
Kaplan-Meier analysis of overall survival in never-smokers. Patients who were female, younger, and had adenocarcinoma and low NSE levels had longer median survival times. NSE, neuron-specific enolase.
고 찰
폐암은 암으로 인한 사망 1위를 차지하고 있는 질환으로 여성, 비흡연가에서 폐암의 유병률은 꾸준히 증가하는 추세이다. 비흡연가에서의 폐암의 발병과 병인을 아는 것은 점점 증가하는 비흡연가 폐암에 대한 치료 방향을 결정하기 위해 의미 있는 일이며 이에 따라 최근 흡연가와 비흡연가에서 생물학적, 유전적 차이에 대한 여러 연구가 활발히 진행되고 있고, 임상적 특징에 대한 연구들이 보고되고 있다[5].
Toh 등[12]의 연구에서는 975명의 환자 중 비흡연가는 286명으로 전체의 32.4%였으며 이 중 여성의 비율은 68.5%로 여성의 비율이 높게 확인되었다. 본 연구에서는 비흡연가의 비율은 전체의 12.3%였으며 남, 여 비율은 남자 23명(21.9%), 여자 82명(78.1%)으로 역시 여성의 비율이 높았다.
흡연과 폐암 발생의 용량-반응의 관계는 명백히 알려진 바이며, 흡연량, 흡연 기간, 흡연을 시작한 나이에 따라 폐암의 위험이 증가하게 된다. 미국과 유럽의 연구에 따르면 흡연가에서 비흡연가에 비해 이른 나이에서 폐암이 진단되었는데, Missouri Cancer Registry 연구에서는 흡연가 남성의 폐암 진단 시 평균 나이는 64.9세였으며, 비흡연가 남성에서는 70.5세였고, 흡연가 여성에서는 63.5세, 비흡연가 여성에서 72.4세에 진단되었다[13]. 용량-반응 관계를 고려 시 비흡연가에서 간접흡연으로 노출되는 양은 소량이어서 흡연가에 비해 늦은 나이에 발병하는 미국과 유럽의 연구 결과들이 부합하나, 본 연구에서는 진단 시 평균 연령은 61세였으며 60대에서 46명으로 가장 높은 비율을 보여 앞선 연구들에 비해 비교적 이른 나이에 발병하였다. Shimizu 등[14]의 연구에서도 흡연가에서 평균 60세, 비흡연가에서 55세에 진단되었는데, 일본, 홍콩을 비롯한 아시아 국가들의 연구들에서는 비흡연가의 진단 시 연령은 흡연가에 비해 이른 나이였다[5,12]. 이는 흡연 이외의 다른 폐암 발병의 위험인자가 존재하고, 이에 대해 아시아인들의 감수성이 더 높기 때문으로 생각된다.
여러 연구들을 통해 비흡연가에서 흔한 조직형은 선암이라 입증되었는데[15-17], Toh 등[12]은 폐암환자의 조직형 중 69.9%에서 선암을 보고하였다. 본 연구에서도 선암이 79%로 가장 흔한 조직형으로 확인되었다.
싱가포르에서 이루어진 Toh 등[18]의 연구에서 비흡연가 생존기간은 18.5개월, 흡연가 13.6개월로 비흡연가에서 생존기간이 긴 것으로 보고하였는데 본 연구에서는 비흡연자의 생존기간은 19.2개월로 Toh 등[18]의 연구와 유사하지만 진행병기의 환자만들 대상으로 한 점과 흡연가와 비교하지 못한 한계가 있다. 남성에서의 생존기간의 중앙값은 13.5개월, 여성에서는 21.6개월로 여성에서 생존 기간이 높게 나타났고(p = 0.03), 선암군과 기타 조직형군을 비교 시 각각 21.6개월, 8.8개월로 선암군에서 생존기간이 길었다(p = 0.038). Toh 등[12]의 연구에서도 여성과(p = 0.09), 선암에서 생존기간이 길었다(p = 0.455).
NSE는 폐암에서 민감도가 뛰어난 종양 표지자로서 신경세포의 분화가 많은 소세포폐암의 예후인자로서 관련이 많이 보고된 반면 비소세포암에서는 유용성이 많이 알려지지 않았지만 Maeda 등[19]은 비소세포암에서도 NSE 값이 예후에 관계됨을 보고하였고, Pujul 등[20]은 NSE 12.5초과인 경우 비교위험도가 1.52로 예후가 나쁜 것으로 보고하였다. 2005년도 본원의 김 등의 연구에서도 NSE 15초과인 경우 생존기간이 6.7개월이었으나 15이하인 경우 15.3개월로 NSE가 예후와 관계됨을 보고하였다. 본 연구에서도 NSE 15초과인 경우 생존기간이 13.4개월, 15이하인 경우 22.4개월로 NSE 값이 낮은 경우 생존기간이 길었다. 폐암이 여러 종류의 이질적(Heterogenous)인 종양이고, 비소세포암과 소세포암은 같은 내배엽에서 분화하였기 때문에 분화가 되면서 중복될 수 있고[21], 비소세포암에서 신경 내세포 분화가 있는 경우 전이에 관여하기에 예후가 나쁜 이유가 될 수 있다[22].
최근 비흡연가 폐암환자에 EGFR-TKI를 사용 시 반응률과 생존율에서 큰 향상을 보여 이에 대해 활발히 논의되는데 Lynch 등[23]은 선암환자에서 gefitinib의 효과적인 반응에 대해 보고하였고, 이후 여러 연구에서 EGFR-TK domain의 mutation이 여성, 비흡연가, 아시아인과 선암환자에서 많이 발견됨과 이들에 대한 EGFR-TKI의 효과적인 반응에 대해 보고되었다[24-26]. Wu 등[27]은 1차 항암 약제군의 종류와 관계없이 2차 약제군으로 EGFR-TKI를 사용하였을 때 생존기간과 관해 지속 기간의 향상을 보고하였다. 본 연구에서도 비흡연가에서 EGFR-TKI를 사용한 군의 생존기간은 24.3개월로 사용하지 않은 군의 9.7개월에 비해 생존기간의 향상이 있었으며(p = 0.001), 2차 항암약제로 EGFR-TK inhibitor (gefitinib, erotinib)를 사용한 군에서 관해 지속기간이 5.9개월로 기타 군 3.1개월에 비하여 관해 지속기간이 길었다(p = 0.01).
최근 비흡연자에서 Glypican-5 (GPC5) gene의 발현에 관계된 13q31.3 유전자의 변이와 GPC5 gene의 조절억제 이로 인하여 폐암에 대한 감수성이 높아짐에 대한 연구도 보고되었다[28]. 본 연구는 의무기록을 통해 후향적으로 조사하였으며 수술 가능한 병기의 환자는 제외한 진행병기의 환자를 대상으로 하여 선택 편견이 있을 수 있어 향후 임상에서의 전향적인 연구가 필요할 것으로 생각되며 이를 통해 보다 효과적인 치료방향의 설정이 필요할 것으로 생각된다.