췌장의 파골세포양 거대세포 미분화 암종 1예
A Case of Undifferentiated Carcinoma with Osteoclast-Like Giant Cells in the Pancreas
Article information
Abstract
저자들은 상복부 불편감과 소화불량을 있는 환자에서 췌장 미부에 선암종을 동반한 파골세포양 거대세포 미분화 암종을 진단하였고, 수술적 절제 후 방사선 치료와 항암화학요법을 시행한 예를 경험하였기에 문헌고찰과 함께 보고한다.
Trans Abstract
Undifferentiated carcinomas with osteoclast-like giant cells are rare pancreatic and periampullary neoplasms that mimic giant cell tumors of bone morphologically. Recently, we experienced an osteoclast-like giant cell tumor arising in the tail of the pancreas. A 76-year-old male was admitted with epigastric discomfort and indigestion. Abdominal computed tomography (CT) and abdominal magnetic resonance imaging (MRI) showed a 3×3-cm mass containing necrotic and hemorrhagic areas in the tail of the pancreas. A distal pancreatectomy and splenectomy were performed. Histological examination showed tumor cell components consisting of mononuclear pleomorphic cells admixed with osteoclastic giant cells. The final diagnosis was undifferentiated carcinoma with osteoclast-like giant cells with ductal adenocarcinoma in the pancreas. (Korean J Med 2011;80:82-86)
서 론
단핵 간질세포와 비교적 균일한 핵을 가진 파골세포 모양의 다핵 거대세포로 구성된 파골세포양 거대세포(osteoclast-like giant cell)는 유방, 갑상선, 이하선, 폐, 대장, 자궁근육, 심장, 간, 연부 조직 등에서 발견된다[1]. 췌장에서 발생하는 파골세포양 거대세포 미분화 암종(undifferentiated carcinoma with osteoclast-like giant cells)은 외분비 췌장암의 1% 이하로 매우 드물어[2] 그 기원이나 방사선적 진단 기준, 임상경과에 대해 명확하게 밝혀진 것은 없다. 치료 방법으로 대부분 수술적 절제를 하였으나[3-6], 최근에는 수술과 함께 항암화학요법을 병행하는 방법이 시도되고 있다[7,8]. 저자들은 췌장 미부에 발생한 파골세포양 거대세포 미분화 암종 1예를 경험하였기에 문헌고찰과 함께 보고한다.
증 례
환 자: 김〇〇, 남자 76세
주 소: 상복부 불편감, 소화불량
현병력: 내원 3개월 전부터 지속되는 상복부 통증과 소화불량을 주소로 내원하였다. 통증은 특별한 악화 요인 없이 간간이 발생하였고, 뚜렷한 체중 감소는 없었다.
과거력: 30년 전 고혈압을 진단받아 candesartan을 복용하고 있었으며 20년 전 제 2형 당뇨병을 진단 받아 metformin을 복용 중이었다.
가족력: 특이 사항 없음.
사회력: 20갑년의 흡연력이 있고, 8년 전부터 금연 중이며 10년 전부터 금주 상태이다.
진찰 소견: 상대적으로 건강해 보였으며 의식은 명료하였고, 혈압은 110/70 mmHg, 맥박수 76회/분, 호흡수 20회/분, 체온 36.7℃였다. 결막에 빈혈이나 공막의 황달은 관찰되지 않았고, 심음, 흉부청진은 정상이었다. 복부 진찰에서 장음은 정상이었으며 상복부에 압통이 있었으나 반발 압통은 없었고, 촉지되는 종괴는 없었다.
검사실 소견: 말초 혈액 검사에서 백혈구 6,700/mm³, 혈색소 12.8 g/dL, 혈소판 212,000/mm3였다. 혈액화학 검사상 BUN 25 mg/dL, 크레아티닌 1.3 mg/dL, 총 단백질 6.0 g/dL, 알부민 3.4 g/dL, AST/ALT 18/19 IU/L였다. 혈청 amylase 43 U/L, 혈청 lipase 22 U/L였다. CA 19-9 4 U/mL, CEA 1.9 ng/mL였고, AFP 0.89 ng/mL로 정상이었다.
방사선 소견: 복부 전산화 단층 촬영에서 췌장의 미부에 3×3 cm 크기의 종양이 관찰되었다(그림 1A). 췌장 자기공명영상에서는 내부에 일부 출혈과 함께 괴사된 소견이 보이는 췌장 미부의 종양이 관찰되었다(그림 1B). 원발 부위의 전이여부를 판정하기 위해 양전자 단층촬영을 시행하였고, 췌장 미부에서 표준화 섭취 계수 11.5의 부분이 보였다. 췌장 주변에서는 표준화 섭취 계수 2.0~3.5 정도의 림프절들이 보였다(그림 2).
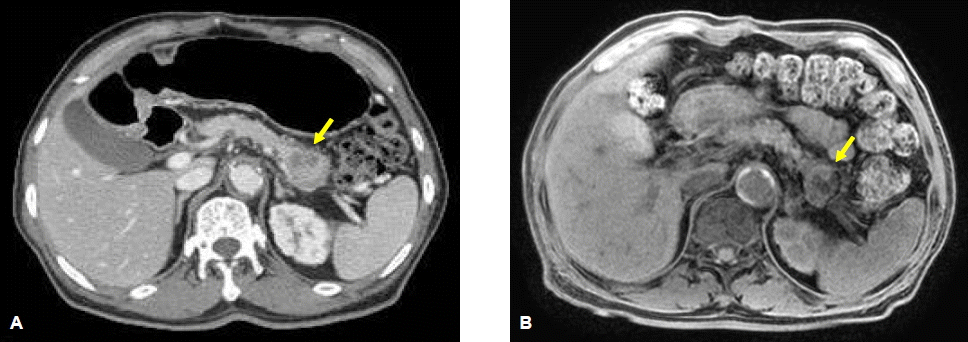
Abdominal CT (A) and T1-weighted abdominal MRI (B) show a 3×3-cm hypovascular mass with areas of internal hemorrhage and necrosis in the pancreas tail (arrow).
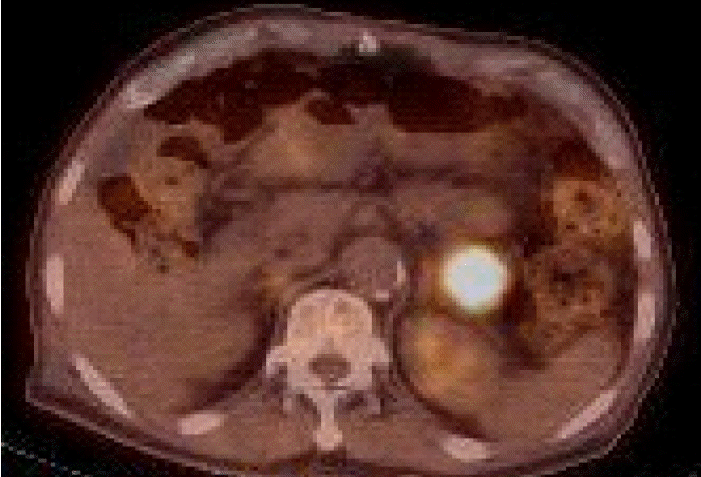
18F-fluorodeoxyglucose (FDG) positron emission tomography- computed tomography (PET-CT) of the torso shows a hypermetabolic lesion in the pancreas tail.
임상경과: 제 4병일에 원위부 췌장 절제술과 비장 전절제술, 좌측 부신 전절제술을 시행하였다. 절제된 췌장 미부에 경계가 불명확한 장경 3.5 cm의 종괴가 관찰되었다. 종괴의 단면은 광범위한 출혈과 괴사의 소견과 일부 부위에서 낭성변화를 동반하고 있었다(그림 3). 수술 후 절제면은 음성이었으나 췌장 주위의 림프절에 전이소견이 있었다.

Grossly, the surgically resected distal pancreas contains an ill-defined round mass with extensive hemorrhage and cystic degeneration.
현미경 소견에서 종양은 비정형성 핵을 가지고 있는 단핵세포와 다수의 핵을 가지면서 파골세포와 유사한 거대세포들로 이루어졌다. 단핵세포들에서는 전반적으로 심한 핵의 비정형성과 세포 분열이 관찰되었다. 거대세포들은 2~40개 정도의 핵을 갖고 있었으며, 핵들의 비정형성은 관찰되지 않았다(그림 4A). 종양의 일부에서는 투명한 세포질을 가지며 선구조를 형성하는 샘암종의 성분도 관찰되었다(그림 4B).
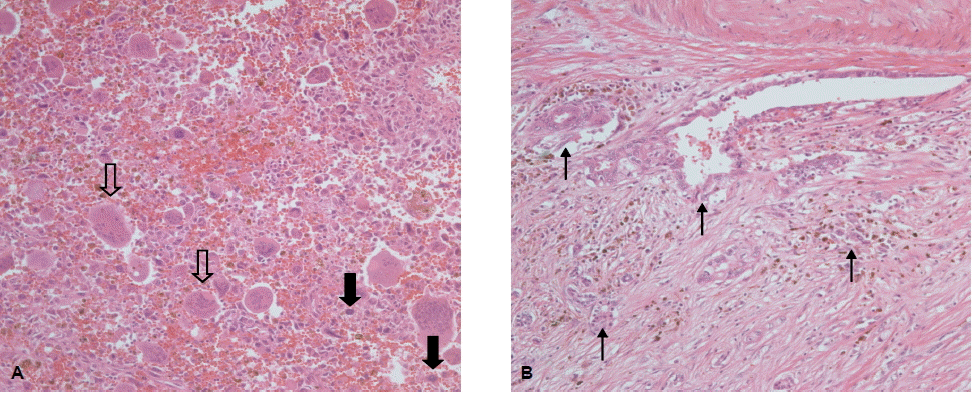
Microscopically, the tumor contains both atypical mononuclear cells (closed arrow) and osteoclast-like multinucleate giant cells (open arrow) (H&E staining; A, ×200) and ductal adenocarcinoma (closed arrowhead) (H&E staining; B, ×200).
면역조직화학염색에서 종양을 이루는 두 가지의 세포들이 각기 다른 양상의 발현을 보였다. 거대세포들은 CD68, vimentin에 양성, cytokeratin, epithelial membrane antigen (EMA)에 음성 소견을 보이는 반면, 단핵세포는 vimentin, cytokeratin, EMA에 양성, CD68에는 음성 소견을 보였다(그림 5A, 5B).

Immunohistochemically, the tumor mononuclear cells are negative for CD68, but the osteoclast-like multinucleate giant cells are positive for CD68 (A, ×400). Conversely, the mononuclear cells are positive for epithelial membrane antigen (EMA), while the osteoclast-like multinucleate giant cells are negative for EMA (B, ×400).
환자는 췌장의 선암종을 동반한 파골세포양 거대세포 미분화 암종을 진단받고 제 24병일에 보조적 항암-방사선 치료를 시행하였고, 총 7개월간 fluorouracil로 보조적 항암화학치료를 하였다. 환자는 진단받고 11개월이 지난 현재까지 재발의 소견 없이 외래에서 경과관찰 중이다.
고 찰
췌장의 거대세포 종양은 Sommers와 Meissner가 다형 암종 증례를 처음 기술한 이래로 보고된 증례의 수는 극히 적으며 이중 조직 아형 가운데 하나인 파골세포양 거대세포 미분화 암종은 매우 드문 췌장 종양으로 국내에서 7개의 증례만이 보고되어 있다[3-10].
거대세포 종양은 조직 소견에 따라 다형 거대세포 종양과 파골세포양 거대세포 종양으로 나뉜다. 다형 거대세포 종양은 거대세포나 다형핵 거대세포를 포함하는 췌장의 종양으로 미분화 암종 또는 역형(anaplastic) 암종으로 분류한다. 방추형 또는 난형의 다형성이 심한 종양 단핵세포로 구성되어 있고, 거대세포가 종양세포의 일부이다. 반면에 파골세포양 거대세포 종양은 미분화 암종과 유사한 세포들과 함께 파골세포 모양의 거대세포가 출현하고, 비종양 세포이다. 이 중 거대세포는 보통 20개 이상의 일정한 모양을 가지는 작은 핵들로 구성되어 있다[11,12].
파골세포양 거대세포종양의 기원에 대해서 아직 명확하게 밝혀진 것은 없다. 그러나 많은 경우, 국소 비정형 췌관선 구조가 발견되거나 선암종이 동반되어 발생하는 것으로 보아 상피세포에서 기원한다는 설이 있다. 본 증례에서도 선암종이 동반되어 있었다. 반면에 역형 세포가 존재하고 뼈에서 발생한 거대세포종양과 매우 유사한 파골세포양 거대세포가 출현하며 종양세포들이 vimentin에 양성 반응을 보이고 일부 종양에서는 상피세포 분화가 부족한 점으로 보아 중간엽에서 기원한다는 의견이 있다[9].
조직학적으로는 vimentin 외에 cytokeratin도 발현하며, 췌관선암종에서 처럼 CK7, CK8, CK18 그리고 CK19가 발현되나 K-ras 유전자 돌연변이는 관찰되지 않는다. 그리고 조직구의 면역화학염색표지자인 CD68, 백혈구 공통항원인 CD56, vimentin에 양성반응을 보이는 거대세포가 보인다[12-14]. 본 증례에서는 vimentin, cytokeratin, EMA에 양성, CD68에는 음성 소견을 보이는 단핵세포와 CD68, vimentin에 양성, cytokeratin, EMA에 음성 소견을 보이는 거대세포들을 관찰할 수 있었다.
파골세포양 거대세포의 역할과 종양세포인지 여부에 대해서 논란이 있으나 현재는 종양성분에서 성장인자나 화학주성 사이토카인을 생산하여 혈액 내 순환하는 단핵세포 체계의 전구세포를 증식 및 분화시킨다고 추측되며 비종양반응 세포로 여겨진다[9].
파골세포양 거대세포 미분화 암종의 방사선학 연구는 충분치 않으나 전산화 단층 촬영에서 괴사에 해당하는 저음영을 가지는 종괴로 동맥기에 강한 조영 증강을 보이는 것으로 기술되어 왔다. 혈관 조영 소견은 뼈에 생긴 거대세포암종과 같은 과혈관성이며 이는 조직학적으로 해면 혹은 굴모양 혈액강(sinusoidal blood space)을 가지기 때문이다[15].
자기공명 영상에서 역시 진단에 유용한 소견에 대한 연구는 없으나 본 증례에서는 종양 내부에 일부 출혈과 괴사된 소견이 관찰되었다.
임상적으로 췌장에 발생하는 파골세포양 거대세포 미분화암종의 남녀 발생비는 비슷하고 발병 연령은 30대의 젊은 사람에게도 보고된 경우가 있으나 대부분 60~70대 이상의 고연령이다. 주 증상은 복통, 식욕감퇴, 체중 감소, 황달, 오심, 구토, 복부 종괴였다[16]. 대개 선암종이 동반되었으며 이런 경우에 선암종이 동반되지 않는 순수한 형태의 파골세포양 거대세포 종양보다 더 나쁜 예후를 보인다. 반면에 선암종이 없는 경우에는 췌장에 발생하는 다른 종양에 비해 성장이나 전이가 천천히 발생하여 비교적 예후가 좋은 것으로 알려져 있다[9]. 진단 또는 수술 후 평균 생존은 20.4개월이었으며 대부분의 환자들이 진단 후 1년 안에 사망하였으나 15년 이상 생존한 환자들도 있었다[2,16].
대부분의 환자들은 수술적 절제를 하였으며[3-6], 일부에서는 환자가 치료를 거부하거나 전이된 정도가 심해, 치료하지 않고 경과관찰을 하였다[3,9]. 그러나 최근 국내에서 근치적 절제술 후 항암화학요법을 시행한 예가 보고되고 있다. 국내에서 보고된 파골세포양 거대세포 췌장암 환자 7예 중 수술 후 항암화학요법을 시행한 경우는 총 2예이며 모두 원격전이는 없었으나 재발을 방지하기 위해 gemcitabine을 사용하였다. 이 중 1예는 55개월간 생존하였고, 다른 1예는 2개월째 치료 중이다[7,8]. 본 증례에서는 췌장 미부에 종양이 있어 절제술을 시행하였고, 수술 후 절제면은 음성이었으나 췌장 주위의 림프절에 전이소견이 있어 방사선 치료와 함께 fluorouracil로 총 8회의 항암화학요법을 시행하였으며, 진단 후 11개월이 지난 지금까지 별다른 문제 없이 경과관찰 중이다.
파골세포양 거대세포 미분화 암종은 매우 드물기 때문에 이에 대한 치료는 아직까지 정립되지 않은 상태이며 지금까지 수술적 치료 외에 다른 치료를 시도한 경우가 드물다. 하지만 파골세포양 거대세포 미분화 암종이 대개 선암종과 동반되고, 상피세포에서 기원한다는 설이 있는 것을 고려해 볼 때, 항암화학요법을 시도해 볼 수 있으며, 뼈에 발생한 거대세포 종양과 유사하기 때문에 방사선 치료를 시도해 볼 수 있다. 최근에 수술과 함께 보조적인 치료를 시도하고 있으며, 아직 그 효용성에 대해 논의하기에 증례가 부족하지만, 파골세포양 거대세포 미분화 암종은 흔히 췌장에 발생하는 악성 종양보다 생존율이 길기 때문에 더 적극적인 치료가 고려되어야 한다. 따라서 수술 후 항암화학요법, 방사선 치료 등 보조요법을 다양하게 시도함으로써 장기적인 치료를 확립하는 것이 중요하다.