집단생활하는 경찰부대에서 A형 간염바이러스의 감염력 및 발병력 연구
Infectivity and Pathogenicity of Hepatitis A Virus during an Outbreak in a Communal Living Setting
Article information
Abstract
목적:
성인에서 현증 A형 간염 발생이 증가하면서 공중보건 문제가 되고 있다. A형 간염의 발생률과 항체 양성률에 관한 연구는 많이 보고되고 있으나, A형 간염바이러스의 감염력이나 발병력에 대한 연구는 거의 없는 실정이다. 본 연구는 집단생활하는 경찰부대의 A형 간염 유행의 2차 감염률과 발병률을 통해서 A형 간염바이러스의 감염률과 발병률을 연구하였다.
방법:
대원 3명이 A형 간염으로 입원치료하였던 전투경찰부대의 부대원 중 초발환자를 제외하고 이후에 발생한 A형 간염 환자 2명을 포함한 70명(이하 환자 접촉군)을 대상으로, A형 간염 임상 증상 동반 유무와 과거 A형 간염 백신접종 여부를 포함한 병력청취, 간기능검사를 포함한 혈액검사, 혈청검사를 3번째 현증 A형 간염 환자의 퇴원일에 검사하였으며, 잠복기를 감안하여 3번째 현증 A형 간염 환자의 황달 발현시점 2개월 후에 병력청취를 포함한 동일한 검사를 반복 시행하였다. A형 간염이 발생치 않은 다른 부대의 전투경찰대원 75명(이하 환자 비접촉군)을 비교 연구하기 위하여 병력청취 및 동일한 검사를 시행하였다. 전체 감수성 있는 긴밀접촉자 중 HAV 감염자의 비율을 바이러스의 2차 감염률로, HAV 감염자 중에서 현증 A형 간염으로 진단된 자의 비율을 발병률로 정의하였다.
결과:
환자 비접촉군에서는 IgM anti-HAV, IgG anti-HAV가 모두 음성이었고, 환자 접촉군에서는 IgM anti-HAV, IgG anti-HAV 둘다 양성은 3명, IgG anti-HAV만 양성은 2명이었다. 연구 대상자 중 현증 A형 간염은 입원치료하였던 2명 이외는 없었다.
결론:
20대 젊은 남성들이 집단생활하는 경찰부대에서 A형 간염 초발환자와 접촉한 환자 접촉군의 A형 간염바이러스의 2차 감염률은 4.3~7.1%였고, 발병률은 40.0~66.7%였다.
Trans Abstract
Background/Aims:
Acute viral hepatitis A infection in adults is an emerging public health problem in Korea. The infectivity andpathogenicity of hepatitis A virus (HAV) among people living in close contact have not been studied previously. This study investigatedthe secondary attack rate and pathogenicity rate of HAV during an outbreak among auxiliary police in a communal livingsetting in Korea.
Methods:
A total of 70 people in close contact with a hepatitis A patient (index case) were enrolled in the study, which includeda thorough oral history, physical examination, and laboratory testing. The subjects were part of an auxiliary police unit living in acommunal setting (HAV contact group). Serum antibody titers were measured in the contact group at two points during the study.Subjects in another auxiliary police unit without exposure to hepatitis A were examined as a control group (HAV non-contactgroup). The secondary attack rate and pathogenicity rate were calculated from the data.
Results:
In the HAV non-contact group, none of the subjects had anti-HAV antibodies. In the HAV contact group, three subjectshad both IgM and IgG anti-HAV antibodies, and two had only IgG anti-HAV antibodies. Two of three HAV-infected subjects weretreated for hepatitis A.
Conclusions:
The secondary attack rate of HAV was 4.3~7.1% and the pathogenicity rate was 40~66.7% in the group of youngadults. (Korean J Med 2011;80:63-67)
서 론
A형 간염은 A형 간염바이러스(hepatitis A virus, HAV)에 의해 발생하는 급성 간염으로 대변-구강 경로를 통하여 감염되는 전염성이 높은 질환이다[1]. A형 간염은 환자와의 친밀한 접촉을 통해 가족이나 친지, 집단생활을 하는 사람들 사이에서 전파되어 발생하거나, 오염된 식수나 음식을 통해 전파되어 집단적으로 발생하는 것이 가장 흔한 경로이고, 습관성 약물중독, 동성연애, 수혈 등이 감염의 고위험군으로 알려져 있다[2-4]. 반수 이상의 환자에서는 역학조사를 철저히 하여도 명확한 전염원을 찾을 수 없었다[2,5].
국내에서는 사회경제적인 발전과 함께 위생환경의 개선으로 인하여 유소아에서 불현성 감염을 통해 면역을 획득하는 경우가 줄어들면서, 2000년대 들어 보고된 연구결과에서는 20대의 A형 간염 항체 양성률이 0.6~2%로 감소하였고[1,6,7], 성인에서 현증 A형 간염 발생이 증가하면서 공중 보건 문제가 되고 있다[5,8]. A형 간염의 발생률과 항체 양성률에 관한 연구는 많이 보고되고 있으나, A형 간염바이러스의 감염력(infectivity)이나 발병력(pathogenicity)에 대한 연구는 거의 없는 실정이다. 감염력은 숙주의 표적 장기에 침입하여 증식하는 병원체의 능력으로, 감수성이 있으면서 초발환자(index case)에 노출된 개체 수에 대한 감염된 개체 수의비율(2차 감염률)로 나타낼 수 있다[9]. 발병력은 감염자에서 감염 질환이 발생할 수 있는 정도를 결정하는 병원체의 특성으로, 전체 감염자의 수에 대한 감염 질환이 발생한 감염자수의 비율(발병률)로 나타낼 수 있다[9]. A형 간염바이러스의 2차 감염률(secondary attack rate)과 발병률(pathogenicity rate)에 대한 연구를 통해, 군인과 전투경찰 등의 긴밀접촉이 있는 집단생활 단체에서 A형 간염의 전파위험성을 알 수 있고 관리, 치료와 격리여부 판단 등에 도움을 줄 수 있을 것이다.
전투경찰부대에서는 건강한 젊은 성인 남자들이 복무기간동안 식사, 취침, 용변, 근무 및 기타 자유시간을 같은 공간(숙소, 식당, 화장실 등)을 공유하며 지내는 집단생활을 하기에 A형 간염의 유행이 종종 보고되고 있다. 이에 유행이 있었던 전투경찰부대의 A형 간염바이러스 항체 혈청검사, 문진 및 간기능 검사를 통해, A형 간염바이러스의 2차 감염률과 발병률을 연구하였다.
대상 및 방법
2009년 5월부터 7월까지 인천에 위치한 전투경찰부대에서 생활하는 대원 3명이 A형 간염으로 진단받고 경찰병원에 입원치료하였다. 그 부대에서 생활하는 전투경찰대원 중 A형 간염으로 치료받았던 첫 환자, 즉 초발환자(index case)를 제외하고 이후에 발생한 A형 간염 환자 2명을 포함한 70명(이하 환자 접촉군)을 대상으로, A형 간염 임상 증상 동반 유무와 과거 A형 간염 백신접종 여부를 포함한 병력청취, 간기능검사를 포함한 혈액검사 및 IgM anti-HAV (Anti-HAV IgM IRMA Kit, BINBT, Beijing, China), IgG anti-HAV (Anti-HAV IgG IRMA Kit, BINBT, Beijing, China), hepatitis B surface antigen, hepatitis B surface antibody, hepatitis C virus antibody를 3번째 현증 A형 간염 환자의 퇴원일에 검사하였으며, 잠복기를 감안하여 3번째 현증 A형 간염 환자의 황달 발현시점 2개월 후에 병력청취를 포함한 동일한 검사를 반복 시행하였다. A형 간염이 발생하지 않은 다른 부대의 전투경찰대원 75명(이하 환자 비접촉군)을 비교 연구하기 위하여 병력청취 및 동일한 검사를 시행하였다. HAV 감염자(anti-HAV 양성)이면서, 간염의 흔한 임상양상(황달, 고열, 구역, 전신쇠약감)의 발생, 빌리루빈 수치의 상승을 동반한 간기능 검사의 이상소견이 있고, 다른 간염바이러스의 혈청검사가 음성인 경우를 현증 A형 간염으로 진단하였다. 전체 감수성 있는 긴밀 접촉자 중 HAV 감염자의 비율을 바이러스의 2차 감염률로, HAV 감염자 중에서 현증 A형 간염으로 진단된 자의 비율을 발병률로 정의하였다.
결 과
전체연구 대상의 연령 중앙값은 20세(18~25세)이며, 환자 접촉군의 연령 중앙값은 21세(19~24세), 환자 비접촉군의 연령 중앙값은 20세(18~25세)였다. 병력청취 결과 A형 간염 백신 접종과 과거에 A형 간염 감염의 병력은 환자 접촉군과 비접촉군에서 모두 없었다. 기본혈액검사결과(간기능 검사 포함), 검사 당일 A형 간염으로 치료받고 퇴원한 1명의 AST와 ALT 상승을 제외하고는 환자 접촉군과 환자 비접촉군에서 모두 정상이었다. 환자 비접촉군에서는 IgM anti-HAV, IgG anti-HAV가 모두 음성이었고, 환자 접촉군에서는 IgM anti-HAV, IgG anti-HAV 둘다 양성은 초발환자 이후에 발생한 2명의 환자를 포함하여 3명, IgG anti-HAV만 양성은 2명이었다. 연구 대상자 중 현증 A형 간염은 입원치료하였던 2명 이외는 없었다. 2개월 후에 IgM anti-HAV, IgG anti-HAV 검사를 환자 접촉군에서 반복한 결과에서도, 혈청전환(seroconversion)의 소견은 없었고, 새로이 발생한 간염 환자도 없었다. 이를 통해, 환자 비접촉군에서는 항체 양성인 자가 없었으며, 환자 접촉군에서는 IgM anti-HAV, IgG anti-HAV 둘다 양성이면서 초발 환자 발생 이후에 현증 A형 간염으로 입원치료했던 2명과 IgM anti-HAV, IgG anti-HAV 둘다 양성이나 무증상 감염자인 1명, 그리고 IgG만 양성인 2명으로 총 5명이었다. 환자 비접촉군에서 항체 양성인 자가 없는 것과 국내에서 2000년 이후 20대 젊은 성인의 A형 간염에 관한 혈청학적 연구결과들을 근거로 하여, 환자 접촉군의 IgG anti-HAV만 양성인 2명도 최근 A형 간염바이러스 감염의 결과로 판단하면, 이를 통한 HAV의 2차 감염률은 7.1% (5/70)이고 발병률은 연구기간 동안 5명 감염자 중 2명이 발병하여 40%였다. 그와 다르게 IgG anti-HAV만 양성인 2명의 결과를 이전의 불현성 A형 간염의 감염에 의한 것으로 본다면 HAV의 2차 감염률은 4.3% (3/70)이고, 발병률은 3명 감염자 중 2명이 발병하여 66.7%이다.
고 찰
우리나라의 A형 간염 발생은 1980년대까지는 개인과 사회의 위생이 좋지 않은 저개발국에서 보이는 것처럼, 6세 이하의 유소아에서 감염되어 불현성 감염을 통해 자연 면역을 획득하는 경우가 대부분으로 성인에서 현증 A형 간염 증례를 보기 힘들었으나, 화장실과 같은 위생환경의 개선으로 인하여 소아 연령의 감염이 줄어들어서 젊은 성인 연령층의 항체 양성률이 낮아지고[8], 성인이 된 후에 A형 간염바이러스에 처음 노출되면서 증상이 현저한 A형 간염 증례가 많이 보고되고 있다[6,8]. 국내 A형 간염 항체 양성률은 1980년대 10~19세에는 86.7%, 20세 이후 96% 이상으로 매우 높게 나타나던 것이 1990년대 중반에는 20세 이하의 항체 양성률이 9~15%로 감소하였고[8,10,11], 2000년대 들어 보고된 A형 간염 항체 양성률을 조사한 연구들을 통해 나타난 결과는 21~30세는 0.6~2% [1,6,7]로 급격히 낮아지는 소견을 보였다.
A형 간염바이러스의 잠복기는 15~45일이며, IgM anti-HAV는 바이러스 감염 후 생성되어, 대변에서 A형 간염바이러스가 검출되지 않을 때부터 혈청검사상으로 검출가능하고 대개 3~6개월 뒤 소실되며, 면역항체이기도 한 IgG anti-HAV는 평생 지속된다[12,13]. A형 간염바이러스는 간에서 복제되어 담즙으로 배출되므로, 대변에서 높은 농도로 발견된다. 대변 내 바이러스 검출 연구에 따르면, 대변을 통해서 증명된 A형 간염바이러스의 감염력은 황달 발생 3주 전부터 황달 발생 8일 후까지였으나, 황달 발생 2주 전이 가장 높은 농도를 나타내었고, 황달 발생 직후부터 급격히 감소하였다[14-16]. 이를 통해, 본 연구의 A형 간염 감염자들의 감염 가능 시기와 시기에 따른 감염력 상태를 추정하였다(그림 1).
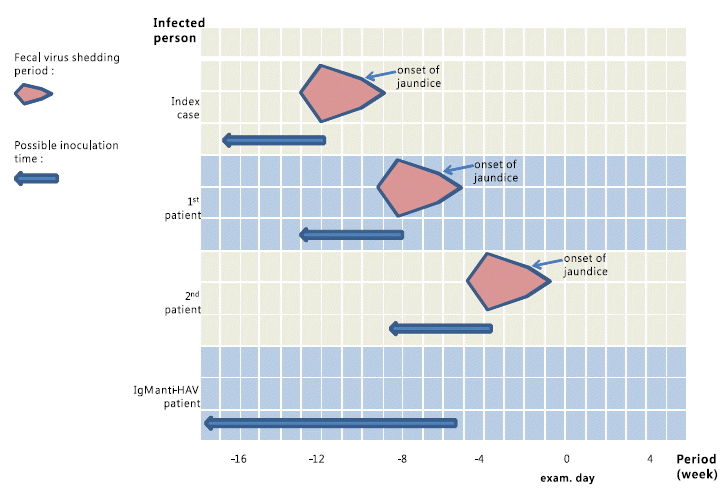
The highest viral concentration in the stool occurs during the 2-week period prior to the development of jaundice and elevated liver enzymes. However, stools are infective from 21 days before until 8 days after the appearance of symptoms. Viral concentration in the stool declines rapidly after the appearance of jaundice. Hepatitis A virus has an incubation time of 15~45 days. The IgM anti-HAV antibodies persist for 3~6 months, and IgG anti-HAV antibodies persist permanently. Incubation periods and antibody levels were used to estimate the time of viral transmission for each case.
2007년에 강 등은 군인을 대상으로 한 연구에서 HAV 항체 양성률을 2%로 보고하였고[17], 같은 해에 이 등은 507명의 전투 경찰을 대상으로 한 연구에서 항체 양성률을 0.6%로 보고하였다[7]. 본 연구결과에서 감수성있는 긴밀접촉자 70명 중에서는 IgM anti-HAV, IgG anti-HAV 둘 다 양성은 3명, IgG anti-HAV만 양성은 2명이었다. IgG anti-HAV만 양성인 자에서의 항체가 과거의 불현성 A형 간염의 감염에 의한 것인지, 아니면 초발환자에 노출된 이후에 생긴 것인지 명확하지 않다. 20대 젊은 성인에서 A형 간염 항체 양성률이 낮고, 또한 본 연구의 환자 비접촉군에서도 항체 양성률은 0% (0/75)로 나타난 것을 근거로, IgG anti-HAV만 양성인 자는 초발환자에 노출된 후 발생한 최근 A형 간염바이러스 감염의 결과로 추정할 수 있으나, 과거에 발생했을 가능성도 완전히 배제할 수 없어서 결과를 같이 병기하였다.
감염력을 실험실 환경이 아닌 임상에서 실제로 감염력을 측정하는 방법으로는 2차 감염률이 있으며[9], A형 간염의 2차 감염률(secondary attack rate)로 감염력을 평가한 연구들에서는 연구의 대상군과 연구방법에 따라 7.9~43.3%였다[18-22]. 그러나 대부분 소아나 유아에 대한 연구였고, 감수성이 있는 성인집단을 대상으로 한 연구는 거의 없었다.
발병력의 측정 방법은 감염자의 수에 대한 현증증상이 발생한 감염자 수의 비율인 발병률로 나타낼 수 있으며[9], 발병력은 병원체의 특성이지만 숙주의 나이, 면역력 등의 숙주의 특성에 따라 큰 영향을 받는다[9]. A형 간염의 발병력에 대한 연구는 많지 않으나, 2009년에 발표된 A형 간염바이러스 감염자와 긴밀접촉한 16세 이하의 어린이에서 행해진 연구에서 30명의 긴밀접촉자에서 13명이 A형 간염으로 판정되었고, 13명 중 유증상 감염은 부모에게 질문하여 얻어진 아이의 임상증상 동반 유무로 판단하여 10명으로 보고하여[19], 발병률은 13명 중 10명으로 77%로 유추할 수 있었다. 그러나 이 경우에 황달이 나타난 경우는 없었고, 간기능검사는 시행하지 않았다. 1980년에 발표된 보육시설에서의 A형 간염에 관한 연구에서 의사의 병력청취와 이학적 검사를 통해 무증상 감염이 1~2세에서는 84%, 3~4세에서는 50%, 5세 이상에서는 20%로 추정할 수 있다고 보고하여[23], 이를 통해 발병률을 유추할 수 있겠다. A형 간염의 발병률에 대한 상기 연구 같이 어린이에서 시행된 경우는 있으나 성인에서 보고된 발병률 연구는 없었다. 본 연구에서는 20세의 성인에서 간기능 검사와 함께 신체검진, 문진을 통해 A형 간염바이러스의 감염력, A형 간염의 발병력을 제시하였다.
본 연구는 평균나이 20세의 전투경찰들을 대상으로 하였으므로 다양한 인구전체를 대변할 수는 없다. 또한 1명의 A형 간염 초발환자(index case) 후 2명의 환자를 포함한 70명의 접촉자, 75명의 대조군을 대상으로 한 소규모 연구라는 점, 후향적 연구로 초발환자 발생 후 바로 연구를 시작하지 못하여 유행발병 시작 전의 혈청학적 상태를 알 수가 없어서 IgG anti-HAV만 양성인 경우의 해석이 정확하지 못한 점, 감염원이나 감염경로와 같은 감염의 역학을 정확히 밝힐 수 없었다는 점을 제한점으로 들 수 있겠다.