판토프라졸이 난소 적출한 ICR 생쥐의 골교체에 미치는 영향
The Effect of Pantoprazole on Bone Turnover in Ovariectomized ICR Mice
Article information
Abstract
목적:
장기간의 양성자 펌프 억제제 투여는 골다공증과 연관된 병적 골절과 연관이 있다고 알려져 있다. 그러나 양성자 펌프 억제제의 장기간 사용이 어떤 기전으로 골절의 위험을 높이는지에 대해서는 알려지지 않았다. 이 연구는 난소 적출한 ICR 생쥐의 골교체에 양성자 펌프 억제제인 판토프라졸이 미치는 영향을 알아보고자 하였다.
방법:
실험동물로 난소를 적출한 암컷 ICR 생쥐를 사용하였다. 이들은 무작위로 판토프라졸군(n=10) 및 대조군(n=10)으로 나누었다. 판토프라졸군은 매일 20 mg/kg의 판토프라졸을 복강 내로 두 차례씩 주입했다. 4주간의 실험이 끝난 뒤 이들을 희생시켜 골밀도 및 경골의 건중량을 측정하였고 채취한 혈액으로 ELISA를 이용하여 골교체 표지자인 osteocalcin 및 CTX-1을 측정하였다. 또한, 비장을 추출하여 균질화한 후 RT-PCR을 통해 파골세포의 분화를 촉진하는 사이토카인의 발현을 측정하였다. 골대사와 연관이 있는 혈청 calcium, phosphorus, ALP (alkaline phosphatase) 등도 측정하였다.
결과:
혈청 osteocalcin 농도는 판토프라졸군에서 의미있게 낮게 측정되었으나(p=0.023) 골밀도, 경골의 건중량, 그리고 혈청 ALP, calcium, phosphorus, CTX-1 농도는 양 군 간에 유의한 차이를 보이지 않았다. RT-PCR을 통해 측정한 IL-1β의 발현은 판토프라졸군에서 감소하는 경향을 보였으나(p=0.058), TNF-α, IL-1β, IL-6의 발현은 양 군 간에 유의한 차이를 보이지 않았다.
결론:
이번 실험에서 판토프라졸은 난소를 적출한 ICR 생쥐의 혈청 osteocalcin 농도 및 비장 세포에서의 IL-1β 활성도를 감소시켜 판토프라졸이 골형성 및 골흡수에 영향을 미칠 수있음을 보여주었다. 그러나 추후 보다 많은 개체수를 이용한 추가적인 연구가 더 필요할 것으로 생각한다.
Trans Abstract
Background/Aims:
Long-term exposure to proton pump inhibitors is associated with osteoporosis-related fractures; however, themechanism is unknown. The purpose of this study was to evaluate the effect of pantoprazole on osteoporosis and bone turnover inovariectomized ICR mice fed a calcium-free diet.
Methods:
Ovariectomized female ICR mice were divided into a pantoprazole group (n=10) and a control group (n=10). The micein the pantoprazole group were given an intraperitoneal injection of pantoprazole at 20 mg/kg twice daily. After 4 weeks, the micewere humanely euthanized, and bone mineral density (BMD) and dry tibia weight were measured. Serum osteocalcin and CTX-1levels were measured by enzyme-linked immunosorbent assay. The mRNA expression levels of cytokines that stimulate osteoclastdifferentiation were determined using RT-PCR. Serum calcium, phosphorus, and alkaline phosphatase (ALP) levels were alsoanalyzed.
Results:
Serum osteocalcin concentration was significantly lower in the pantoprazole group compared with the control group(p=0.023). There was no difference in BMD, dry tibia weight, or serum ALP, calcium, phosphorus, or CTX-1 between the twogroups. The expression of interleukin (IL)-1β was lower in the pantoprazole group compared with the control group, but not significantlylower (p=0.058). The levels of tumor necrosis factor-α and IL-6 did not differ between the two groups.
Conclusions:
Pantoprazole, a proton pump inhibitor, decreased serum osteocalcin and suppressed IL-1β expression, suggestingthat pantoprazole affects bone formation and resorption in ovariectomized ICR mice. Further studies using larger sample sizes areneeded. (Korean J Med 2011;80:56-62)
서 론
위식도 역류 질환, 소화성 궤양 등은 매우 흔한 질환으로 그 유병률이 갈수록 증가하고 있으며, 최근의 연구에 따르면 위식도 역류 질환의 유병률은 미국, 중국, 싱가포르 등에서 급격히 증가하는 경향을 보이고 있다[1]. 위산 분비를 억제하기 위한 약제의 사용도 이에 따라 증가하고 있어 최근 영국의 한 지역에서 실시된 연구에 따르면 제2형 히스타민 수용체 길항제 및 양성자 펌프 억제제 등 위산 분비 억제제는 처방된 약물의 14%에 달하는 비용을 차지하였으며 2.8%의 일반 인구집단에서 위산 분비 억제제를 장기적으로 처방받고 있다고 보고하였다[2]. 이들 위산 분비 억제제 중 양성자 펌프 억제제는 위식도 역류 질환 치료의 근간이 되는 동시에 소화성 궤양 및 기능성 소화불량증의 치료에도 유용하게 쓰이고 있다[3,4]. 이러한 치료 효과와 더불어 양성자 펌프 억제제는 뚜렷한 부작용도 없어서 만성 질환에서의 장기치료에 적합한 것으로 알려져 있다[5]. 그러나 최근의 연구에서 노인에게 있어 병원감염 폐렴을 약 세 배나 증가시킨다는 보고가 있었으며 Clostridium difficile 감염과의 연관 가능성이 제기되고 있다[6,7]. 또한 심한 위산 분비 억제로 인해 불용성 칼슘의 흡수가 저해되어 골다공증 및 그로 인한 대퇴골두 골절과 같은 합병증의 발생할 수 있다는 연구결과도 발표되고 있다[8-10].
뼈는 조골세포의 작용으로 인한 골형성과 파골세포의 작용으로 인한 골흡수의 작용이 평생동안 끊임없이 일어나면서 골밀도가 유지되는 활성 유기조직이다[11]. 골다공증은 가장 흔하게 발생하는 뼈의 대사성 질환으로 단위체적당 골질의 감소에 의해 발생하며 골질의 감소는 골형성에 대한 골흡수의 비율이 증가함으로써 발생한다[12]. 골다공증은 폐경기의 여성에서 난소기능의 저하로 인한 에스트로겐 결핍이 주된 원인이 되며, 조골세포에서 IL-1, IL-6 등 사이토카인 생성 증가로 인해 파골세포가 활성화되어 골흡수가 발생한다. 그 외에도 골다공증은, 활동량 부족, 칼슘 섭취 부족등으로 인해 유발된다고 알려져 있다[13].
이론적인 기전을 살펴보면, 칼슘의 흡수는 위의 산성도가 중요한데 양성자 펌프 억제제는 위산 분비를 억제함으로써 칼슘의 흡수를 억제하여 골다공증의 발생에 관여하는 것으로 설명되고 있으며[14], 다른 한편으로는 양성자 펌프 억제제가 파골세포의 세포막에 존재하는 공포의 H+-K+/ATPase를 억제시켜 골흡수를 저해하는 것으로도 알려져 있다[15]. 그러나 양성자 펌프 억제제를 장기간 사용했을 때 골다공증 및 대퇴골두 골절을 일으키는 기전은 명확히 밝혀지지 않아서, 최근의 골다공증 가이드라인에서는 명확한 기전이 규명될 때까지 양성자 펌프 억제제를 장기 복용할 때에는 동시에 칼슘 섭취를 보충할 것을 권고하고 있다[16].
이에 이번 연구는 양성자 펌프 억제제가 골교체에 영향을 끼쳐 골다공증을 악화시킬 것이라는 가정하에 양성자 펌프 억제제가 난소적출 및 칼슘제거 식이를 시행한 ICR mice 모델을 이용하여 양성자 펌프 억제제가 골다공증 및 골교체에 어떠한 영향을 미치는지 알아보고자 하였다.
대상 및 방법
실험 동물
실험 동물로 암컷 ICR mice (SLC, Inc., Shizuoka, Japan) 20마리를 구입하였다. 6주령에 난소적출을 시행한 후 2주간 안정을 취하게 하였다. 사육실내 환경은 일정조건(온도 23±1℃, 습도 55±5%)을 유지하였으며 명암은 12시간 간격(light: 7:00~19:00)으로 조절하였다. 골교체에 미치는 영향을 배제하기 위해 칼슘이 배제된 식이를 시행하였다. 이번 연구는 본원 동물실험위원회의 허가를 받았으며 그 규정에 따라 실험을 진행하였다. 또한 실험 과정 중 난소적출술 시 충분한 마취를 하여 실험에 사용된 동물의 고통을 줄이고자 노력하였다.
실험 방법
난소적출을 시행한 생쥐는 인간의 폐경 때와 비슷한 해면골 변화 양상을 나타내므로 골다공증으로 인한 골변화 연구에 적당한 실험 동물이다[16,17]. 따라서 암컷 ICR mice 20마리의 난소를 이들이 6주령이 된 시점에 적출하였고, 8주령 때 판토프라졸군과 대조군으로 무작위 분류하여 실험을 진행하였다. 4주간에 걸쳐 판토프라졸군에는 하루에 두 차례씩 20 mg/kg의 판토프라졸을 복강내 주입하였으며 동시에 대조군에는 같은 양의 생리식염수를 주입하였다. 판토프라졸 및 생리식염수가 두 군에 주입된 4주간은 칼슘이 결핍된 식이가 공급되었다. 4주간의 실험기간 종료 후 쥐를 희생하여 우심방에서 혈액을 채취하였고, 경골 및 비장을 적출하였다.
분석 대상
경골의 골밀도 및 질량
골밀도는 Dual-energy X-ray absorptiometer (DEXA) (XR-26; Norland medical systems, Fort Atkinson, WI, USA)를 통해 측정하였다. 경골의 건중량(dry tibia weight)은 경골중량 절대치/체중×100으로 계산하였다.
Enzyme-linked immunosorbent assay (ELISA)
ELISA를 통해 조골세포에서 분비되고 골형성 표지자인 혈청 osteocalcin (Biomedical technology, Stoughton, MA, USA)과 파골세포에서 분비되고 골흡수의 표지자로 알려진 혈청 CTX-1 (Nordic bioscience, Herlev, Denmark)을 ELISA를 통해 측정하였다. ELISA는 각각의 실험도구 제작사에서 제시한 방법대로 진행하였다. 요약하면, 양 군에서 채취한 혈액에서 원심 분리하여 추출한 혈청을 streptavidin으로 코팅된 microtitre well에 각각 25 μL씩 분주한 후 미리 준비한 antibody solution을 100 μL씩 첨가하였다. 그 후 2~8℃에서 60±5분간 배양한 후 washing buffer를 이용해 다섯 차례에 거쳐 세척하였다. 100 μL씩의 chromogenic substrate를 각각의 well에 첨가하고 15±2분간 배양한 후, sulfuric acid를 plate에 넣어 발색반응을 중지시켰다. 마지막으로 450~650 nm의 파장 구간에서 흡광도를 측정하였다.
Reverse transcriptase-polymerase chain reaction(RT-PCR)
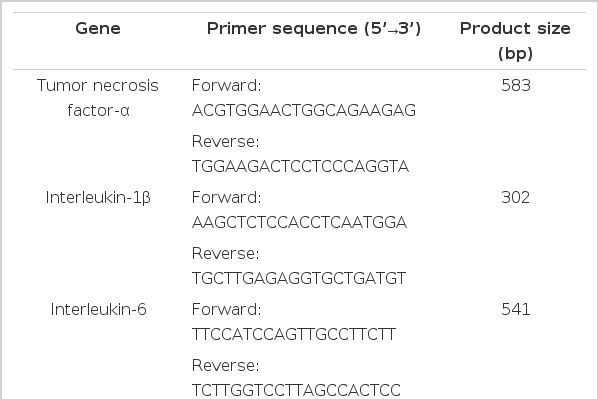
TNF-α, IL-1β, IL-6와 같은 파골세포의 분화를 촉진하는 사이토카인들의 mRNA 발현 정도를 분석하기 위해 RT-PCR을 시행하였다. 요약하면, 실험 종료 후 실험 동물의 비장을 균질화(homogenization)한 후 Trizol 시약(Invitrogen, Carlsbad, CA, USA)을 사용해 RNA를 추출하였다. Superscript II reverse transcriptase (Invitrogen)을 사용해 cDNA를 합성한 후 PCR을 수행하였으며 생성물은 1% 아가로스 겔에서 전기영동 후 photo-documentation system (ChemiImager 5500, Alpha innotech, San Leandro, CA, USA)으로 분석하였다(표 1).
혈액학적 분석
양성자 펌프 억제제가 골대사에 미치는 영향을 알아보기 위해 혈청 calcium, alkaline phosphatase (ALP), phosphorus 농도를 측정하였다. 즉, 실험동물에서 채취한 혈액을 실온에서 약 30분 방치한 다음 원심분리를 통하여 혈청을 분리하였고, 혈청 내 calcium, ALP, phosphorus 측정은 시약(Denka seiken Co., Ltd., Tokyo, Japan)을 이용해 활성도 분석을 진행하였다.
통계 분석
통계 프로그램은 SPSS (version 12.0, SPSS Inc., Chicago, IL, USA)를 이용하였다. 각 실험군별로 연속변수의 평균치와 표준편차를 구하였고, 통계분석은 Wilcoxon signed rank test를 사용하였다. p 값이 0.05 미만인 경우 통계적으로 유의하다고 설정하였다.
결 과
경골의 골밀도 및 중량
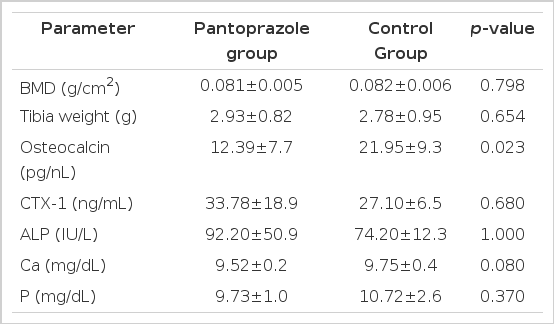
경골의 골밀도 측정 결과 판토프라졸군이 0.081±0.005 g/cm2, 대조군이 0.082±0.006 g/cm2로 유의한 차이가 없었으며(p=0.798), 경골의 중량 또한 판토프라졸군이 2.93±0.82 g, 대조군이 2.78±0.95 g으로 유의한 차이를 보이지 않았다(p=0.654, 표 2).
골교체 표지자
판토프라졸이 골교체 표지자에 미친 영향을 살펴보면, 혈청 osteocalcin 농도는 판토프라졸군이 12.39±7.7 pg/nL, 대조군이 21.95±9.3 pg/nL로 판토프라졸군에서 유의하게 낮았으나(p=0.023), 혈청 CTX-1은 판토프라졸군이 33.78±18.9 ng/mL, 대조군이 27.10±6.53 ng/mL로 양 군 간에 유의한 차이는 없었다(p=0.68, 표 2).
혈청 화학 검사
혈청에서 측정한 calcium, ALP, phosphorus 모두 판토프라졸군과 대조군 사이에 유의한 차이는 없었다. 혈청 calcium은 판토프라졸군이 9.52±0.2 mg/dL, 대조군이 9.75±0.4 mg/dL로 판토프라졸군에서 더 낮은 경향을 보였으나(p=0.08, 표 2), 통계적으로 유의한 차이는 없었다.
사이토카인(TNF-α, IL-1β, IL-6)
비장에서 추출한 사이토카인의 mRNA 발현을 RT-PCR을 통해 분석한 결과, 통계적으로 유의하지는 않았으나 판토프라졸군의 IL-1β mRNA의 발현이 대조군에 비해 억제되는 경향을 보였다(p=0.058). 그러나 TNF-α, IL-6 등 다른 사이토카인은 판토프라졸군과 대조군 사이에 뚜렷한 차이가 나타나지 않았다(그림 1).

(A) RT-PCR of the cytokine genes TNF-α, IL-1β, and IL-6 in the pantoprazole and control groups. Total RNA was isolated from splenic tissues, and 1 uL of cDNA was used as a template for RT-PCR. The mRNA expression level of each gene was analyzed three times by RT-PCR. (B) The mRNA levels of TNF-α, IL-1β, and IL-6 relative to that of β-actin. Pantoprazole showed a tendency to inhibit IL-1β gene expression (p=0.058). Expression levels of the other two genes did not differ between the groups.
고 찰
최근 위식도 역류 질환이나 소화성 궤양 등의 치료를 위한 장기간의 양성자 펌프 억제제 사용이 늘어남에 따라 이의 부작용에 대한 연구들이 활발히 진행 중이다. 최근 한 연구에서 고용량의 양성자 펌프 억제제를 1년 이상 복용한 경우 사용하지 않은 군에 비해 대퇴골두 골절이 44% 증가한다는 보고가 있었다[10]. 정확한 기전은 밝혀지지 않았으나 위산분비 억제로 인한 칼슘의 흡수 저하를 그 원인으로 생각한다[18]. 이는 위 내의 산성 환경이 양성자 펌프 억제제로 인해 pH가 증가하면서 섭취한 칼슘의 이온화를 조장하여 흡수가 저하되기 때문으로 설명한다[19].
양성자 펌프 억제제가 골밀도에 미치는 영향은 완전히 규명되어 있지 않다. 양성자 펌프 억제제를 7년 이상 복용했을 때 골다공증과 연관된 골절이 증가한다는 보고가 있었으나[20] 최근 Targownik 등에 의한 환자군-대조군 연구(case-control study)에서는 양성자 펌프 억제제가 골다공증이나 골밀도 감소 가속화와 관련이 없는 것으로 나타났다[21]. 그러나 아직도 골밀도에 대한 임상 연구는 부족하여 더 많은 연구가 필요한 상태이다. 한편, 골다공증에 대한 동물 실험 모델에 대해서는 생쥐 혹은 백서의 난소를 적출한 모델이 광범위하게 사용되고 있는데[16], 이는 난소 적출 후 생기는 골흡수가 인간과 유사하기 때문이며 난소 적출된 동물 개체의 경골, 대퇴골, 척추 등의 골밀도가 적출술 후에 민감하게 변화하기 때문이다[17]. 이번 실험은 난소 적출술을 시행한 생쥐의 경골을 이용하여 골밀도 및 중량을 측정하였으나 두 군 간의 유의한 차이를 보이지는 않았다. 그러나 DEXA를 통한 골밀도 측정은 이차원적인 골형태 분석의 한계를 가지고 있어 histomorphometry, micro CT (computed tomography) 등과 같은 골대사를 보다 잘 반영할 수 있는 검사를 추가로 시행해야 할 것으로 생각한다[22].
Osteocalcin과 CTX-1은 골교체를 반영하는 표지자로 알려져 있으며 임상적으로도 사용되고 있는 지표 중의 하나이다. Osteocalcin은 조골세포에서 생성되는 골형성의 표지자로서 ALP보다 더 민감한 것으로 알려져 있으며[23], 폐경 후의 여성에 있어서도 혈청 osteocalcin 수치는 골형성과 뚜렷한 상관관계를 나타낸다[24,25]. 한편, CTX-1은 폐경 전에는 뚜렷한 변화를 보이지 않으나 폐경기의 호르몬 변화를 겪는 여성 및 폐경 후의 여성에서 유의하게 상승하여[26,27] 폐경기 및 폐경 후 여성에 있어 골흡수로 인한 골다공증의 민감한 생화학적 표지자로 이용될 수 있으며 골다공증으로 인한 골절 위험을 평가하는데도 유용하다고 알려져 있다[28,29].
이번 연구에서는 양성자 펌프 억제제의 위에 기술한 골교체 표지자에 미치는 영향을 보고자 하였다. 골형성 표지자인 혈청 osteocalcin은 판토프라졸군에서 유의하게 감소하였으나 골흡수 표지자인 CTX-1은 두 군 간에 유의한 차이가 없었다. 두 가지 결과로 양성자 펌프 억제제가 골형성 혹은 골흡수에 어떠한 영향을 미친다는 정확한 결론을 추론하기는 어렵지만 양성자 펌프 억제제가 골교체에 영향을 미칠 수 있음을 시사하는 결과라 생각한다.
골다공증의 기전에 있어서 골흡수의 역할을 하는 파골세포의 분화, 활성화가 중요한 역할을 한다. 골다공증의 병리 기전을 설명하는데 있어서 receptor activator for nuclear factor κ B ligand (RANKL)과 osteoprotegerin (OPG)의 상호작용은 뼈의 재형성 및 흡수에 있어서 중요하며 여러 연구에서 두 지표의 비가 병적인 골절의 발생 위험인자임이 밝혀진 바 있다[30,31]. 파골세포가 활성화되기 위해서는 산성화가 요구되는데 과거의 연구에서 양성자 펌프 억제제가 파골세포의 활성화를 억제하여 골흡수를 억제함이 보고된 바 있어, 최근에 발표된 연구와는 다소 상반되는 결과를 보이고 있다[32]. 이에 양성자 펌프 억제제가 골다공증을 악화시키는 원인에 대한 규명이 요구되며 파골세포의 분화, 활성화와 관련된 RANKL, OPG 등의 세포신호 전달체계에 대한 연구가 필요하다. 이번 연구에서 양성자 펌프 억제제에 의한 골형성의 표지자인 osteocalcin의 억제가 관찰되어서 파골세포의 활성화보다는 골형성을 촉진하는 골아세포의 기능에 대한 추가연구가 양성자 펌프 억제제에 의한 골대사에 미치는 영향의 기전을 밝히는데 도움이 될 수 있을 것으로 생각한다. 또한 이번 연구에서 측정한 calcium 수치는 두 군 간에 통계적으로 유의한 차이가 없었는데, 이는 혈중 calcium 농도가 내외적 실험요인에도 불구하고 항상성을 유지하려는 속성 때문이라는 기존 연구와 유사한 결과라고 할 수 있겠다[33].
이번 연구에서는 골다공증과 관련된 proinflammtory cytokine에 미치는 영향을 알아보고자 비장 조직에서의 사이토카인의 발현 정도를 확인하였다. IL-1β의 mRNA 발현은 판토프라졸군에서 대조군에 비해 발현이 억제되는 경향을 보였고, IL-6나 TNF-α는 차이를 보이지 않았다. 비장에서 추출한 사이토카인의 발현이 정확한 골다공증과 관련된 기전을 설명하는지에 관해 논란이 있을 수 있지만, 양성자 펌프 억제제에 의해서 오히려 사이토카인 발현의 억제 소견이 관찰되어서 기존의 임상연구와는 다소 상반된 결과를 얻을 수 있었다. 이에 대한 추가 연구가 필요할 것으로 생각하며 정확한 연구를 위해서는 비장에서의 T 세포를 통한 파골세포의 일차배양을 이용하여 사이토카인의 발현에 관해 연구를 시행해야 할 것이다.
이번 연구의 제한점으로 표본의 수가 적고 골대사를 반영할 정도의 투약기간이 다소 짧다는 점이 있다. 그러나 4주간의 기간은 골변화 및 골대사를 확인하는데 충분한 기간이라고 생각하지는 않으나 생쥐의 평균 생존기간이 1년 정도인 점과 사람에 있어서 통상적인 양성자 펌프 억제제 투여 기간을 고려할 때 결과를 도출해 내는데 있어서 짧은 기간은 아니라고 생각한다. 양성자 펌프 억제제가 골대사에 미치는 영향의 기전을 규명하기 위해 향후 더 큰 규모의 in vitro의 실험을 포함한 추가 연구가 필요하다. 다른 제한점으로 이번 연구에서 DEXA를 이용하여 골밀도 분석을 시행하였는데 지주골의 미세형태변화를 평가하는데 더 정밀한 방법인 micro CT나 histomorphometry와 같은 방법을 이용한 추가 실험이 필요할 것으로 생각한다.
결론적으로, 난소 적출한 생쥐에서 양성자 펌프 억제제인 판토프라졸은 골형성 표지자인 osteocalcin을 감소시키고 골흡수에 영향을 미치는 사이토카인인 IL-1β의 발현을 억제하였으나 이것이 판토프라졸의 직접적인 영향인지 규명하기 위해서는 더 많은 개체수를 이용한 추가적인 연구가 필요할 것으로 생각한다.