안지오텐신 전환효소 억제제/안지오텐신 수용체 차단제 사용과 고칼륨혈증
Use of Angiotensin Converting Enzyme Inhibitors and Angiotensin Receptor Blockers: A Closer Look at Hyperkalemia
Article information
Trans Abstract
Therapeutic manipulation of the renin-angiotensin-aldosterone system (RAAS) is an important strategy for improving hypertension, diabetes, cardiovascular disease, and chronic kidney disease. Development of hyperkalemia after the administration of RAAS inhibitors is of particular concern because patients at highest risk for this complication are often the same patients who derive the greatest cardiovascular or renoprotective benefit. Based on an overview of the incidence of hyperkalemia during treatment with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers alone and in combination, this review suggests approaches for monitoring, detecting, and managing hyperkalemia in patients treated with RAAS inhibitors. Although the incidence of hyperkalemia with RAAS inhibitors is generally low, hyperkalemia can be associated with increased mortality. When using RAAS inhibitors, it is important to monitor on-treatment electrolyte levels and renal function parameters in patients with a high risk for hyperkalemia. (Korean J Med 2011;80:20-30)
서 론
레닌-안지오텐신-알도스테론 계(renin-angiotensin-aldosterone system, RAAS)는 체액, 혈압 및 심혈관계 조절에 있어 중요한 역할을 한다. 그렇지만 현대인에 있어 과도하게 발현되는 RAAS는 고혈압, 심혈관 질환, 당뇨병 그리고 만성콩팥병(chronic kidney disease) 치료의 주된 목표가 되고 있다. 또한 전 세계적으로 꾸준히 증가하고 있는 비만, 과체중 혹은 대사 증후군(metabolic syndrome)도 RAAS를 자극하는 것으로 알려져 있으며 따라서 이들 질환에서도 RAAS를 억제함으로써 표적 장기 손상을 예방할 수 있다는 것이 잘 알려져 있다[1-3]. 안지오텐신 전환효소 억제제(angiotensin converting enzyme inhibitor, ACEi), 안지오텐신 수용체 차단제(angiotensin receptor blocker, ARB), 알도스테론 수용체 길항제(aldosterone receptor antagonist) 그리고 우리나라에서도 시판될 직접적 레닌 억제제(direct renin inhibitor)가 전 세계적으로 널리 쓰이고 있는 RAAS 억제제들이다. 안타깝게도 고혈압이나 표적 장기 보호치료 목적으로 사용되어야 하는 RAAS 억제제들은 혈청 칼륨(potassium)의 상승 위험도가 높을 것으로 예상되는 질환자들에서 제한되는 경우가 많으며 때로는 그러한 고칼륨혈증발생 가능성에 대한 과장된 우려 때문에 RAAS 억제를 통하여 얻는 이득을 놓치는 경우가 종종 있다[1,4].
고칼륨혈증의 발생 기전과 위험인자
위에서 언급했듯이 많은 임상적인 유용성 및 중요성에도 불구하고 이들 RAAS 억제제들 사용 시 나타날 수 있는 부작용으로 인하여 그 투여의 제한이 있을 수 있는데 대표적인 부작용이 바로 고칼륨혈증이다[1,5]. 이들 RAAS 억제제들 중에서 ACEi, ARB 그리고 직접적 레닌 억제제는 부신에서 안지오텐신 II에 의해 매개되는 알도스테론의 분비를 억제 하거나 경우에 따라서는 신혈류의 감소와 사구체여과율(glomerular filtration rate, GFR)을 저하시킴으로써 고칼륨혈증을 일으키는 것으로 알려져 있다. 알도스테론 수용체 길항제는 알도스테론과 알도스테론 수용체 간의 결합을 차단시킴으로써 세뇨관으로의 칼륨 배설을 억제하여 고칼륨혈증을 일으킨다.
환자의 기저 질환 특성이 고칼륨혈증 발생에 기여할 수도 있다. 일반적으로 신기능 저하가 일어나면 위장관으로의 칼륨 배설을 증가시키는 일종의 보상 작용이 일어나기는 하지만 칼륨 배설의 주된 경로는 신장이기 때문에 특히 5기 만성콩팥병, 즉 말기신부전(말기콩팥병) 환자들에서는 고칼륨혈증이 매우 흔할 수밖에 없다. 또 최근 몇 년 사이에 심신성 증후군(cardiorenal syndrome)의 개념이 정립되고 있는데 실제로 울혈성 심부전 환자의 약 절반 가량은 신기능 저하를 보이고 있어 이들 역시 고칼륨혈증의 위험도가 높아질 수밖에 없다[6]. 또한 심부전 상태에서는 심박출량 저하, 저염식이 경향 그리고 전신 RAAS 활성화 등과 연관되어 원위집합관에서의 나트륨 농도 저하와 더불어 여러 가지 알도스테론 효과를 억제시키는 약제들의 투여가 많이 이루어지기 때문에 고칼륨혈증의 빈도가 높아진다[7]. 이러한 기저 질환들 자체가 고칼륨혈증 발생의 가능성이 높은데다가 RAAS 억제제를 투여하게 되면 고칼륨혈증의 가능성은 보다 상승하게 된다. 당뇨병에서는 인슐린 결핍 상황이 혈장에서 세포내로의 칼륨 이동을 제한시킴으로써 혈청 칼륨의 상승을 유발할 가능성이 높다[8]. 또한 레닌 분비 장애가 일어나 알도스테론 수치 저하가 발생하게 되면 저레닌성 저알도스테론혈증으로 인하여 고칼륨혈증의 발생 가능성이 있으며 여기에 해당하는 질환에는 당뇨병성 신병증과 간질성 신염 등이 속하고 이와 같은 저레닌성 저알도스테론혈증과 비슷한 상황이 일어날 수 있는 질환에는 신이식 상태, 루푸스 신염, 유전분증(amyloidosis), 요관 폐색, 그리고 겸상 적혈구병(sickle cell disease) 등이 있다[9].
또한 RAAS 억제제들 외에도 많은 약물들이 고칼륨혈증 발생에 관여하는 것으로 알려져 있다(표 1). 비스테로이드성 항염증 약물(nonsteroidal anti-inflammatory drugs, NSAIDs), 베타 차단제, 헤파린 그리고 calcineurin 억제제들이 대표적이다[4]. NSAIDs는 프로스타글란딘 합성 억제제로서 작용하고 신혈류에 영향을 줄 수 있는데 저레닌성 저알도스테론혈증을 유발하여 고칼륨혈증과 대사성 산증을 발생시킨다[10]. 항생제 중에서는 trimethoprim-sulfamethoxazole이 대표적인데 trimethoprim이 ACEi 혹은 ARB 복용 환자들에게서 고칼륨혈증을 일으키는 기전은 원위 세뇨관에 있는 내강 쪽 나트륨 통로에 대해서 amiloride와 유사한 억제력을 발휘하기 때문으로 생각된다[11]. 이로 인하여 나트륨 재흡수와 칼륨 배설이 억제되어, 혈청 칼륨의 상승 가능성이 높은 환자들에게 임상적으로 유의한 고칼륨혈증을 일으키는 것이다.
전 세계적으로 평균 기대 수명의 증가로 인하여 65세 이상의 노인 인구가 증가하고 있다는 사실도 주목할 필요가 있다. 상당히 많은 노인 인구에서 여러 가지의 기저 질환, 즉 고혈압, 당뇨병 그리고 만성콩팥병을 가지고 있다고 알려져 있으며 만성콩팥병의 경우 노인 인구에서 약 30%의 유병률을 보인다고 보고되고 있다[12]. 혈장 레닌 활성도와 혈장 알도스테론 농도는 노화에 따라 감소한다고 알려져 있고, 특히 사구체여과율이 노화와 관련하여 저하되어 있으므로 노인 인구에서의 고칼륨혈증 발생 위험도는 높아지게 된다[12]. 뿐만 아니라 여러 가지 퇴행성 근골격계 질환의 높은 유병률로 인하여 NSAIDs의 복용이 증가한다. 따라서 이러한 여러 가지 위험인자들이 존재하는 노인 인구에서 RAAS 억제제를 사용하게 되면 고칼륨혈증 발생 가능성을 더욱 높일 수 있는 것이다.
기저 질환과 용법에 따른 고칼륨혈증 발생의 차이
1. 고혈압
RAAS 억제제들마다 각각 다른 방식으로 칼륨 항상성에 영향을 주어 결과적으로 혈장 칼륨 수치도 다르게 반응할 수 있을 것으로 예상되었지만 실제 임상 시험에서는 큰 차이가 없는 것으로 보고되었다. 일반적으로 단순 고혈압 환자들에서 ACEi 혹은 ARB를 단독으로 사용하였을 때 고칼륨혈증의 발생 빈도는 2% 이내로서 매우 낮은 편이며 혈장 칼륨 수치의 상승 정도는 대개 0.1 mmol/L로 보고되어 임상적으로 볼 때 큰 의미를 두기 어려운 것으로 보고되고 있다. ACEi인 lisinopril 20 mg을 매일 경구투여하여 8주간 경과 관찰한 연구에서 혈장 칼륨의 상승 정도는 0.2 mmol/L에 불과하였다[13]. ACEi를 복용하는 1,818명의 외래 환자들을 52주간 추적관찰한 결과에서도 혈장 칼륨 5.5 mmol/L 이상으로 상승한 빈도는 2%였다. 이 연구에서는 captopril, enalapril, lisinopril이 사용되었는데 비교적 지속형 ACEi인 lisinopril과 enalapril이 고칼륨혈증 빈도가 조금 더 높은 것으로 보고되었다[14].
고혈압 환자들에서 ARB 단독 사용으로 인한 고칼륨혈증의 경우도 ACEi의 경우와 크게 다르지 않은 것으로 보인다. 2,085명의 고혈압 환자들을 대상으로 8주에서 12주간 시행한 무작위 이중맹검 임상시험한 결과, losartan을 투여한 군에 있어서 혈장 칼륨 5.5 mmol/L 이상이었던 경우는 1.5%로서 ACEi 투여군의 1.3%에 비해 큰 차이는 없었다[15]. 3,095명의 고혈압 환자들을 대상으로 6주에서 52주 동안 olmesartan을 투여한 임상 시험에서도 역시 위약군에 비하여 고칼륨혈증의 빈도는 유의한 차이를 보이지 않았다[16]. 818명의 고혈압 환자들을 대상으로 한 임상시험에서도 telmisartan 단독투여군에서 혈장 칼륨 수치가 다소 올라가기는 하였으나 용량-반응 효과는 보이지 않았다[17].
고혈압 환자들에서 ACEi와 ARB를 동시 사용하였을 시 고칼륨혈증의 빈도는 한 종류의 RAAS 차단제 사용 시보다는 조금 더 높은 것으로 보인다. 1,096명의 고혈압 환자들을 대상으로 한 A Multicenter Trial Using Atacand and Zestril vs. Zestril to Evaluate the Effects on Lowering Blood Pressure(AMAZE) 연구에서는 고칼륨혈증으로 인하여 약제를 중단한 빈도가 lisinopril과 candesartan 병용 투여군에서는 0.7%, lisinopril 단독 투여군에서는 0%였다고 보고하였다. 그러나 병용 투여군이나 단독 투여군 모두에서 고칼륨혈증이 직접적으로 임상적인 악영향을 끼치지는 않았다[18]. 고위험도의 심혈관계 위험인자들을 가진 25,577명을 대상으로 한 Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial (ONTARGET) 연구에서는 5.5 mmol/L 이상의 고칼륨혈증 발생은 ramipril 단독 투여군 283명, telmisartan 287명에 비해 telmisartan과 ramipiril 동시 투여 시 480명의 환자에서 나타났으며 병용 요법 시 ramipril 단독 투여 시보다 유의하게 혈장 칼륨이 상승하는 것으로 보고되었다[19].
2. 당뇨병
고혈압이 동반된 당뇨병 환자들에서 ACEi와 ARB 사용은 미세알부민뇨에서 현성단백뇨로의 진행을 억제하는 것으로 이미 잘 알려져 있다. 뿐만 아니라 이미 현성단백뇨를 보이는 당뇨병 환자들에서 ACEi와 ARB는 항고혈압 효과에 독립적으로 단백뇨를 줄이는 효과를 발휘하고 신기능 저하 속도를 늦추는 것이 여러 임상 연구들을 통하여 증명되었다[20]. 인구 증가, 과체중 및 비만의 높은 유병률 그리고 노인 인구의 증가는 결국 당뇨병 환자의 증가로 이어질 수밖에 없으며 잘 알려진 바와 같이 당뇨병은 만성콩팥병 및 말기콩팥병의 가장 흔한 원인이 되므로 향후 적극적인 RAAS 차단제 사용은 점차 늘 수밖에 없다.
당뇨병 환자들에서 ACEi 혹은 ARB를 사용하게 되면 고칼륨혈증의 발생 가능성은 어느 정도 될 것인가? 비교적 초기임상 시험 결과에 따르면, 하루 500 mg 이상의 단백뇨를 보이면서 혈청 크레아티닌 2.5 mg/dL 이하인 인슐린 의존성 당뇨병 환자들을 대상으로 한 연구에서 captopril 사용군 207명 중에서 혈장 칼륨 6.0 mmol/L 이상으로 상승된 환자가 3명 발생한 반면 위약군 202명에서는 고칼륨혈증이 발생하지 않았다[21]. 제2형 당뇨병 환자 1,513명을 대상으로 ARB 효과를 알아본 Reduction of Endpoints in NIDDM with Angiotensin II Antagonist Losartan (RENAAL) 연구에서는 소변 알부민 대크레아티닌 비율 300 이상인 경우와 혈청 크레아티닌 1.3에서 3.0 mg/dL를 신병증으로 정의하였는데 정확한 수치 언급은 없었으나 심각한 임상적 유해를 일으킬 만한 전해질 변화는 없었던 것으로 보인다[22]. 같은 시기에 발표된 Irbesartan Diabetic Nephropathy Trial (IDNT) 연구 결과에 따르면, 고혈압이 동반된 당뇨병성 신병증(단백뇨 하루 900 mg 이상 그리고 혈청 크레아티닌은 남자의 경우 1.2~3.0 mg/dL 그리고 여자의 경우 1.0~3.0 mg/dL) 환자 1,715명을 대상으로 irbesartan 하루 300 mg과 amlodipine 10 mg을 각각 투여하였더니 고칼륨혈증으로 인하여 약제 투여 중단하였던 빈도가 irbesartan 군에서 1.9%로서 amlodipine군의 0.5%과 위약군의 0.4%보다는 유의하게 높았다[23].
앞서 언급한 대로 RAAS에 대한 단일 억제제 투여는 불완전한 RAAS 차단이 이루어지기 때문에 당뇨병성 신병증 환자들에서의 병용 투여는 계속 시도되어 왔다. 한 메타 분석 결과에 의하면 ACEi와 ARB 병용 투여로 인한 혈청 칼륨상승 정도는 평균 0.2 mmol/L로 보고되었다[24]. 병용 억제로 인한 혈청 칼륨의 상승은 통계적으로 유의하였으나 임상적으로 큰 의미는 두기 어려운 것으로 판단하였다. 고혈압, 미세알부민뇨 및 당뇨병을 가지고 있는 199명의 환자들을 대상으로 candesartan 하루 16 mg 및 lisinopril 하루 20 mg을 각각 단독 투여 혹은 병용 요법으로 투여한 결과, 병용 투여한 군에서 혈청 칼륨이 약 0.3 mmol/L 상승하여 유의한 변화를 보였으나 임상적인 조치가 필요할 정도는 아니었다고 보고하였다[25].
3. 신장 질환
대표적인 비당뇨병성 신장 질환으로서 사구체신염 환자들에서도 RAAS 차단제가 많이 사용되고 있다. 14명의 막성사구체신염 환자들을 대상으로 ramipiril 하루 2.5 내지 20 mg을 2개월간 투여한 결과 혈청 칼륨 6.0 mmol/L 이상인 고칼륨혈증 발생으로 인하여 투약을 중단한 경우는 없었다[26]. 병리 조직 검사로 확인되지 않았으나 하루 500 mg의 단백뇨를 보이면서 크레아티닌 청소율 20 mL/min/1.73 m2 미만이 아닌 비당뇨병성 만성콩팥병 성인 환자 16명 환자들에게 telmisartan 하루 80 mg씩 4.8±2.7개월 동안 투여하였을 때도 혈청 칼륨 6.0 mmol/L 이상의 고칼륨혈증은 전혀 발생하지 않았다고 보고하였다[27].
신기능이 비교적 보존되어 있는 신장 질환들에서의 RAAS 차단제 사용은 큰 문제가 되지 않는 것으로 보고되고 있지만 심각한 신기능 저하를 보이는 만성콩팥병 내지 말기신부전 환자에서의 RAAS 차단제 사용 시 안정성 여부는 항상 관심거리가 될 수밖에 없다. 그렇지만 혈청 칼륨 수치의 상승 가능성이 높을 것이라고 예상되었던 만성콩팥병 환자들에 대한 임상 시험 결과들을 보면 혈청 칼륨의 평균 상승 정도는 0.3 mmol/L 이하이며 고칼륨혈증으로 인한 임상적인 유해한 결과를 초래하거나 투약 중단을 한 경우는 의외로 낮아 약 1~2%에 불과하다[4,5]. 혈청 크레아티닌 1.5~5.0 mg/dL 그리고 크레아티닌 청소율 20~70 mL/min/1.73 m2를 보이는 비당뇨병성 단백뇨 환자 422명을 대상으로 ACEi인 benazepril 투여 효과를 알아본 연구 결과를 보면, 혈청 크레아티닌 3.1~5.0 mg/dL인 환자들에게 benazepril을 투여하였더니 혈청 칼륨 6.0 mmol/L 이상의 고칼륨혈증 발생이 11명(5%)에서 나타났고, 이 중 8명은 식이 조절, 이뇨제 동시 투여 그리고 산염기 평형 유지 등을 통하여 칼륨이 안정되었으나 나머지 3명이 임상 시험에서 탈락되었다. 비록 ACEi 투여군에서 위약군에 비해 혈청 칼륨 수치가 유의하게 높았으나 그 차이는 0.5 mmol/L 이상을 초과하지는 않았으며 전체적인 고칼륨혈증 발생 빈도는 ACEi 투여군과 위약 투여군 모두 비슷하였다[4]. 혈청 크레아티닌 1.5~3.0 mg/dL를 보이는 환자들에서는 고칼륨혈증의 발생 빈도가 보다 더 낮았다.
그렇다면 신기능 저하 환자들에서 RAAS 억제제 간에 고칼륨혈증 발생 빈도가 차이가 있는 것일까? 고혈압이 있으면서 크레아티닌 청소율 30~80 mL/min인 35명의 만성콩팥병 환자들을 대상으로 ARB인 valsartan 하루 80 mg과 ACEi인 lisinopril 하루 10 mg을 2군으로 나누어 투여한 결과 전체적으로 유의한 혈청 칼륨 상승은 없었다. 그렇지만 사구체여과율 60 mL/min/1.73 m2 이하인 대상자들을 따로 분석해 보면 lisinopril 투여군에서는 투여 전 평균 혈청 칼륨 4.6 mEq/L에 서 10주간 투여 후 약 0.28 mEq/L의 유의한 칼륨 상승이 있었던 반면, valsartan 경우에는 투여 전 평균 혈청 칼륨 4.5 mEq/L에서 약 0.12 mEq/L 정도의 상승을 보여 큰 차이가 없었으며 lisinopril 투여군과 비교해 보면 혈청 칼륨이 최종적으로 약 43%가 더 낮았다[28]. 이것은 valsartan 투여군에서 혈장 알도스테론 수치가 lisinopril 투여군에서보다 상대적으로 덜 저하된 사실과 관련되지 않을까 추정되지만 실제 전신 RAAS 활성 정도와 콩팥 내 RAAS 활성 정도는 다르게 나타날 수 있어 혈청 칼륨 농도의 차이가 발생하는 기전을 설명하기에는 부족하고 더욱이 대상 환자수가 적었기 때문에 RAAS 억제제들 상호간에 절대적인 비교는 하기 어렵다. 결론적으로 볼 때 일반적으로 예상되는 것에 비해 제 4기 만성콩팥병 환자들에서조차 RAAS 차단제 사용 시 임상적으로 유의한 고칼륨혈증의 발생 빈도는 예상보다 그리 높지 않다.
RAAS 억제제 2종류의 병용 투여는 분명 고칼륨혈증을 보다 높일 것으로 예상할 수 있다. 그러나 메타 분석에 따르면 혈청 칼륨의 증가는 0.5 mmol/L 이하이며, 병용 투여의 중단이 필요할 정도의 고칼륨혈증의 발생 빈도는 5% 이내인 것으로 알려져 있다[5]. 비당뇨병성 단백뇨 질환 및 당뇨병성 신병증에 대한 임상 연구들을 종합하여 시행한 메타 분석보고에 따르면 ARB와 ACEi 병용 투여 시 혈청 칼륨이 평균 0.11 mEq/L의 유의한 상승을 일으키는 것으로 알려졌다[29].
결국 만성콩팥병 환자들에서 단순히 신기능 저하 소견만으로 RAAS 억제제를 사용하지 않는 것은 RAAS를 차단시킴으로써 환자들에게 주어질 수 있는 심혈관계 이득 및 신장보호 효과의 기회를 빼앗아 버리는 경우가 될 수 있으므로 여러 가지 처치를 통하여 고칼륨혈증을 최소화시키도록 노력해야 한다[9].
4. 심장 질환
심부전 환자들에서 ACEi나 ARB 단독 투여 역시 혈청 칼륨의 상승을 유발할 수 있다. 그렇지만 임상적으로 볼 때 혈청 칼륨 6.0 mEq/L 이상의 유의한 고칼륨혈증의 발생 빈도는 2% 이내로 비교적 낮은 편이다. 비교적 초창기 연구인 Cooperative North Scandinavian Enalapril Survival Study(CONSENSUS) 결과에 의하면, 울혈성 심부전 환자들에서 enalapril 5~20 mg을 하루 2회 투여한 결과 혈청 칼륨 5.5 mmol/L 이상으로 상승하였던 경우가 7.1%로서 위약군 4%보다는 많았다[30]. 또한 65세 이상의 심부전(NYHA II-IV) 환자 722명을 대상으로 무작위로 losaratn 하루 50 mg 혹은 captopril 50 mg씩 하루 3회 투여를 48주 동안 시행한 결과, 두 약제 투여군 모두 고칼륨혈증으로 인하여 약제를 중단하는 경우는 드물었다. 약제 투여 전 모든 환자들의 혈청 크레아티닌은 2.5 mg/dL 이하였으며 혈청 칼륨 3.5 이하 혹은 5.5 mmol/L 이상인 경우는 배제하였는데 약제 투여 후의 혈청 칼륨이 투여 전 수치와 비교하여 0.5 mmol/L 이상 상승이 지속되는 경우는 losartan 투여군에서 18.8% 그리고 captopril 투여군에서 22.7%로서 losartan 투여군에서 다소 적은 편이었으나 유의한 차이는 아니었다(p=0.069)[31].
그러나 좀 더 오랜 기간 추적하게 되면 조금 다른 결과를 나타내는 것으로 보인다. 2,028명의 심부전 환자들을 대상으로 candesartan을 투여하여 평균 33.7개월을 추적한 Candesartan in Heart failure: Assessment of Reduction in Mortality and morbdity (CHARM) 연구 결과 고칼륨혈증으로 약제 중단하게 되는 경우는 1.9%로서 위약군 0.3%보다 유의하게 높았고 혈청 칼륨 6.0 mmol/L 이상 되는 경우도 역시 candesartan 투여군에서 많았다[32]. 초기 6개월까지는 혈청 칼륨 6.0 mmol/L 이상의 고칼륨혈증 발생 정도가 candesratan 투여 군에서 3% 그리고 위약군 1.3%로서 두 군 간에 차이 없었던 것으로 보아 투약 기간이 길어짐에 따라 고칼륨혈증 발생 가능성이 높아지는 것으로 생각된다. 또한 이 CHARM 데이터를 사후 분석을 한 결과, 임상적으로 유의한 고칼륨혈증 즉, 치명적인 고칼륨혈증 또는 용량 조절, 시험 중단 혹은 입원 치료가 필요한 고칼륨혈증의 빈도가 candesartan의 경우가 4.0%로서 위약군 1.5%보다 유의하게 높았다[33].
위와 같이 RAAS 억제제 단독 투여 시 고칼륨혈증 발생률은 낮지만 발생 가능성은 투여 기간 내내 존재하는 것은 사실이다 그럼에도 불구하고 만성 심부전 환자들에게 ACEi 외에 ARB를 추가 투여를 시도하는 것은 RAAS의 신경호르몬 활성도(neurohormonal activity)를 억제함으로써 추가적인 이득을 얻기 위함이다. 예상외로 RAAS 억제제 병용 투여 시혈청 칼륨의 상승 정도는 비교적 낮은 편이며(약 0.1~0.3 mmol/L), 고칼륨혈증으로 인하여 약제 중단하게 되는 경우는 1% 이내로 보고되고 있다[5]. 여러 임상 시험들의 메타분석에 따르면 만성 심부전 환자들을 대상으로 수행한 ARB와 ACEi 병용 요법이 대조군에 비하여 혈청 칼륨 5.5 mEq/L 이상의 고칼륨혈증 발생 위험도를 유의하게 높인다고 하였다[34]. 비록 유의한 정도는 아니지만 급성심근경색과 함께 좌심실 기능 장애가 동반된 환자들에서도 고칼륨혈증의 위험도가 증가한다고 하였다. 각각의 연구 결과를 따로 파악해보면, CHARM-Added trial에서는 ACEi를 복용해오던 2,548명의 심부전 환자들을 대상으로 하였고, 이 중 1,276명 환자들에게 candesartan을 추가 투여한 결과 3.4%의 환자들에서 고칼륨혈증이 발생하였고, 이는 대조군, 즉 ACEi 단독 투여군에 비하여 유의하게 높았다[35]. 마찬가지로 추후에 시행된 사후 분석에서도 ACEi에 candesartan을 추가하게 되면 치명적인 고칼륨혈증과 투여 용량 감량, 투여 중단 또는 입원을 필요로 하는 고칼륨혈증의 빈도가 2.9%에서 8.4%로 유의하게 증가된다는 결론이 나왔다[33]. 그렇지만 혈청 크레아티닌 2.0 mg/dL 이상인 만성콩팥병 환자들처럼 고칼륨혈증의 발생 위험도가 높은 환자들에서 ACEi와 candesartan 병용사용은 심혈관계 사망과 입원율을 낮춘다는 결론을 보이기 때문에 임상적인 유용성은 있는 것으로 생각되었다. 이미 대부분 ACEi를 복용하고 있던 5,010명의 심부전 환자들에게 valsartan 160 mg을 하루 2회 추가 투여하였던 Valsartan heart Failure Trial (Val-HeFT) 연구에서도 valsartan 투여군에서 혈청 칼륨 수치가 약 0.12 mmol/L 상승하여 위약군에서의 0.07 mmol/L 감소한 것에 비해 유의하게 상승하였다[36]. 14,703명의 급성심근경색 환자들을 대상으로 valsartan 혹은 captopril 단독 투여 혹은 동시 투여를 하였던 Valsartan in Acute Myocardial Infarction (VALIANT) 연구에서는 단독 투여 혹은 병용 투여 군 사이에 고칼륨혈증의 발생 차이는 없었다[37].
심부전에서 ACEi에 ARB를 추가 투여함으로써 얻는 이득이 부작용들보다 상회할 것인가에 대해서는 아직 논란의 여지가 있다. 개개의 임상 시험 결과와 달리, 총 18,061명이 포함된 8개 임상 시험들의 메타분석 결과에 따르면 병용 투여가 실제 심혈관계 이득은 많지 않고 오히려 신기능 악화와 증상이 동반되는 저혈압을 비롯하여 고칼륨혈증 발생의 부작용 발생 빈도를 유의하게 높였다는 보고가 있다[38].
고칼륨혈증 발생 위험도에 대한 해석
앞서 언급되었듯이 여러 대규모 임상 시험 결과들에 따르면, RAAS 억제제 단독 투여 사용에 의한 경우 다른 개입 요소만 없다면 혈청 칼륨 5.5 mmol/L 이상으로 상승될 위험도는 약 2% 이내로서 낮은 편이다(표 2). RAAS 억제제들을 병용 투여하게 되면 고칼륨혈증의 위험도가 약 5% 정도까지 올라가며 심부전이나 만성콩팥병과 같이 기저 질환 자체가 위험 요소로 작용하는 경우에는 고칼륨혈증 빈도가 5~10%까지 상승하게 된다. 그러나 혈청 칼륨 농도가 상승되는 절대 수치값은 대개 0.3 mmol/L에 불과하여 이 정도의 상승 수준이 임상적으로 의미가 있다고 보아야 할지는 의문이다[5].

Incidence of hyperkalemia in patients treated with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers
그러나 정말 여태까지 발표된 임상 연구들의 결과들을 액면 그대로 받아들여야 할 것인가? 현재까지 많은 임상 시험들의 결과들은 임상의들에게 진료 지침을 위한 많은 자료와 근거들을 제공해온 것은 사실이다. 그렇지만 대상 환자 선택이나 추적 관리에 있어 철저하고 집중된 체계 속에서 수행된 임상 연구들의 결과 그대로 실제 임상 현장에서도 적용하기에는 무리가 있다. 실제로 많은 임상 연구들은 신기능장애가 심하거나 혈청 칼륨 수치가 비교적 높은 환자들을 처음부터 배제시켜 연구를 진행해 왔다[39]. 더욱이 대개의 임상 시험에서는 추적 생화학검사를 적극적으로 시행하였기 때문에 고칼륨혈증과 같은 전해질 이상을 보다 빨리 감지하고 조치를 할 수 있었다. 그러나 일선 진료 현장 특히 종합병원급이 아닌 일반 개원가에서 검사를 자주 하기 어려운것이 현실이다.
또 하나 고려해야 할 점은 바로 많은 임상 시험 결과들이 주장하듯이 RAAS 억제제 단독 투여뿐 아니라 2제 이상의 병용 투여 요법이 임상적인 이득이 크고 그에 비해 고칼륨혈증과 같은 부작용 빈도가 비교적 낮고 발생하더라도 임상적으로 의미 있는 경우는 정말 적은 것인가에 대한 것이다. 해석하기 어려운 점이 있기는 하지만 결국 비교적 최근에 발표된 ONTARGET 등의 대규모 임상 시험 결과로부터의 교훈은 RAAS 억제제 병용 요법을 시행할 경우 신기능과 더불어 전해질 수치에 대한 적극적인 감시를 해야 한다는 것이다[1,5].
RAAS 억제제 사용에 따른 고칼륨혈증 관리
우선 임상적으로 의미있는 고칼륨혈증이라 할 수 있는 혈청 칼륨의 수치를 정의할 필요가 있다. 기관이나 병원마다 설정 범위가 다르기는 하지만 혈청 칼륨의 상한치는 대개 5.0~5.1 mEq/L로 되어 있다. 대개의 임상 시험에서 임상적으로 유의한 고칼륨혈증의 범위를 5.5 내지 6.0 mEq/L로 보고있는데 이들 연구에서는 잦은 검사가 가능하였기 때문에 당수의 경우 RAAS 억제제 중단 없이 칼륨 저하 치료를 병행하여 조절을 시도하였다. 그렇지만 잦은 검사 처방이 쉽지않고 빠른 결과 보고를 얻기 어려우며 게다가 추적검사에 대한 환자 이해도 및 순응도가 뒷받침해주기 어려운 실제 임상 현장에서는 임상적으로 유의한 고칼륨혈증의 정의를 높게 잡기에는 무리가 있다. 따라서 추적검사의 제한이 있을 시에는 혈청 칼륨의 일반적인 상한치인 5.0 mEq/L을 기준으로 하여 조치를 취하는 것이 좋겠다. 또한 혈청 칼륨의 절대적인 수치 상승 정도 외에도 얼마나 빠르게 상승하였는지도 중요한데 이러한 경우 심전도 변화 유무를 알아보는 것이 중요하다.
사실 혈액 검사에서 고칼륨혈증이 보이면 가장 먼저 확인해야 할 일은 아마도 환자 혈액 검체의 용혈 여부일 것이다. 채혈 과정이나 혹은 검체 수송 과정에서 문제가 발생할 수 있는데 채혈 중 주먹을 너무 꽉 쥐거나 지혈대(tourniquet) 적용 혹은 너무 가느다란 주사 바늘을 사용할 때 나타나며 어떤 검체 튜브의 경우 potassium ethylenediaminetetraacetic acid (EDTA)로 인하여 가성고칼륨혈증(pseudohyperkalemia)으로 나타나기도 한다[9].
RAAS 억제제 사용에 있어 가장 먼저 해야 할 일은 역시 대상 환자의 병력 청취를 통한 기저 질환의 파악 및 신기능 상태 평가이다. 정상 신기능을 가진 단순 고혈압 환자에서 고칼륨혈증의 빈도는 앞서 언급한 대로 낮지만 만약 발생한다면 환자의 식이 상태 및 NSAIDs와 같은 타 약제 복용력을 확인해야 한다. 재확인한 결과 고칼륨혈증이 맞다면 저칼륨식이 및 NSAIDs 등 관련 약제의 중단을 해야 하며 대개 이런 식으로 조절되는 경우가 많다. 큰 변화가 없는 한 6개월마다 추적검사를 하는 것이 좋겠다[5].
심부전 환자 혹은 사구체여과율이 감소된 신기능 장애 환자에서는 고칼륨혈증 가능성이 보다 높으므로 복용 시작 전 환자에게 식이 교육 및 피해야 할 약제에 대한 설명이 선행되어야 한다. 그렇다면 식이 교육은 어떻게 해야 하는가? 사실 정상적인 신기능과 부신기능을 가진 사람에게서 고칼륨 함유 음식을 많이 섭취하였다고 해서 고칼륨혈증이 발생하기는 어렵다. 반면에 신기능 장애가 있는 경우에서는 고칼륨식이와 관련하여 고칼륨혈증이 쉽게 발생할 수 있다. 오렌지나 귤 주스 혹은 멜론 같은 과일 및 야채 그리고 요즈음 흔히 쓰이고 있는 나트륨 대체제가 주된 칼륨 공급 경로로 잘 알려져 있으며 그 외에도 일반적으로 잘 알려지지 않은 식품에도 상당한 양의 칼륨이 포함되는 것으로 알려져 있어 주의가 필요한데, 예를 들어 면역 강화의 목적으로 복용되는 노니(noni) 주스 등이 있다[9]. 더 좋은 방법은 영양사를 통한 영양 상담이 되겠지만 일반적인 진료 현장에서는 시행하기 어렵다.
만성콩팥병 4기 내지 5기와 같이 심각한 신기능 저하가 있는 경우는 칼륨 상승에 대한 주의가 더더욱 필요하다. RAAS 억제제마다 신장 배설 정도가 약간씩 차이가 나므로 용량 조절이 필요하며 칼륨 배설을 유도하기 위해 처음부터 루프 이뇨제를 병용 투여하는 것도 좋겠다. 경우에 따라서는 polystyrene sulfonate와 같은 칼륨 결합 수지(potassium-binding resin)를 고려할 수 있다. 다만 칼륨 결합 수지의 투여는 환자에 따라 약물 순응도가 떨어져 실제 복용 여부를 중간에 확인해야 한다. 산증 교정이나 저레닌성 저알도스테론혈증 치료를 위해 탄산수소 나트륨(sodium bicarbonate)이나 플루드로코르티손(fludrocortisone)을 투여할 수도 있다. 그렇지만 오히려 체액 과다와 같은 문제를 일으킬 수 있으며 특히 플루드로코르티손의 경우 콩팥 질환을 악화시킬 가능성도 있으므로 실제 임상에서 추천되기 어렵다. RAAS 억제제를 새로이 투여하거나 변경한 경우 1~2주 후에 전해질 및 신기능 평가를 해야 하며 수 주마다 크레아티닌 및 전해질 수치 검사를 하여 약물 처방을 조정할 필요가 있다.
처음부터 고용량의 RAAS 억제제를 사용하기보다는 혈청 칼륨을 검사하면서 초기에는 저용량으로 시작하여 용량을 순차적으로 증량하는 것이 추천된다[9]. 임상적으로 2제 이상의 RAAS 억제제 투여가 필요한 경우에서도 처음부터 동시 투여보다는 단독 투여 후 경과를 보면서 병용 투여를 고려하고 고칼륨혈증 발생 가능성에 대한 추적관리를 강화하여야 한다. 만약 약제 투여 후 혈청 칼륨이 정상 범위의 상한선을 넘었지만 임상적으로 유해성을 아직 보이지 않은 수준, 예를 들어 혈청 칼륨 5.5 mEq/L 이하인 경우에는 어떻게 해야 하는가? 만약 고용량을 사용하고 있었다면 용량을 감량해보고 2제 이상의 병용 요법 시 1개 약제씩 중단하게 되면 혈청 칼륨 수치가 회복될 수 있다. 또한 앞서 언급한대로 고칼륨혈증에 기여할 만한 다른 요소들이 있는지 확인하여 교정해보고 그래도 조절이 안된다면 모든 RAAS 억제제들을 중단해야 한다. 이와 같은 내용을 정리하면 그림 1과 같다.
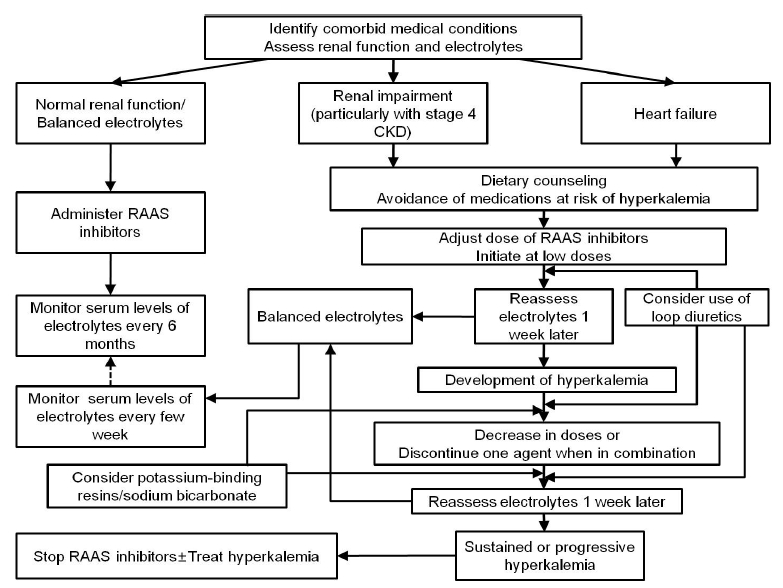
Approach to monitoring, detecting, and managing hyperkalemia in patients treated with renin-angiotensin system blockers. CKD, chronic kidney disease; RAAS, renin-angiotensin-aldosterone system.
만약 조절되지 않거나 임상적인 유해성을 일으키는 고칼륨혈증으로 RAAS 억제제를 중단한 이후에는 어떻게 해야할 것인가? 대개 혈청 칼륨 6.0 mEq/L 이상이거나 심전도 변화가 있다면 즉각적인 칼륨 저하를 위한 치료가 들어가야겠지만 그렇지 않은 경우에는 RAAS 억제제 및 칼륨 상승을 유발할 수 있는 약제를 중단하고 저칼륨식이를 하게 되면 대개 정상 범위로 돌아온다. 그 다음 문제로서 그렇다면 RAAS 억제제의 대체 약제로 어떤 것을 선택해야 할 것인가? 환자의 기저 질환에 따라 다르겠으나 단순히 항고혈압 목적으로만 한다면 칼슘 통로 차단제, 이뇨제나 알파 차단제를 사용할 수 있겠다. 베타차단제 역시 칼륨 상승에 기여할 수 있으므로 정상 범위의 혈청 칼륨 범위 내로 회복된 것을 확인한 후에 사용을 고려해야 할 것이다. 아직 많은 임상 경험이 있는 것은 아니지만 단백뇨를 동반하는 당뇨병성 신병증이나 비당뇨병성 만성콩팥병의 경우, 항고혈압 효과뿐 아니라 단백뇨 감소를 목적으로 약제를 선택한다면 칼슘 통로 차단제 중에서도 L/N형 칼슘 통로 차단제인 clinidipine 혹은 L/T형 칼슘 통로 차단제인 efonidipine, nilvadipine, azelnidipine 등의 사용을 고려해 볼 수 있다[40].
결 론
ACEi와 ARB와 같은 RAAS 억제제들은 고혈압, 심혈관 질환, 당뇨병 그리고 만성콩팥병 등에 유용하게 사용되어왔다. 전반적으로 볼 때 이들 약제 사용과 관련되어 고칼륨혈증이 발생할 수는 있으나, 그 발생 빈도가 높지 않고 환자들이 RAAS 억제를 통하여 얻는 이득이 크므로 RAAS 억제제를 투여 받고 있거나 투여 예정인 환자들에게서는 정기적인 감시를 하면서 처방하는 것이 좋겠다.
