Sunitinib이 FRTL-5 세포의 증식 및 생존에 미치는 영향
Effect of sunitinib on the proliferation and survival of FRTL-5 cells
Article information
Abstract
목적
최근 소화기 기질 종양과 신장암의 치료에 사용되고 있는 표적 치료제인 sunitinib은 36~85%의 환자에서 갑상선 기능 이상을 유발하였다. 아직 sunitinib이 갑상선 기능 저하를 일으키는 기전은 명확히 알려진 바가 없다. 본 연구에서는 현재 가장 널리 사용되고 있는 정상 갑상선 세포 모델인 FRTL-5 세포를 이용하여 sunitinib이 갑상선 세포에 미치는 영향을 확인하고자 하였다.
방법
FRTL-5 세포에서 sunitinib이 세포의 증식에 미치는 영향을 갑상선 자극 호르몬(TSH)의 유무에 따라서 확인하였다. 유속 세포 측정 분석을 통해서 세포 주기에 미치는 영향과 세포 자연사의 여부를 확인하였다. 세포 주기의 진행과 관련된 단백 발현량의 변화는 웨스턴 블롯을 통해서 확인하였다.
결과
Sunitinib은 농도와 시간 의존적으로 FRTL-5 세포의 증식을 억제하였으며, TSH가 존재하는 조건에서 그 영향이 뚜렷하였다. FRTL-5의 세포 주기는 sunitinib에 의해서 G1-S기에 멈추었으며, 15 μM의 고농도에서는 caspase-3를 활성화하고 세포의 자연사를 촉진하였다. TSH에 의해서 기저에서 억제되어 있었던 p21cip1과 p27kip1의 단백 발현이 sunitinib에 의해서 증가되는 것을 웨스턴 블롯으로 확인하였다. 또한, G1-S기 진행에 관련된 cyclin D1, cyclin dependent kinase 2는 sunitinib에 의해서 억제되었다.
결론
정상 갑상선 세포주인 FRTL-5 세포는 TSH가 존재하는 상태에서 sunitinib에 의해서 세포의 증식을 더욱 억제하였고, 고농도에서는 세포 자연사를 유발하였다. Sunitinib은 TSH에 의해서 기존에 억제되어 있던 p27kip1/p21cip1 단백 발현을 증가시키면서 세포 주기를 G1-S기에 멈추도록 하였으며, 이는 sunitinib이 TSH의 작용을 방해할 수 있음을 보여주고 있다.
Trans Abstract
Background/Aims:
Hypothyroidism has been reported in 36~85% of patients treated with sunitinib for renal cell carcinoma or gastrointestinal stromal tumor. However, the mechanism behind this hypothyroidism is unclear. This study evaluated the effects of sunitinib, a multi-target tyrosine kinase inhibitor, on the survival and proliferation of thyrocytes using FRTL-5 rat thyroid cells.
Methods:
We examined the effect of sunitinib on cell proliferation in the presence and absence of thyroid stimulating hormone (TSH) in a colorimetric assay. Effects on the cell cycle were evaluated by flow cytometry, and on apoptosis using an annexin V apoptosis assay kit and by immunoblotting for caspase-3. Immunoblotting was also used to evaluate changes in the levels of intracellular proteins associated with the G1-S phase of the cell cycle.
Results:
Sunitinib suppressed the proliferation of FRTL-5 cells in a dose- and time-dependent manner. This suppressive effect was enhanced by the presence of TSH (1 mU/mL). Sunitinib was subsequently shown, in flow cytometric analyses, to arrest the cell cycle at the G1-S phase. Furthermore, it induced apoptosis at a high concentration (15 μM) by activating caspase-3. G1-S phase arrest was associated with the induction of p27kip1 and p21cip1, whose expression is suppressed by TSH under control conditions. Sunitinib also decreased intracellular levels of cyclin D1 and cyclin-dependent kinase 2 in FRTL-5 cells.
Conclusions:
Sunitinib induced apoptosis in and suppressed the proliferation of FRTL-5 cells. Its suppression of proliferation was further enhanced by the presence of TSH. Sunitinib arrested the cell cycle in the G1-S phase by inducing the expression of p27kip1/p21cip1, which are suppressed by TSH under normal conditions. Collectively, these findings suggest that sunitinib may interfere with TSH signaling pathways in normal thyrocytes. (Korean J Med 79:509-517, 2010)
서 론
최근 개발되어 소화기 기질암과 진행성 신장암의 치료에 임상적으로 널리 사용되고 있으며, 다른 고형암에서도 임상 연구 중인 sunitinib은 경구 투약이 가능한 tyrosine kinase 억제제이다1). Sunitinib은 vascular endothelial growth factors 수용체들(VEGFR-1, -2), platelet-drivved growth factors 수용체(PDGFR-α, -β), 줄기 세포 인자 수용체인 c-KIT, 그리고 FLT-3와 RET kinase 등에도 광범위하게 억제 작용하는 것으로 알려져 있다1-4). 그런데 sunitinib을 사용한 임상 연구에서는 약 36~85%에 해당하는 환자들에서 갑상선 기능 저하증을 비롯한 갑상선 기능 이상이 발생한다는 것이 보고되었다5-9). 다른 표적 치료제인 imatinib과 sorafenib의 경우에도 갑상선 기능 이상과 관련된 보고가 하나씩 있었으나10,11) 최근까지 tyrosine kinase 억제제와 관련된 갑상선 기능 이상은 거의 대부분 sunitinib과 관련된 것이었다.
일부 연구들에서는 sunitinib의 투여 초기에 갑상선 중독증이 발생하였다가 이후 기능 저하증으로 진행됨을 보이면서 이들 중 일부에서 시행된 갑상선 초음파 검사 결과 갑상선의 부피가 감소한 소견으로 미루어 보아 sunitinib에 의해서 갑상선이 직접적으로 파괴되었을 가능성을 제시하기도 하였다9). 또 다른 연구들에서는 갑상선 호르몬 생성에 중요한 효소인 thyroid peroxidase (TPO)가 억제될 수 있다는 가능성과 갑상선 세포의 요오드 섭취가 억제될 수 있다는 가능성을 제시하였다12,13). 하지만 아직까지 sunitinib이 갑상선 기능 이상을 유발하는 기전이나 갑상선 세포에 미치는 영향을 구체적으로 밝힌 연구는 없는 실정이다.
본 연구는 백서의 갑상선에서 유래하였으며 요오드를 섭취하고 갑상선 글로불린과 TPO를 발현하는 등 갑상선 세포의 특성을 지니고 있는 FRTL-5 세포주를 이용하여 sunitinib이 갑상선 세포의 증식과 생존에 미치는 영향을 규명하고자 하였다.
대상 및 방법
1. 연구 재료
본 실험에 사용된 고순도의 정제된 우형 TSH, 인슐린, 코르티솔, 소마토스타틴, 트란스페린, glycyl-L-histidyl-L-lysin 아세트산염(GHL)의 여섯 가지 호르몬과 Coon’s modified F-12 nutrient mixture는 Sigma-Aldrich사(St. Louis, MO, USA) 제품을 사용하였다. 세포 배양에 필요한 열불활성화된 우태아 혈청, 비필수아미노산, 5% 트립신 용액, 인산염 완충 용액(PBS), penicillin-streptomycine계 항생제는 Gibco사(Grand Island, NY, USA)에서 구입하였다. Cell Counting Kit-8 (CCK-8)은 Dojindo Laboratories (Kumamoto, Japan)에서 구입하였고, HRP Chemiluminescent Substrate Reagent 키트는 Invitrogen (Carlsbad, CA, USA), 니트로셀룰로스막은 Amersham Bioscience (Piscataway, NJ, USA)에서 구입하였다. 세포 자연사 확인을 위한 Vybrant Apoptosis 측정키트와 단백 정량에 사용된 Quanti-iT™ Protein Assay 키트는 Molecular Probe사(Eugene, OR, USA)에서 구입하였다. Caspase-3, cleaved caspase-3, cyclin D1, cyclin depedent kinase (CDK) 2, p27kip1에 대한 일차 항체와 세포용해 완충액는 Cell Signaling사(Danver, MA, USA)에서 구입하였다. CDK4에 대한 일차 항체는 Abcam사(Cambridge, MA, USA)에서 p21cip1에 대한 일차 항체는 BD Biosicences (San Jose, CA, USA)에서 각각 구입하였다. 이차 항체인 HRP-conjugated anti-rabbit IgG 와 anti-mouse IgG는 Vector Laboratories (Burlingame, CA, USA)에서 구입하였다. 그 외에 사용된 모든 재료들은 Sigma-Aldrich(St.Louis, MO)에서 구입하였다.
2. 세포 배양
Coon’s modified F-12 배지에 열불활성화된 5% 우태아 혈청, 1 mM non-essential amino acid, TSH (10 mU/mL), 인슐린(10 μg/mL), 코르티솔(0.4 ng/mL), 소마토스타틴(10 ng/mL), 트란스페린(5 μg/mL), GHL (10 ng/mL) 등의 여섯 가지 호르몬 혼합체를 첨가하여 만든 배양액(6H 배양액)에 FRTL-5 세포주(interthyr Research Foundation, Baltimore, MD, USA)를 배양하였다. FRTL-5는 갑상선 세포주의 모든 특징을 잘 유지하고 있는 세포주이다. 성장 배가 시간은 TSH를 추가할 경우 36±6시간이며, TSH가 포함되지 않은 배지에서는 자라지 않는다. 배지는 새로운 배양액으로 2~3일 간격으로 교환하였고, 세포를 5~7일마다 계대 배양하였으며, 5% CO2, 37℃ 항온배양기에서 배양하였다. 일부 실험에서는 실험 전 3일 동안 FRTL-5 세포를 TSH가 없는 배양액(5H 배양액)에서 배양하였다.
3. 세포 생존 분석(Cell viablility assay)
Sunitinib이 세포 생존에 미치는 영향을 확인하기 위해서 24우물판에 각 우물 당 3×105개씩의 세포를 분주하고 2일 후에 정해진 농도의 sunitinib이 포함된 6H 배양액으로 갈아주고 24~72시간 동안 세포 배양기에서 배양하였다. TSH를 제외한 5H 배양액에서의 실험은 세포 분주 3일 후에 HBSS 용액으로 2차례 세척한 후에 3일간 5H 배양액에서 유지한 후에 같은 방법으로 sunitinib이 포함된 5H 배양액에서 세포를 배양하였다. CCK-8을 이용한 발색 분석법은 배양액을 제거하고 PBS 용액으로 2번 세척한 후 CCK-8의 농도가 10%가 되도록 배양액과 희석하여 각 우물당 400 μL씩 첨가하였다. 세포 배양기에서 1~2시간 동안 배양한 후, 세포의 탈수소효소의 활성도에 의한 formazan 염료 발색을 측정하기 위해 Sepctramax Spectramax (Molecular Devices, Sunnyvale, CA) Microplate 분광 광도계에서 450 nm의 파장으로 흡광도를 측정하였으며, 각 실험은 독립적으로 3회 반복 실행하여 평균치를 구하였다.
4. 세포 주기의 유속 세포 측정 분석
FRTL-5 세포를 60 mm 배양 접시에서 1×106개의 세포를 분주하고, 48시간 동안 배양한 후에 24시간 또는 48시간 동안 sunitinib 0 μM, 5 μM, 15 μM로 처리하였다. 5% 트립신 용액으로 세포를 처리하여 모은 후에 PBS로 2차례 세척하였다. 세포를 다시 PBS에 부유시킨 후에 -20℃에 보관한 차가운 70% 에탄올을 첨가하여 다음날까지 4℃에서 고정하였다. 이후 분석 당일 시료를 PBS로 2차례 세척한 후에 propidium iodide (50 μg/mL)와 리보핵산 분해 효소 A (100 μg/mL)를 첨가하여 차광된 상태로 37℃에서 30분간 반응시켰다. 유속 세포 측정은 FACSort flow cytometer (Becton Dickinson; San Jose, CA, USA)로 측정하였으며, 한번 측정되는 시료에서 1×104개 이상의 세포를 분석하였다.
5. 세포자연사(Apoptosis)의 측정
Vybrant® Apoptosis 측정 키트를 이용하여 세포 자연사를 측정하였다. 60 mm 배양 접시에 1×106 개의 세포를 분주하고, 48시간 동안 배양한 후에 정해진 농도의 sunitinib이 포함된 배지로 바꾼 후에 24시간과 48시간에 세포를 5% 트립신 용액으로 세포를 처리하여 모았다. 차가운 PBS로 세포를 세척하고 원심분리한 후에 부유시킨 세포를 한 번 더 PBS로 세척하였다. 상층액을 버린 후에 annexin binding 완충액 100 μL를 넣어서 섞어 주었다. Annexa Fluor® 488 annexin V 5 uL와 PI working solution (100 μg/mL) 1 μL를 추가하고 상온에서 15분 동안 반응시켰다. 추가로 400 μL의 annexin binding 완충액을 추가하여 부드럽게 혼합하고 차갑게 보관한 상태로 즉시 FACSort flow cytometer로 분석하였다. 형광 발색은 530 nm와 575 nm 이상에서 측정하며 세포는 3군으로 나누었다. 살아있는 세포는 낮은 형광을 보이고, 세포 자연사는 녹색의 형광, 죽은 세포는 붉은색과 녹색 형광을 모두 보이게 된다.
6. 웨스턴 블롯 분석
단백질 추출을 위해서 실험한 세포를 차게 유지된 PBS 용액으로 2회 세척하여 반응을 종료시켰다. 단백질 분해 효소 억제제를 첨가한 세포용해 완충액을 이용하여 세포를 모아 분해한 후 4℃, 13,000×g에서 30분 동안 원심 분리하고 단백질을 포함하는 상층액을 분리하여 단백질 정량을 하였다. 단백질 정량은 Quanti-iTTM Protein Assay 키트를 이용하였으며, 우태아 혈청 알부민을 표준으로 BCA 정량법으로 측정하였다. 25 μg의 단백질을 12% SDS-PAGE gel에서 전기 영동하여 전개시킨 후에 니트로셀룰로스막으로 이동시켰다. 막에 실험에 해당하는 일차 항체(1:1,000 희석)와 12시간 동안 냉장 반응시킨 후 HRP가 연결되어 있는 이차 항체(1:4,000 희석)로 1시간 동안 반응시켰다. HRP Chemiluminescent Substrate Reagent 키트를 이용하여 막을 필름에 감광시켰다. 발현량의 정량과 보정을 위한 스캔은 FluorS Multi-Imager와 Quantitation Software (Bio-Rad, Hercules, CA, USA)를 이용하였다.
7. 통계 분석
모든 실험들은 세포군을 달리해서 적어도 3회 이상 반복하여 실시하였으며 실험 결과는 평균±표준편차로 표시하였다. 실험군 간 차이에 대한 통계적 유의성 분석은 Mann-Whitney분석을 이용하였으며, p 값은 0.05 이하인 경우를 통계적으로 의미있는 것으로 정의하였다. 통계 분석은 SPSS version 18.0 (SPSS Inc., Chicago, IL)을 이용하였다.
결 과
1. Sunitinib에 의한 FRTL-5 세포의 증식 억제와 세포 사멸
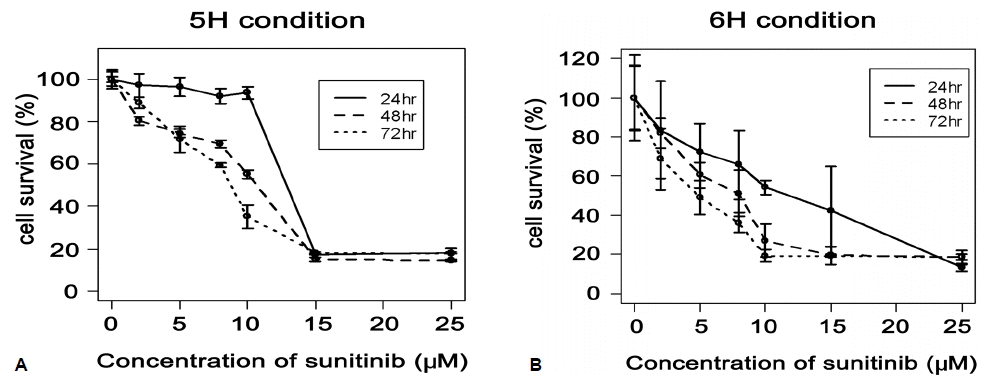
6H 배양액과 TSH를 제외한 5H 배양액에서 FRTL-5의 증식과 생존을 CCK-8을 이용한 발색반응법을 통해서 확인하였다. 5H 상태와 6H 상태 모두에서 sunitinib의 농도와 시간에 따라서 FRTL-5 세포의 생존율이 감소하는 것을 확인할 수 있었다(그림 1). 5 μM 농도의 sunitinib을 24시간 동안 처리하였을 때 5H 배양액에서의 세포수는 거의 감소하지 않았으나, 6H 배양액에서는 약 20%의 세포가 감소되었다(p<0.01). 48시간 뒤에는 5H 배양액은 약 20%의 세포가 감소한 반면, 6H 배양액에서는 약 40% 정도의 세포가 감소되었다(p<0.01). 즉, TSH가 포함된 6H 배양액에서 sunitinib에 의한 세포 증식 또는 생존 억제에 의한 세포수의 감소가 더 뚜렸하게 나타났다. 한편, 15~25 μM 농도의 sunitinib에서는 생존 세포가 거의 없음을 확인할 수 있었다.
2. Sunitinib에 의한 FRTL-5 세포의 세포 주기 억제
FRTL-5 세포 성장 주기에 sunitinib이 미치는 영향을 확인하기 위해서 5~15 μM 농도의 sunitinib을 24시간 및 48시간 처리한 후에 유속 세포 측정을 통해서 각 세포 주기 변화를 확인하였다. Sunitinib 처리하지 않은 세포에서 G1기에 속한 세포의 비율은 63%였으나, 5 μM 처리 후 24시간에 70%, 48시간에 72%로 G1기의 세포 비율이 증가하였으며(각각 p=0.10, p=0.03), 15 μM 처리 후 24시간에는 G1기 세포가 79%로 증가되었다(p<0.01, 그림 2). 반면, 22%의 세포가 S기에 있었으나, 5 μM의 sunitinib에서 24시간 뒤에 18%, 48시간 뒤에 17%로 S기의 세포가 감소하였고(각각 p=0.24, p=0.04), 15 μM 농도에서 24시간 후에는 S기의 세포가 16%로 감소하였다(p=0.05). Sunitinib에 의한 갑상선 세포의 주기 변화를 분석한 결과, 세포의 성장은 G1-S기에 멈추는 비율이 높았던 것을 확인할 수 있었다.
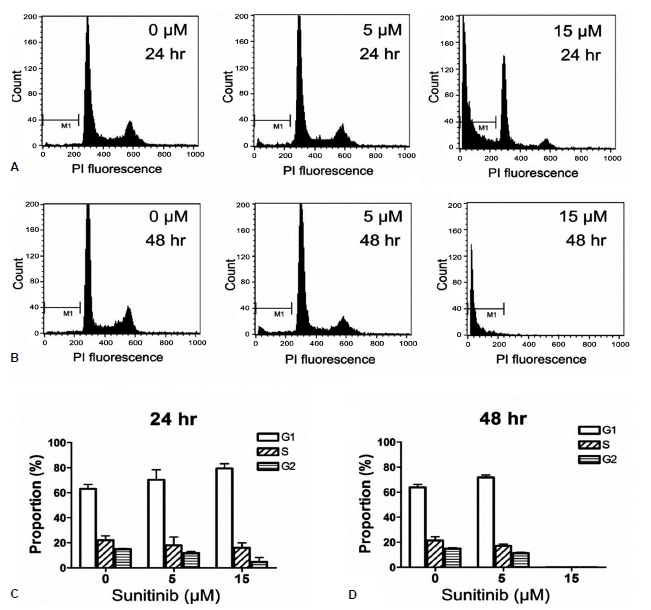
Induction of cell death and G1-S phase arrest by sunitinib in FRTL-5 cells. FRTL-5 cells were maintained in 6H medium for 3 days and then treated with sunitinib (0~15 μM) for 24 or 48 h. They were then subjected to florescence-activated cell-sorting (FACS) analysis after fixation and staining with propidium iodide (A and B). Proportions of cells in each phase of cell cycle (C and D). PI, propidium iodide; M1, proportion of dead cells.
3. Sunitinib에 의한 FRTL-5 세포의 세포 자연사
Sunitinib에 의해서 사멸된 세포의 비율을 유속 세포 측정을 통해서 확인하였다. Sunitinib을 15 μM로 처리한 후 24시간에 60%, 48시간에 99%의 세포가 사멸되었음을 확인하였으며, 5 μM 농도에서 사멸된 세포의 비율은 1~2% 정도에 불과하였다(그림 2A, 2B). 15 μM의 농도에서 FRTL-5 세포가 생존하지 못하는 기전을 확인하기 위해서 세포자연사 여부를 확인하였으며, 15 μM 농도에서 annexin V 형광을 띤 세포가 시간에 따라서 점차 증가되는 결과를 보여서 sunitinib이 FRTL-5의 세포 자연사를 유발함을 확인하였다(그림 3A-3C). 세포 자연사 과정에서 중요한 단백인 caspase-3의 활성화 여부는 웨스턴 블롯으로 확인하였다. Caspase-3의 단백 발현은 sunitinib을 처리한 후에 증가하였으며, 15 μM 농도에서 24시간에 cleaved caspase-3의 증가도 확인할 수 있었다(그림 3D). 따라서 FRTL-5 세포에서 sunitinib이 세포의 증식이 억제하고, 고농도에서는 세포 자연사를 유발하는 것을 알 수 있었다.
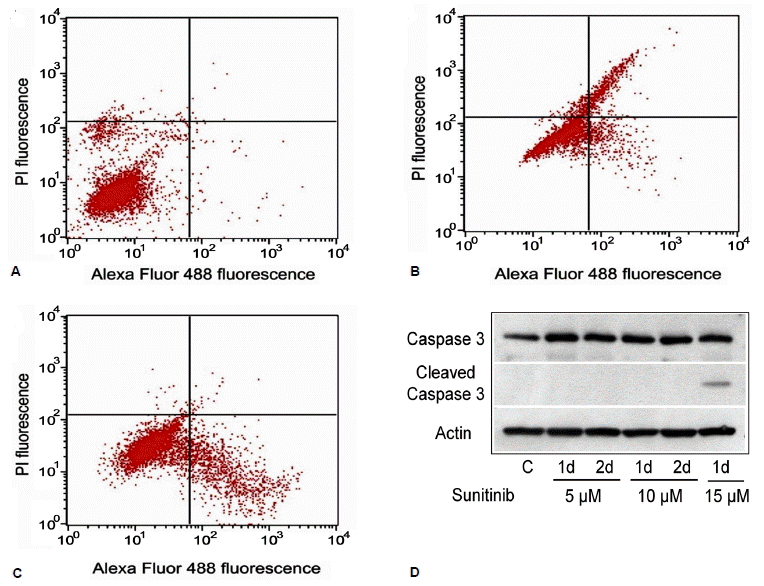
Induction of apoptosis in FRTL-5 cells treated with 15 μM sunitinib. FRTL-5 cells were maintained in 6H medium for 3 days and then treated with vehicle (A) or 15 μM sunitinib for 24 h (B) or 48 h (C). They were then subjected to FACS analysis after staining for propidium iodide and annexin V. The lower right quadrant shows apoptotic cells. Levels of caspase-3 and cleaved caspase-3 were increased after treatment with sunitinib (5~15 μM in 6H medium) (D).
PI, propidium iodide; Alexa Flour 488, Annexin V; C, vehicle control; d, day.
4. Sunitinib이 세포 주기에 관련된 단백 발현에 미치는 영향
Sunitinib이 FRTL-5 세포가 G1기에서 S기로 진행되는 과정을 억제하는 기전을 확인하기 위해서 G1기와 S기에 관련된 단백인 cyclin D1/cyclin E, CDK2, CDK4와 p27kip1/p21cip1의 변화를 웨스턴 블롯으로 확인하였다. 6H 배양액에서 FRTL-5 세포의 p27kip1/p21cip1 단백량의 발현은 감소되어 있었으나, sunitinib에 의해서 용량 및 시간 의존적으로 그 발현이 증가되었다. 5 μM sunitinib을 처리한 후 6시간부터 p27kip1/p21cip1 단백의 발현량이 유의하게 증가하였고(p<0.01), 48시간이 지난 후에 그 발현량이 가장 많았다(p<0.001, 그림 4A-4C). 한편, G1기 진행에 중요한 단백인 cyclin D1의 발현은 6~12시간 동안은 큰 변화가 없었으나, 24~48시간 이후부터는 그 발현량이 유의하게 감소하였다(그림 4A, 4D). 또한, G1-S기 진행에서 중요한 CDK2의 경우에는 sunitinib을 처리한 초기부터 단백 발현량의 유의한 감소를 보였다(그림 4A, 4E).
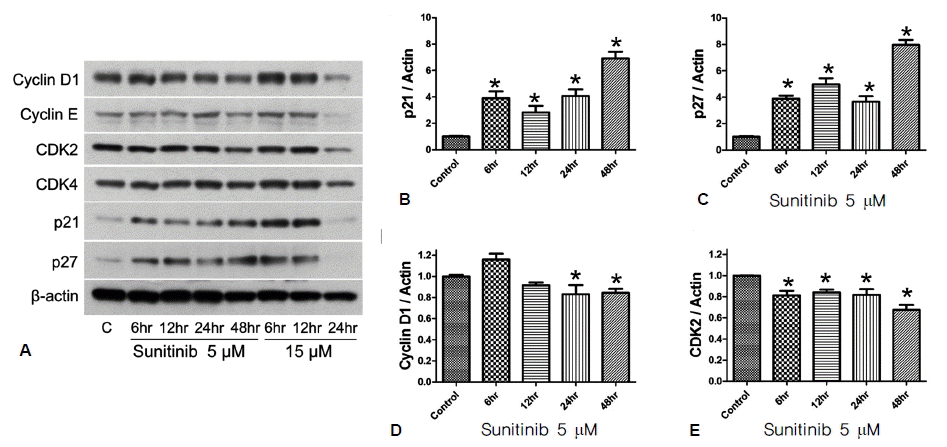
Arrest of the cell cycle in the G1-S phase by sunitinib through induction of p27kip1/p21cip1 expression and suppression of cyclin D1/cyclin-dependent kinase 2 in FRTL-5 cells. FRTL-5 cells were maintained in 6H medium for 3 days and then treated with sunitinib (5~15 μM in 6H medium) for 6~48 h. Whole-cell lysates were prepared and analyzed by Western blotting. Relative expression of each protein was calculated using a FluorS Multi-Imager (Bio-Rad, Hercules, CA, USA) and quantitation software.
CDK, cyclin-dependent kinase; C, vehicle control; hr, hours.
*p<0.05.
고 찰
본 연구에서는 sunitinib이 FRTL-5 세포의 증식과 생존을 억제하고 세포자연사를 유도하는 것을 확인하였다. Sunitinib은 FRTL-5의 세포 주기를 G1-S기에 멈추도록 하였으며, 이는 TSH에 의해서 기존에 억제되어 있던 p27kip1의 발현 증가와 관련이 있어서 sunitinib이 TSH의 작용을 방해할 수 있음을 보여주고 있다.
Sunitinib을 사용한 진행성 신장암과 소화기 기질 종양에 대한 연구에서는 약 36~85%의 환자들에서 갑상선 기능 저하증이나 갑상선 기능 이상이 발생한 반면에 다른 tyrosine kinase 억제제인 imatinib의 경우에는 갑상선 전절제술 후에 갑상선 호르몬을 복용하던 환자 10명에서 갑상선 호르몬 요구량이 늘어났다는 보고가 전부이며11), sorafenib의 경우는 갑상선 기능 저하가 약 21% 정도만 보고되어 있어서 sunitinib에 비해서 그 정도나 빈도가 경한 것으로 보인다10). 따라서 sunitinib이 갑상선 세포에 미치는 영향은 다른 tyrosine kinase 억제제에 비해서 특이적인 것으로 볼 수 있고, 그 기전을 확인하는 것은 sunitinib을 투여하는 환자들에서 갑상선 기능 이상을 예측하고 예방하는데 도움을 줄 수 있을 뿐만 아니라, 향후 개발되는 새로운 tyrosine kinase 억제제의 부작용을 조기에 확인하고 적용하는데 도움을 줄 수 있을 것이다. 하지만 아직까지 sunitinib이 갑상선 기능 이상을 유발하는 명확한 기전에 대해서는 알려져 있지 않으며 일부 보고들을 통해서 몇 가지 가능성이 제기되었다. Desai 등에 의한 전향적인 연구에서는 sunitinib의 사용기간이 길수록 갑상선 기능 이상의 빈도가 증가되었으나 자가면역 갑상선 질환의 병력과 sunitinib에 의한 갑상선 기능 저하는 관련이 없었다9). 이 연구에서는 suntinib 투여 초기에 갑상선 중독증과 동반되어 일시적으로 TSH가 억제되었다가 시간이 경과함에 따라서 갑상선 기능 저하가 진행하는 특성을 보였으며, 일부 환자들에서 시행된 갑상선 초음파 결과에서도 갑상선의 부피가 감소된 소견을 보여서 sunitinib이 직접적으로 갑상선 세포를 파괴하여 갑상선염을 유발할 수 있다는 가능성을 보여주었다. 한편, Wong 등의 연구에서는 sunitinib이 갑상선 호르몬 과정에서 TPO를 직접적으로 억제할 수 있다는 가능성을 제기하였지만, methimazole과 같은 항갑상선제에 비해서 그 효과가 미미하고 고농도의 sunitinib에 의해서만 TPO가 억제되는 것으로 보아 그 가능성은 낮을 것으로 보인다12). Mannavola 등은 sunitinib에 의해서 갑상선 기능 이상이 발생한 환자들에서 약물 사용기간에 일치하여 TSH가 주기적으로 증가하고, 요오드 섭취능도 주기적으로 감소됨을 밝혀서 sunitinib에 의해서 갑상선 세포의 요오드 섭취능이 억제될 수도 있다는 가능성을 제시하기도 하였다13). 하지만 FRTL-5 세포를 이용한 실험연구에서는 sunitinib이 요오드 섭취능을 억제하지 않았으며, 갑상선 세포 내 요오드 섭취와 관련된 sodium iodide symport의 발현에도 영향을 주지 않음이 확인되었다14). 따라서 본 연구는 sunitinib이 FRTL-5 세포의 증식과 세포자연사 그리고 세포 주기 진행과 관련된 영향을 확인하고자 하였다.
본 연구에서는 sunitinib에 의해서 갑상선 세포의 증식과 생존이 억제됨을 확인하였다. 이미 기존의 연구에서 FRTL-5 세포의 증식과 생존이 1~50 μM sunitnib에 의해서 농도 및 시간 의존적으로 억제됨을 확인하였다14). 본 연구는 sunitinib에 의한 세포 증식 및 생존 억제의 효과가 TSH가 존재하는 상태에서 더 유의한 것을 추가적으로 확인하였으며, 저농도에서는 세포의 성장과 증식을 억제하고 고농도에서는 세포의 자연사를 유발한다는 것을 보였다. 또한, Sunitinib은 세포 주기 진행을 억제하였으며, FACS 분석에서 세포 주기가 특히 G1-S기에 멈춰있는 비율이 높음을 확인하였다.
세포는 G1-S-G2-M기의 주기를 거치면서 DNA를 합성하고 세포 분열을 통해서 증식하게 되는데, 이 과정에서는 세포 외부의 다양한 신호 자극과 그 자극에 반응하는 세포 내 신호 전달 체계가 관여하게 된다. 세포 증식을 위해서는 G1기에서 GTPase 활성 단백이 활성화되고, S기에 DNA 합성이 이뤄지는 것이 필수 적이다. G1-S기의 진행에는 cyclin D와 cyclin E가 CDK와 결합하는 과정이 핵심적인 요소인데, 이 과정에서 cyclin D, cyclin E 그리고 CDK2를 억제하는 역할을 하는 것이 p21cip1, p27kip1 및 p57Kip2과 같은 Cip/Kip 단백이다15-17). FRTL-5 세포에서는 TSH가 세포의 증식과 생존에 있어서 핵심적인 역할을 하고 있으며, 인슐린은 TSH 작용에 보조적인 역할을 하고 있으며, TSH가 없는 상태에서는 인슐린이나 인슐린양 성장인자에 의한 하부 신호전달 체계의 활성은 미미하다18,19). 따라서 sunitinib이 갑상선 세포의 성장에 미치는 영향을 확인하기 위해서는 TSH 신호 전달 체계에 suntinib이 직접적으로 미치는 영향에 대한 확인이 필요하다. 기존의 연구에서 TSH는 세포의 G1기를 조절하는 Cyclin D1의 발현은 증가시키는 한편 p27kip1의 발현을 억제하는 것으로 알려져 있다18,20).
본 연구에서도 FRTL-5 세포는 TSH가 존재하는 배양액에서 p27kip1/p21cip1 발현이 억제되어 있음을 확인할 수 있었다. Sunitinib을 처리하였을 때 초기부터 p27kip1/p21cip1의 발현이 증가되었으며, 이는 기저 상태에서 TSH에 의해서 억제되었던 p27kip1/p21cip1 단백발현이 sunitinib에 의해서 농도와 시간에 따라서 증가되고, 이에 따라서 갑상선 세포의 G1-S기 진행이 억제될 수 있음을 보이고 있다. 따라서 이러한 결과는 sunitinib이 갑상선 세포에 필수적인 TSH의 작용 기전을 방해하는 역할을 한다는 것을 보여주는 결과이다. cyclin D1와 CDK2가 sunitinib에 의해서 24시간 뒤부터 억제되는 것은 p27kip1/p21cip1의 증가에 의해서 영향을 받을 가능성이 높으며, cyclin D1 및 CDK2의 억제 역시 G1-S기 진행억제와 관련되어 있을 것으로 보인다.
비록 세포 실험이긴 하지만, 본 연구는 sunitnib이 정상 갑상선 세포인 FRTL-5 세포의 증식과 생존에 필수적인 TSH의 작용과 관련이 있을 수 있음을 처음으로 확인하였다. Sunitinib은 TSH가 존재하는 조건에서 갑상선 세포의 증식과 생존을 더욱 억제하였으며, TSH에 의해서 억제되어 있던 p27kip1/p21cip1 단백 발현을 증가시켜서 세포 주기가 G1-S기에 머무르도록 하였다. 향후, sunitnib이 갑상선 세포에 미치는 추가적인 작용기전 및 추가적인 동물 실험 등을 통해서 보다 명확한 작용기전을 확인하는 연구가 필요할 것이다.