마이코플라즈마 폐렴에서 발생한 미만성폐포출혈에 의한 급성호흡부전 1예
Acute respiratory failure due to diffuse alveolar hemorrhage in mycoplasma pneumonia
Article information
Abstract
저자 등은 15세의 면역적격 상태의 환자에서 마이코플라즈마 폐렴에서 발생한 미만성폐포출혈에 의한 급성호흡부전을 경험하였기에 문헌고찰과 함께 보고한다.
Trans Abstract
Acute respiratory failure from mycoplasma pneumonia is uncommon, because community-acquired pneumonia from mycoplasma pneumonia is typically not severe in patients without underlying disease. In addition, alveolar hemorrhage is a rare manifestation in these cases. We describe a case of acute respiratory failure that required mechanical ventilation due to diffuse alveolar hemorrhage in an immunocompetent patient with mycoplasma pneumonia. (Korean J Med 79:428-431, 2010)
서 론
미만성폐포출혈(Diffuse alveolar hemorrhage)은 주로 면역저하 상태나 출혈성 기저질환, 바이러스의 감염에서 동반되고 빠른 진행과 불량한 예후를 가지기에 적절한 감별진단이 필요하다1,2).
마이코플라즈마(Mycoplasma) 폐렴은 매우 흔한 지역사회 획득폐렴이며 대체로 저절로 회복되는 경미한 경과를 가진다3). 마이코플라즈마 폐렴에서 미만성폐포출혈은 매우 드문 소견으로 동종골수이식 후에 마이코플라즈마 감염에 의한 1예가 있었다4).
이에 저자 등은 면역적격(immunocompetent) 상태의 마이코플라즈마 폐렴 환자에서 미만성폐포출혈로 인한 급성호흡부전 1예를 경험하였기에 문헌고찰과 함께 보고한다.
증 례
15세의 여자 환자가 3일 간의 고열과 오한, 기침, 호흡곤란으로 내원하였다. 2일 동안 혈액이 섞인 가래를 배출하였고, 진행하는 호흡곤란이 있었다. 특별한 과거력이 없고, 음주와 흡연을 하지 않는 중학생이었다.
환자는 명료한 상태로 체온 38.8℃, 맥박 분당 100회, 호흡수 분당 30회, 혈압 115/70 mmHg였고, 양측 폐에서 흡기시에 수포음이 청진되었다. 그 외에 특이한 진찰 소견은 없었다.
실내 공기에서 동맥혈가스검사상 pH 7.485, PaCO2 27.8 mmHg, PaO2 49.1 mmHg HCO3 20.7mEq/L, SaO2 88.7%였고, 호흡곤란이 진행하여 100%의 산소분압으로 기계환기를 시작하였다. 백혈구는 4,000/mm3 (호중구 81%), 혈색소 13.1 g/dL, 혈소판 123,000/mm3이었고, 프로트롬빈 시간과 활성화부분트롬보플라스틴 시간은 정상 범위였다. 적혈구침강속도는 26 mm/hour, C-반응성 단백질은 25.3 mg/dL이었다.
첫날 측정한 마이코플라즈마(ImmunoWell Gembio, Netherlands) IgM 항체가는 1:1,092이었고 IgG 항체가가 1:402로 높은 수치를 보여 마이코플라즈마 폐렴으로 진단되었다. 입원 후에 마이코플라즈마, IgM 항체가는 1:4,746까지 증가하였다.
흉부촬영에서는 양측 폐에 간유리 음영을 동반한 전반적인 경화상태를 보였고(그림 1A), 흉부 전산화단층촬영에서는 양측 폐하엽에 산재된 공기공간결절(air space nodule)과 간유리 음영 및 공기조영상(air bronchogram)을 동반한 광범위한 경화를 보여 미만성폐포출혈이 의심되었다(그림 1B).
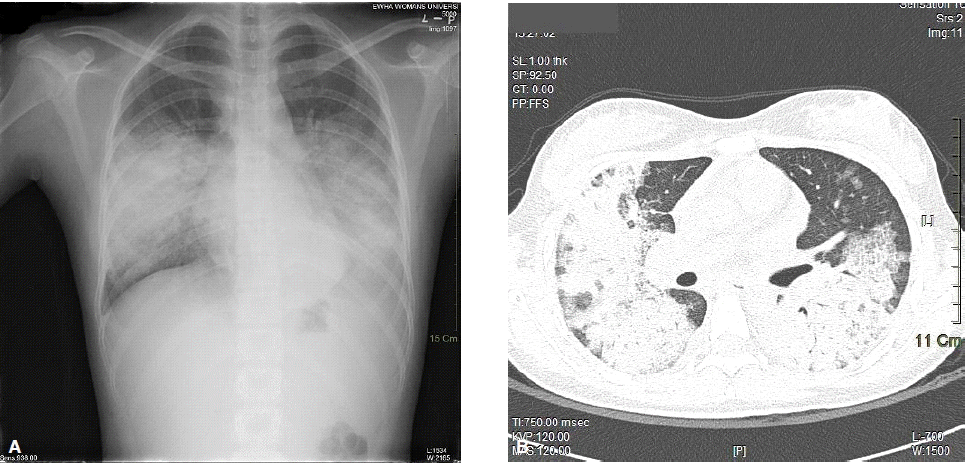
(A) Chest radiography showed bilateral consolidation with ground-glass opacity. (B) Chest CT showed consolidation, ground-glass opacity and poorly-defined air-space nodules.
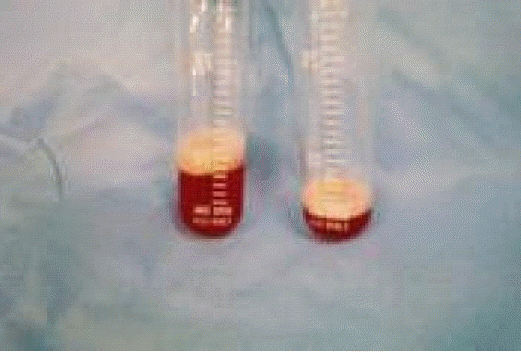
우측 폐중엽에서 실시한 기관지폐포세척에서 처음 받은 세척액보다 나중에 받을수록 더욱 진해지는 혈성액을 보여 폐포출혈을 시사하였다(그림 2). 기관지폐포세척액에서 적혈구는 18,880/mm3, 백혈구는 520/mm3 (호중구 76%, 림프구 13%)였다.
기관지폐포세척액, 흉부 전산화단층촬영 소견과 객혈의 임상양상으로 미만성폐포출혈을 진단할 수 있었다.
미만성폐포출혈의 원인감별진단을 위해 혈청학적, 세균학적 검사를 실시하였고, 모두 음성이었다. 한랭응집소(cold agglutin), 류마토이드 인자, 항핵항체(anti-nuclear antibody), 항중성구세포질 항체(anti-neutrophil cytoplasmic antibody, ANCA), 항사구체기저막 항체(anti-glomerular basement membrane antibody)가 모두 음성이었고, 면역글로불린은 정상범위였다.
기관지세척액에서 실시한 세균 및 결핵균 배양과 도말 검사, Pneumocystis jiroveci 중합효소연쇄반응 등도 모두 음성이었다. 소변 폐렴알균 항체, 소변 레지오넬라 항체와 혈청 한탄 바이러스 항체, 렙토스피라 항체, 리켓치아 항체, 거대세포 바이러스 항체(IgM), 헤르피스바이러스 항체(IgM), 엡스타인바바이러스 항원(capsid antigen)과 항체(IgM), 아데노바이러스 항체, 인플루엔자 A와 B 항원, 풍진 항체, 톡소플라즈마 항체, 파라인플루엔자 항체, 호흡기세포융합바이러스 항체 모두 음성이었다. 따라서 본 환자에서 미만성폐포출혈의 원인은 마이코플라즈마 감염에 의한 것으로 판단하였다.
중환자실에 입원하여 광범위 항생제인 piperacillin/tazabactam과 levofloxacin을 사용하였고, 지속적으로 감소하던 혈색소는 3병일부터 안정화되었다. 산소요구량과 흉부촬영상 증가된 폐음영은 2병일부터 감소하였다. 제8병일 때 기계환기요법을 중단하였고, 2주 후에는 다른 합병증없이 퇴원하였다(그림 3).
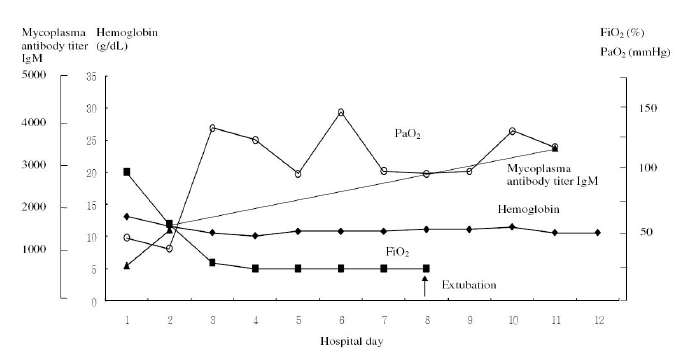
Changes in laboratory data during clinical course. Mycoplasma antibody IgM titers were increased until discharge. Hemoglobin was decreased initially but stabilized from day 3 of hospitalization. Initially, there was a rapid decrease in FiO2 and an increase in PaO2. Extubation was performed on day 8 of hospitalization.
고 찰
기저질환이 없는 경우에 치명적인 폐포출혈은 매우 드문 것으로 알려져 있고, 레지오넬라, 포도상구균, 클라미디아, 리켓치아, 한탄바이러스와 거대세포바이러스 감염 등에서 보고되었다2). 20예의 미만성폐포출혈을 분석한 국내논문에서는 면역성 원인 13예, 원인을 모르는 경우가 4예, 파종혈관내응고를 가진 간암 1예, 감염성 원인은 2예 있었고, 림프종에서 거대세포바이러스 감염과 렙토스피라 감염때문이었다5). 본 증례의 환자는 면역 저하나 다른 기저질환이 없었고, 마이코플라즈마 항체 외에 다른 세균도말 및 배양, 기타 바이러스들의 항체가가 모두 음성으로, 미만성폐포출혈의 원인으로 이들을 배제할 수 있었다.
마이코플라즈마는 지역사회획득 폐렴에서 비교적 흔한 병원체로 방사선학적 소견에 비해 심한 기침 등의 증상을 동반하지만 대체로 가벼운 경과를 보여 다수에서 자연히 회복된다1). 극히 일부에서 심한 경과를 보이는데, 국외에서 급성백혈병환자에서 동종골수이식 후에 마이코플라즈마 감염에 의한 미만성폐포출혈을 보인 폐렴환자가 보고되었고, 인후와 소변에서 Mycoplasma hominis가 동정되었다4). 그 외에 마이코플라즈마 감염에서 드물게 급성호흡곤란증후군이나 중증의 폐렴 발생에 대한 보고가 있었고6,7) 국내에서도 급성호흡부전증후군이 발생한 보고가 있었으나8), 면역적격 상태에서 마이코플라즈마 폐렴에서 미만성폐포출혈로 인한 호흡부전은 보고된 바가 없다.
마이코플라즈마 감염은 인후도말검사, 객담배양 혹은 혈청학적 검사로 진단할 수 있고, 최근 감염은 간접면역형광검사에서 IgM 항체가가 정상보다 4배 이상 증가할 경우 진단에 가치가 있으며 한랭응집소의 경우는 33~76% 정도 양성을 동반하지만 음성일 경우도 있다9). 본 증례에서는 한랭응집소는 음성이었으나 마이코플라즈마 IgM 항체가가 4,000 이상 증가하여 마이코플라즈마에 의한 폐렴을 진단할 수 있었다.
마이코플라즈마 감염에서 미만성폐포출혈을 일으키는 병태생리학적 원인은 거의 알려지지 않았지만 치명적인 혈소판 감소를 일으킨 보고7)가 있었고, 파종성혈관내응고, 세균감염에 의한 폐포벽의 파괴 등이 가능할 수 있다2,3,10-13).
미만성폐포출혈은 심각한 저산소증과 활력징후가 떨어지는 등의 매우 빠르고 광범위한 진행경과를 보이며 예후가 불량하다1). 따라서 원인 질환에 대한 적절한 감별 진단과 빠른 치료가 요구되며 면역적격상태의 환자에서 특별한 원인을 찾을 수 없는 미만성폐포출혈과 호흡부전의 원인으로 마이코플라즈마 폐렴을 고려할 수 있겠다.