원발성 고알도스테론혈증과 동반된 잠복성 쿠싱증후군 1예
A case of adrenocortical adenoma with primary hyperaldosteronism and subclinical Cushing’s syndrome
Article information
Abstract
원발성 고알도스테론혈증과 잠복성 쿠싱 증후군을 동시에 보이는 부신피질샘종을 진단하였던 예는 극히 드물다. 저자들은 고혈압 및 저칼륨혈증에 의해 야기된 증상을 주소로 내원한 41세 여자에게서 원발성 고알도스테론혈증을 시사하는 검사 소견이 있어 이를 평가하던 중, 원발성 고알도스테론혈증과 잠복성 쿠싱 증후군을 동시에 보이는 부신피질샘종 1예를 경험하였기에 문헌고찰과 함께 보고한다.
Trans Abstract
Cases of combined primary hyperaldosteronism and subclinical Cushing's syndrome are extremely rare. We identified a left adrenocortical tumor in a 41-year-old woman by computed tomography (CT) during an evaluation for hypokalemia and hypertension. Hormonal assessment demonstrated normal aldosterone concentrations, low plasma renin activity, an increased aldosterone/renin ratio, and normal serum cortisol levels. Selective adrenal venous sampling for the determination of aldosterone concentrations showed an overfunctioning left adrenal gland. Dexamethasone (overnight 1mg, 2 mg, 8 mg) suppression tests showed insuppressible cortisol. We diagnosed the patient as having an aldosterone-producing adrenal adenoma associated with subclinical Cushing's syndrome. (Korean J Med 79:321-326, 2010)
서 론
최근 부신 우연종으로 발견된 환자들 중 점차 많은 수가 호르몬 검사를 통하여 잠복성 쿠싱 증후군으로 진단되고 있다. 잠복성 쿠싱 증후군이란 월상안, 복부 자색 선조, 중심부 비만 등과 같이 코티솔 과잉을 의심할 만한 전형적인 임상증상 및 이학적 소견이 없이, 생화학적으로 코티솔의 분비가 경도 및 중등도로 증가되어 있는 경우를 말한다. 저자들은 고혈압 및 저칼륨혈증에 의해 야기된 증상을 주소로 내원한 41세 여자에게서 원발성 고알도스테론혈증을 시사하는 검사소견이 있어 이를 평가하던 중, 원발성 고알도스테론혈증과 잠복성 쿠싱 증후군을 동시에 보이는 좌측 부신피질샘종 1예를 경험하였기에 보고하고자 한다.
증 례
환 자: 이○○, 여자, 41세
주 소: 양쪽 상지 및 입술의 마비
현병력: 환자는 내원일 오전부터 양쪽 상지 및 입술의 마비 발생하여 응급실로 내원하였다.
과거력: 7년 전 고혈압 진단받았으며, 1년 전부터 thiazide 25 mg, atenolol 50 mg, felodipine 5 mg 복용 중이다.
가족력 및 사회력: 특이사항 없음.
약제 복용력: 내원 10일 전 한약 복용한 적 있음.
진찰 소견: 환자의 키는 160 cm, 몸무게는 58 kg이었으며, 내원 당시 생체징후는 혈압 140/100 mmHg, 심박동수 84회/분, 호흡수 18회/분, 체온 36.8℃였다. 환자는 급성 병색을 보였고, 의식은 명료하였다. 흉부 청진 결과 이상 없었으며, 복부는 편평하고 부드러웠고, 장음은 정상이었으며, 하지 부종은 없었다.
검사실 소견
-일반 검사: 내원시 말초혈액검사에서 백혈구 6,700/mm3, 혈색소 11.3 gm/dL, 혈소판 256,000/mm3이었으며, 생화학검사에서 혈당 116 mg/dL, 혈중 요소 질소 12.5 mg/dL, 혈청 크레아티닌 0.6 mg/dL, 총 단백 8.0 g/dL, 알부민 4.6 g/dL, aspartate aminotransferase (AST) 24 IU/L, alanine aminotransferase (ALT) 13 IU/L, alkaline phosphatase (ALP) 53 IU/L, 총 빌리루빈 0.5 mg/dL, 나트륨 142 mEq/L, 칼륨 1.7 mEq/L, 칼슘 8.2 mg/dL, 인 2.2 mg/dL, 마그네슘 1.8 mg/dL, 총 콜레스테롤 186 mg/dL, 중성 지방 59 mg/dL, 고밀도 콜레스테롤 61 mg/dL, lactate dehydroganase(LDH) 412 IU/L, creatine phosphokinase (CPK) 129 IU/L의 소견이었다. 동맥혈가스검사에서 pH 7.546, 이산화탄소 분압 43.1 mmHg, 산소 분압 75.0 mmHg, 중탄산염 36.6 mmHg, 산소포화도 96.5%였다. 요검사에서 특이소견은 보이지 않았다.
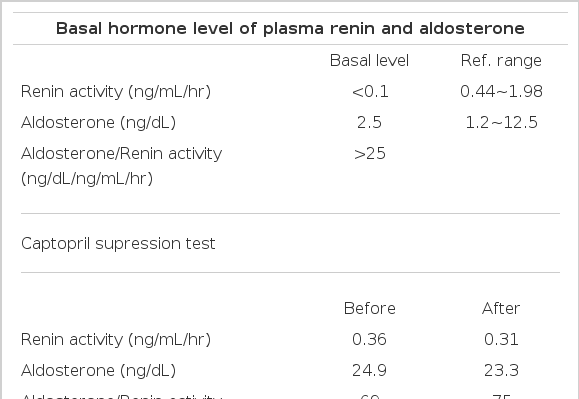
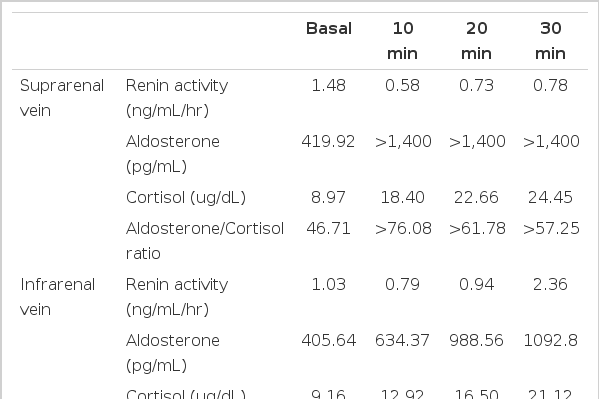
-내분비 검사: 고혈압약 투약 중단 후 내원 2병일째 혈장레닌 활성도는 <0.1 ng/mL (정상 0.44~1.98)로 감소되어 있었으나 알도스테론 농도는 2.5 ng/dL (정상 1.2~12.5)로 정상이었고, 혈장 레닌 활성도와 알도스테론의 비는 25 이상으로 증가되어 있어서 감별진단을 위하여 캡토프릴 억제검사가 추가적으로 필요하였다(표 1). 고혈압약 투약 중단 후 내원 열흘째 시행한 캡토프릴 억제검사에서 알도스테론 감소율은 6%로 억제되지 않았고, 캡토프릴 투여 후에도 혈장 레닌 활성도와 알도스테론의 비는 75로 증가되어 있었다(표 1). 고혈압약 투약 중단 후 내원 한 달째 시행한 생리식염수 부하검사 후 알도스테론 농도는 57.3 ng/dL (정상 1.2~12.5)로 증가된 양상을 보여 원발성 고알도스테론혈증으로 진단하였다(표 1). 기저 혈중 코티솔 및 부신피질자극호르몬 농도는 정상이었으나(표 2), 24시간 소변에서 유리 코티솔 배설량은 134.14 ug/day (정상 20~70)로 증가되어 있어서 쿠싱 증후군을 의심할 수 있었다. 그 밖의 기타 부신 호르몬 24시간 소변 배설량은 정상이었다. 24시간 소변의 메타네프린 0.2 mg/day(정상 0~1), 노어메타네프린 119.1 ug/day (정상 88~444), vanillymandelic acid (VMA) 5.1 mg/day (정상 0~8), 17-ketosteroid 3.7 ng/day (정상 7~20)였고, 혈장 dehydroepiandrosterone sulfate(DHEA-s)는 25.24 ug/day (정상 35~560)였다. 선별검사상 1 mg 하룻밤 덱사메타손 억제검사 후 코티솔 농도는 5 ug/dL 이상이어야 쿠싱 증후군을 의심할 수 있고, 여기서는 4.46 ug/dL으로 기준에 약간 미치지 못하였다. 그러나 표 2에서 이미 24시간 소변 유리 코티솔 배설량으로 쿠싱 증후군을 의심할 만한 소견이 발견되었기 때문에 확진을 위한 저용량 덱사메타손 억제검사를 시행하였다. 저용량 덱사메타손 억제 후 24시간 소변 코르티솔 >10 ug/day이면 쿠싱 증후군으로 확진할 수 있으며, 여기서는 173.2 ug/day로 억제되지 않아 쿠싱 증후군으로 진단하였다. 고용량 덱사메타손 억제 후기저치의 50% 이상의 24시간 소변 유리 코티솔 억제를 보일 때는 뇌하수체 병변에 의한 쿠싱병으로 볼 수 있으며, 부신종양과 이소성 질환에 의한 쿠싱 증후군은 덱사메타손에 의하여 억제되지 않는다. 여기서는 고용량 덱사메타손 억제검사 후 24시간 소변 유리 코티솔이(134.14~107.55)/134.14=0.19(19%)로 억제되지 않아 원발성 쿠싱 증후군으로 진단하였다(표 2). 부신 정맥 도자법에 의한 양측 정맥 채혈 후 알도스테론 분비 선종의 진단 기준은 환측의 알도스테론/코티솔 비(코티솔 값으로 보정한 알도스테론)가 건측에 비해 두배 이상 증가되어 있으면서, 건측 부신정맥과 하대정맥의 알도스테론/코티솔 비가 1 이하인 경우로 보고 있다. 부신 정맥 도자법에 의한 양측 정맥혈 채취 결과, 좌측의 알도스테론/코티솔 비가 우측에 비해 두배 이상 증가되어 있으면서, 우측 부신정맥과 하대정맥의 알도스테론/코티솔 비가 0.4인 소견을 보여 알도스테론과 코티솔을 분비하는 좌측 부신피질샘종으로 진단하였다(표 3).
방사선 소견: 복부 전산화단층촬영에서 1.5×2×2.3 cm 크기의 단일 종괴가 죄측 부신 위에 위치하여 비교적 내부가 균일하게 조영 증강되고 있었고, 양측 신동맥 협착은 보이지 않았다(그림 1). 터키안 자기공명영상에서 특이소견은 관찰되지 않았다.
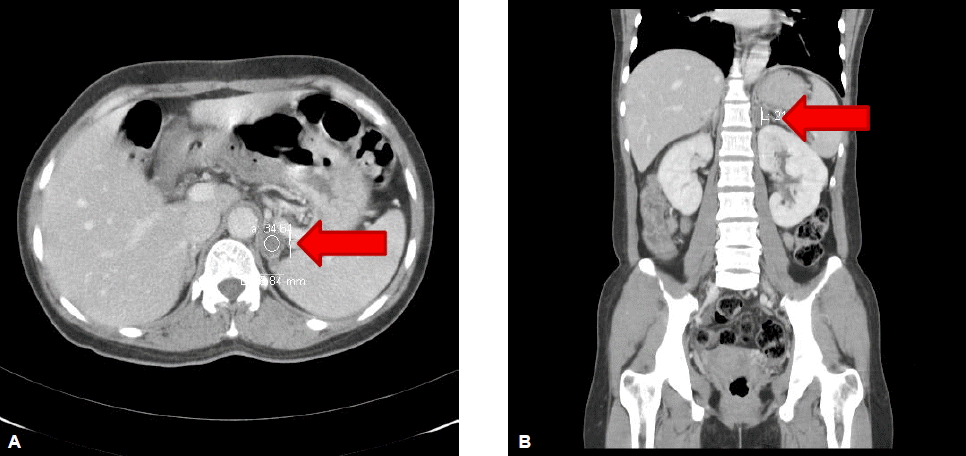
Abdominal CT shows 2.5×2 cm sized ovoid mass (arrow) on the left adrenal gland. (A) Horizontal view. (B) Sagittal view.
수술소견 및 조직소견: 전신 마취 후 복강경하 좌측 부신피질샘종 절제술을 시행하였다. 수술 후 육안적 소견에서 피막에 싸인 5.5×3.0×2.5 cm 크기의 구형 부신피질샘종을 볼 수 있었고, 절단면은 황금색과 황갈색이 군데군데 섞인 모양이었다. Hematoxylin-Eosin 염색 후 광학현미경 소견에서는 종양을 둘러싼 피막의 침범은 보이지 않았고, 크고 투명한 세포의 군집으로 이루어져 있어 부신피질샘종에 합당한 소견이었다(그림 2).
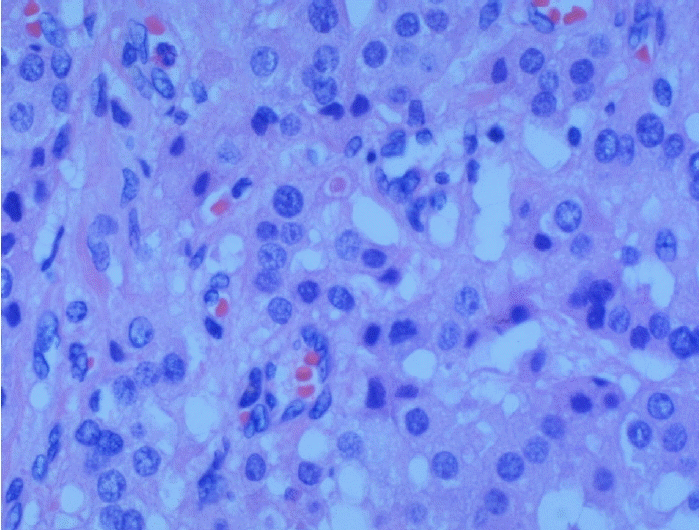
Light microscopic finding shows benign adreno-cortical adenoma consisting of mostly light clear cells and scattered dark compact cells (hematoxylin-eosin stain. ×400).
치료 경과: 수술 후 1개월째 혈압은 정상화되었고, 혈중 칼륨 농도는 4.7 mEq/L였다. 수술 후 별다른 호르몬 보충 요법이 필요하지 않았다. 혈장 레닌 활성도 0.56 ng/mL (정상 0.44~1.98), 알도스테론 농도 1.81 ng/dL (정상 1.2~12.5), 혈중 코티솔 10.59 ug/dL (정상 5~25)로 정상화되었고, 1 mg 하룻밤 덱사메타손 억제검사 후 코티솔 농도는 1.15 ug/dL로 억제되어 호르몬의 완전한 회복을 보였다.
고 찰
부신 우연종은 1.4~8.7% 가량의 빈도를 보이며, 나이에 따라 증가하는 경향을 보인다. 부신 우연종은 복부 전산화단층 촬영을 시행한 환자에게서 최대 5%까지 보고되고 있고, 영상 기술이 발달함에 따라 점차 많은 환자들이 발견되고 있는 추세이다2). 주로 종괴의 크기가 3 cm 이상인 경우 호르몬 과분비를 동반하는 경우가 많으며, 발견된 부신 우연종 중약 6~20% 정도에서 호르몬 이상을 동반하고 있다3).
본 환자에서는 원발성 고알도스테론혈증을 시사하는 검사 소견이 있어 이를 평가하던 중, 원발성 고알도스테론혈증과 잠복성 쿠싱 증후군을 동시에 보이는 좌측 부신피질샘종을 진단하였던 예로, 이와 같이 고알도스테론혈증과 잠복성 쿠싱 증후군을 동시에 나타내는 부신피질샘종의 예는 세계적으로도 매우 드물다4-7). 유사한 보고가 우리나라에서 1예 있었으나, 현성 쿠싱 증후군의 전형적인 임상양상을 보여 이를 평가하던 중 무증상의 고알도스테론혈증이 우연히 동시에 진단되었던 것으로, 쿠싱 증후군의 전형적인 임상양상이 없었던 본 증례와는 차이가 있다8).
본 환자에서는 저칼륨혈증의 원인을 평가하던 중, 알도스테론 농도는 정상이었으나 혈장 레닌 활성도가 감소되어 있었고, 혈장 레닌 활성도와 알도스테론의 비는 증가되어 있음을 발견하였다. 환자가 내원 전 베타 차단제 및 칼슘 통로 차단제 등의 고혈압약을 복용 중이었으므로, 이를 모두 중단한 뒤 열흘 후에 확진을 위한 알도스테론 억제검사를 시행하였다. 캡토프릴 억제 검사에서 알도스테론은 억제되지 않았고, 생리식염수 부하 검사 후에도 알도스테론이 증가된 양상을 보였다. 복부 전산화단층촬영상 좌측 부신피질샘종이 발견되었으며, 부신 정맥 도자법에 의한 양측 정맥혈 채취 결과 좌측의 알도스테론/코티솔 비가 우측에 비해 두 배 이상 증가되어 있으면서, 우측 부신정맥과 하대정맥의 알도스테론/코티솔 비가 1 이하로 감소된 소견을 보여 좌측 원발성 알도스테론 분비 선종으로 진단하였다.
또한 기저 혈중 코티솔 및 ACTH 농도는 정상이었으나 24시간 소변 코티솔 배설량이 증가되어 있었고, 1 mg 하룻밤 덱사메타손 억제 검사와 저용량 및 고용량 덱사메타손 억제 후 모두 억제되지 않았다. 일반적으로 코티솔 과분비시 월상안, 보라색 자색 선조, 자반, 피로감, 중심성 비만 등의 임상 증상을 보이나, 본 환자에서는 이와 같은 증상이 없어 잠복성 쿠싱 증후군으로 진단하였다.
원발성 고알도스테론혈증은 이전에는 진단을 위한 검사 과정이 복잡하였으나, 최근에는 간단한 혈장 레닌 활성도와 알도스테론의 비 검사만으로 선별검사의 유용성이 인정되어 점차로 진단율이 증가하고 있다. 원발성 고알도스테론혈증은 쿠싱 증후군 및 갈색세포종과 더불어 내분비질환에 의한 2차성 고혈압의 주요 원인 질환으로, 혈중 알도스테론 수치가 증가함으로써 염분 저류에 의한 혈장량 증가로 인해 고혈압과 함께 저칼륨혈증을 동반하며, 알도스테론 분비 샘종과 양측 부신피질 증식증에 의한 특발성 고알도스테론혈증이 대부분을 차지한다.
원발성 고알도스테론혈증의 발생 빈도는 보고자에 따라 차이가 있어서 전체 고혈압 환자의 0.1~1%까지 보고하고 있으며9), 여자에게서 더 많고, 30대 및 40대에서 주로 많다고 하며10), 특히 젊은 나이의 여자 고혈압 환자에서는 이차성 고혈압의 원인 질환의 하나로써 꼭 의심해야 할 것으로 생각된다. 증상은 알도스테론 과다로 인해 신장에서의 염분 및 수분의 축적과 칼륨의 과다 배출로 인해 저칼륨혈증에 의한 요 농축능의 감소로 다뇨, 다음 등의 증상과 근신경증상으로 전신 쇠약감, 이상감각, 간헐적 마비 증상이 올 수 있는 것으로 알려져 있다. 본 환자의 경우에서도 젊은 나이의 여자 고혈압 환자이면서 저칼륨혈증으로 인한 근신경증상이 동반되어 있어 원발성 고알도스테론혈증의 전형적인 증상을 나타내는 것을 관찰할 수 있었다.
잠복성 쿠싱 증후군이라는 개념은 1981년 Charbonnel 등에 의하여 처음 기술이 되었고, 부신 우연종의 5~20%까지 그 빈도가 보고되고 있다11). 잠복성 쿠싱 증후군이란 생화학적으로 코티솔이 과분비되고 있으나 이를 의심할 만한 전형적인 임상증상 및 이학적 소견을 보이지 않는 것을 의미하는 것으로, 대부분의 경우에서 현성 쿠싱 증후군으로 이행하지는 않는 경우가 많다12). 그러나 임상증상이 없더라도 비만, 고혈압, 제2형 당뇨, 골다공증 등 코티솔 과잉에 따른 장기적 합병증이 높은 빈도를 보이기 때문에 진단적 가치가 있다. 또한 편측 부신 종양으로 절제술을 시행하려는 경우, 건측 부신이 상대적으로 위축되어 있어 수술 후 예기치 못한 부신 기능 저하 위기를 유발할 수 있으므로 수술 전 잠복성 쿠싱 증후군 유무에 대한 선별 검사가 반드시 필요하다13).
원발성 고알도스테론혈증으로 진단된 환자들 중 일부에서는 잠복성 쿠싱 증후군도 동시에 가지고 있을 것으로 추정되며, 불충분한 호르몬 검사로 인해 완전히 진단되지 못했을 가능성이 있다. 그러므로 원발성 고알도스테론혈증을 비롯한 기능성 부신피질샘종을 보이는 환자에게서, 코티솔 과잉의 전형적인 임상 증상을 보이지 않더라도 잠복성 쿠싱 증후군의 동반 여부에 대한 의심을 해 보는 것이 꼭 필요하며 중요한 일이라 할 수 있다.