급성관동맥 증후군과 취약성 경화반
Acute coronary syndrome and vulnerable plaque
Article information
Trans Abstract
Acute coronary syndrome (ACS) consists of unstable angina, non-ST segment elevation myocardial infarction (NSTEMI), and STEMI. The pathology underlying ACS is acute thrombosis in a coronary artery, which is usually caused by plaque rupture in a mild stenotic lesion. A rupture-prone plaque is known as a vulnerable plaque (VP), although recently the definition of VP has been expanded to include rapidly progressive plaque. Although no single method can predict future cardiac events in mild stenotic lesions, there have been big advances in detecting VP, such as virtual histology-intravascular ultrasound and optical coherence tomography. These techniques look for thin cap fibroatheromas, which is the most common type of VP, characterized by a thin fibrous cap<65 μm, a large necrotic core, and marked macrophage infiltration of the fibrous cap. The recent concept of VP, the methods for detecting VP, and the treatment of VP are discussed. (Korean J Med 79:241-249, 2010)
서 론
최근 경험한 환자에 대해 먼저 소개하고자 한다. 62세 남자 환자로 안정형 협심증의 임상 진단하에 관상동맥 조영술을 시행하였다. 우측 관상동맥의 근위부에 육안으로 30% 정도의 협착 소견이 관찰되었고, 중간 부위에 40%에서 50% 정도의 협착 소견만 보여 약물 치료를 하면서 경과관찰을 하였다(그림 1A). 처음 관상동맥 조영술을 시행 후 10개월째 갑작스런 흉통과 함께 심한 서맥으로 인한 저혈압과 의식 저하를 주소로 응급실로 내원하였다. 심전도상 심근 하벽의 급성 심근 경색증의 진단하에 응급 관상동맥 조영술을 시행하였고 우측 관상동맥 근위부의 완전 폐색이 관찰되었다(그림 1B). 환자는 성공적인 일차적 관상동맥 중재술을 시행받았으며 특별한 합병증 없이 4일째 퇴원하였다. 그러나 의식이 회복되고 응급 시술 1일 후 환자는 저자에게 억울한 심정을 호소하였다. 처음 관상동맥 조영술 시행 시 협착 정도가 심하지 않았다고 하였으나 왜 갑자기 혈관이 막혀서 위험한 고비를 경험했는가에 대한 것이었다. 일차적 관상동맥 중재술 당시 시행한 intravascular ultrasound (IVUS) 소견을 보면 경화반을 덮고 있는 섬유막의 파열이 8시 방향에 관찰이 되고, 하부의 공간이 관찰되는 전형적인 관상동맥 경화반 파열소견이 관찰된다(그림 1-1~1-4). 병에 대한 충분한 설명 후 환자는 이해를 하고 퇴원을 했으나 자칫하면 의료 분쟁으로도 이어질 수 있는 상황이기도 하다.
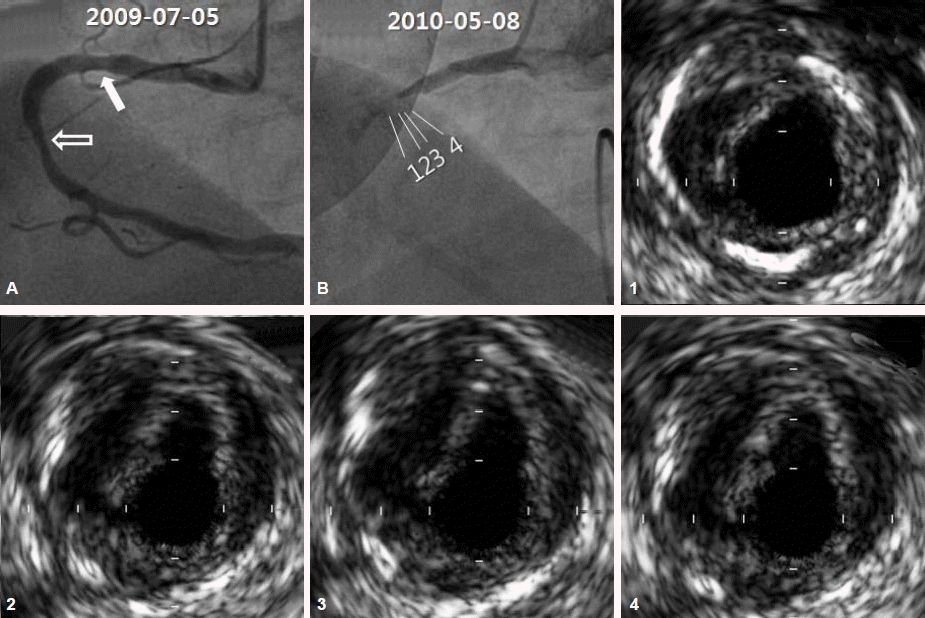
Coronary angiogram (A [transradial] and B [transfemoral]) and intravascular ultrasound (IVUS) findings (1-4) in a 62-years old gentleman. There were 30% stenosis (solid arrow) and 40~50% stenosis (empty arrow) by visual estimation in A and total occlusion in proximal right coronary artery 10 months after the initial angiogram in B, which was matched to the solid arrow lesion. IVUS examination (1-4) showed intimal tear, ruptured plaque cavity and relatively preserved lumen area, which is a typical example of plaque rupture.
본 증례와 같은 급성 심근 경색증은 급성관동맥 증후군에 속하며 대부분 관상동맥 경화반의 파열로 인하여 발생하며 사전에 심한 협착은 없었던 경우가 대부분으로 알려져 있다1). 실제 급성 심근 경색증이 발생하기 전 관상동맥 조영술을 시행했었던 194명의 환자를 조사했을 때 68%에서는 50% 미만의 협착이 있었던 부위에서 급성 심근 경색증이 발생했으며, 18%에서는 50%에서 70%의 협착이 있었으며, 14%에서만 70% 이상의 협착이 있었던 부위에서 원인이 되었다1). 따라서 관상동맥 조영술상 심한 협착의 존재가 급성 관동맥 증후군을 예측하지 못하며 현재까지 어떤 방법도 급성 관동맥 증후군의 발생을 정확히 예측하지 못하였다. 저자는 급성심근 경색증을 포함하는 급성 관동맥 증후군과 경화반 파열(plaque rupture)을 유발하여 급성 관동맥 증후군의 원인으로 알려져 있는 취약성 경화반(vulnerable plaque)의 진단 및 치료에 대해 고찰해 보고자 한다.
취약성 경화반이란?
급성관동맥 증후군은 갑작스런 혈관내 혈전 형성으로 인하며 이의 원인 병변은 경화반 파열(55~60%), 경화반 미란(plaque erosion, 30~35%) 그리고 석회화된 결절(calcified nodule, 2~7%)이다2).
취약성 경화반에 대한 초기 정의는 적절한 자극에 노출 시 혈전 형성의 위험이 있는 경화반을 지칭하였으나 차츰 조직학적 연구에 의해 지질이 많은 핵(lipid rich core)과 대식세포의 침윤이 많은 섬유막(fibrous cap)을 가지는 경화반으로 여겨지고 있다3-5).
최근 미국심장 학회에서 발표한 취약성 경화반에 대한 정의로는 경화반 파열이나 혈전 형성이 일어나기 쉬운 경화반뿐 아니라 병변의 빠른 진행으로 심한 협착이 발생하는 것도 취약성 경화반의 범주에 포함을 하고 있다6-8).
취약성 경화반 연구(The center of vulnerable plaque research)에서 병리학적 진단 기준을 표 1과 같이 제시한 바도 있다8).
취약성 경화반은 급성 관동맥 증후군이나 심인성 급사와 연관이 있으나 혈전 형성이 잘되는 혈액(vulnerable blood)이 있을 수 있으며 치명적 악성 부정맥을 유발하기 쉬운 심근(vulnerable myocardium)도 임상경과에 중요한 역할을 한다. 따라서 심장 사고의 위험이 높은 환자의 인지에 있어서 취약성 경화반이라는 용어보다는 취약성 환자(vulnerable patient)라고 지칭하는 것이 적절할 수도 있다8).
Thin cap fibroatheroma (TCFA)란?
경화반 파열의 전구 병변이며 취약성 경화반의 가장 흔한 형태로서 경화반 파열과 형태학적으로 가장 비슷한 병변은 TCFA로 알려져 있는데, 괴사성 핵(necrotic core)이 있으며 대식세포가 침윤된 얇은 섬유막으로 덮여 있는 병변을 지칭한다. 섬유막에 평활근 세포는 거의 보이지 않지만 대식세포의 침윤은 많으며 섬유막의 두께는 65 μm 미만이다2).
TCFA의 진단 기준으로 사용되는 섬유막의 두께는 부검 연구에서 파열된 경화반의 섬유막의 두께가 23±19 μm인 것에서 유래가 되었다9). 즉, 평균치에서 2 SD (standard deviation)를 더한 값으로 정한 것이다. 경화반 파열의 90% 정도에서는 괴사성 핵의 면적이 경화반 면적(plaque area)의 10% 이상이며 약 65%에서는 25% 이상을 차지하는 반면, TCFA의 75%에서 괴사성 핵의 면적이 경화반 면적의 10% 이상을 차지한다. 괴사성 핵의 길이는 경화반 파열과 TCFA에서 비슷한데 약 2~22.5 mm (평균 8~9 mm)에 이른다10). TCFA의 75% 정도에서 단면적 내경 협착(cross-sectional luminal narrowing)이 75% 미만으로 혈관 직경 협착(diameter stenosis)으로 보았을 때는 50% 미만에 해당된다2). 이로 보아 50% 미만의 협착 병변에서 취약성 경화반의 확인에 신경을 기울여야 하는 이유가 된다.
TCFA의 50% 이상은 주요 관상동맥의 근위부에 존재하고 나머지 1/3은 중간 부위에 위치하고 나머지는 원위부에 존재한다. 경화반 파열이나 치유된 경화반 파열의 위치도 TCFA와 비슷하게 나타난다11). 다른 연구에서는 경화반 파열인 경우 좌전하행지인 경우 83%에서 근위부에 나타나며, 우관상 동맥인 경우 근위부와 원위부가 각각 48%와 32%에서 나타나며, 좌회선지인 경우 고르게 분포가 됨을 206명의 대상 환자에서 세 개의 주요 관상동맥의 IVUS를 이용하여 보고하기도 하였다13).
취약성 경화반의 진단법
취약성 경화반의 확인과 진단을 위해 IVUS, Virtual Histology(VH)-IVUS, optical coherence tomography (OCT), palpography, intravascular Magnetic Resonance Imaging (MRI), coronary angioscopy 등이 많이 연구되고 있다.
관상동맥 조영술은 관상동맥 질환 평가에 가장 많이 사용되는 검사법으로 조영제를 사용하여 혈관 내강을 관찰하는 것이지만, 혈관벽 형태나 경화반 조직성분에 대한 정보가 없어 취약성 경화반을 정확히 인지하기에는 어려움이 있다. 관상동맥 내피세포 기능장애를 측정 시에는 관상동맥 내에 acetylcholine을 투여 후 관상동맥 조영술을 통한 혈관 내강의 직경 변화를 관찰하므로 관상동맥 조영술이 중요한 역할을 한다14). 관상동맥 내피세포 기능 이상이 심혈관계 사건과 관련이 있으며, 내피세포 기능 이상이 있는 부위는 TCFA의 주요 성분인 괴사성 핵이 많이 존재하고 있음이 밝혀져 있기도 하다14,15). 따라서 관상동맥 조영술은 협착 정도에 대한 정보를 제공하므로 취약성 경화반에 대한 한 가지 주요 기준에 대한 정보를 제공하고, 내피 세포 기능 이상을 측정할 수 있으므로 한 가지 부가 기준에 대한 정보를 제공한다(표 1).
IVUS는 병변의 조직성분에 대한 정보를 어느 정도 제공할 뿐만 아니라 관상동맥 경화반, 내경 그리고 혈관 직경 등의 평가에 가장 우수한 검사법으로 여겨진다. IVUS는 8~10 mm 두께의 경화반을 조영할 수 있으며 종축 해상도가 150 μm이고, 횡축 해상도가 250 μm 정도로 얇은 섬유막의 기준이 되는 65 μm 정도의 해상도는 얻을 수 없지만, 경화반 파열이나 균열(fissure) 그리고 괴사성 핵부위에 대한 정보는 얻을 수 있다16). 경화반 형태는 초음파 신호의 밝기에 따라 특징이 있는데 외막(adventitia)의 음영과 비슷하거나 더 밝게 나타나는 경우는 섬유 조직에 해당이 되고 밝으면서 음영 후향(acoustic shadow)이 있는 경우는 석회화를 시사하고 외막보다 어둡게 나타나는 경우는 지질성분이 있음을 시사한다17,18). 취약성 경화반의 진단 기준에서 IVUS로 확인이 가능한 것으로는 주요기준에서는 지질핵(lipid core), endothelial denudation with superficial platelet aggregation, fissured plaque, 90% 이상의 협착과 부가 기준 중에서 superficial calcified nodule, 내피세포 기능이상과 positive remodeling에 대한 정보를 얻을 수 있다(표 1). 따라서 취약성 경화반의 진단 기준의 상당부분을 확인할 수 있는 많은 장점이 있다.
VH-IVUS는 gray-scale IVUS에 비해서 추가적인 진단 기준의 확인에 대한 정보를 주지는 못하지만, 경화반의 조직 성분 분석이 더욱 정확하고 객관적으로 하게 해 준다는 데 장점이 있다19-22). 특히 음영이 낮은 경화반인 경우에 괴사성핵를 정확히 분별할 수 있는 것이 취약성 경화반의 가장 많은 형태인 TCFA의 진단에 도움이 된다.
최근 TCFA의 진단 기준으로 제시된 VH-IVUS 소견으로(그림 2) 괴사성 핵이 전체 경화반 면적의 10% 이상, 경화반 비중(plaque burden)이 40% 이상, 섬유막이 안 보이는 VH-IVUS 영상이 연속해서 3개 이상인 경우로 되어 있다23). 이를 앞에 기술된 부검 연구의 조직 소견과 비교해서 분석을 해 보면, 괴사성 핵은 TCFA의 75% 이상에서 경화반 면적의 10% 이상을 차지한다는 것에서 기인하며, 섬유막이 안 보인다는 것은 IVUS의 종축 해상력이 150 μm인 것으로 보아 섬유막두께가 150 μm 보다 얇다는 것에서 기인한다9,10). 한편, 얇은 섬유막의 두께의 기준인 65 μm는 부검연구에서 기초를 하는데10), 부검 시 조직의 수축이 이루어지고 65 μm의 두께 자체는 이미 경화반 파열이 된 섬유막의 두께에서 기인하므로 VH-IVUS상 섬유막이 안 보이는 것을 섬유막의 두께가 얇은 것이라고 정의하는 데 큰 무리는 없어 보인다. 또한, 이러한 소견들이 세 개의 연속적인 VH-IVUS 영상에서 관찰된다는 것은 보통 VH-IVUS도자의 자동 인출기(automatic pull back device)의 속도가 0.5 mm/sec인 것을 감안해 보면 세 개의 영상에서의 길이는 1.5 mm가 되는데, 이들 영상의 주위 영상까지 같은 소견을 보인다면 최대 길이는 2.5 mm가 된다. 그러므로 부검 소견에서 TCFA의 과사성 핵의 최소 길이가 2 mm이고, 부검 시 조직의 수축이 되는 것을 감안해 보면 연속적인 세 영상에서의 소견은 적합하다고 할 수 있다.
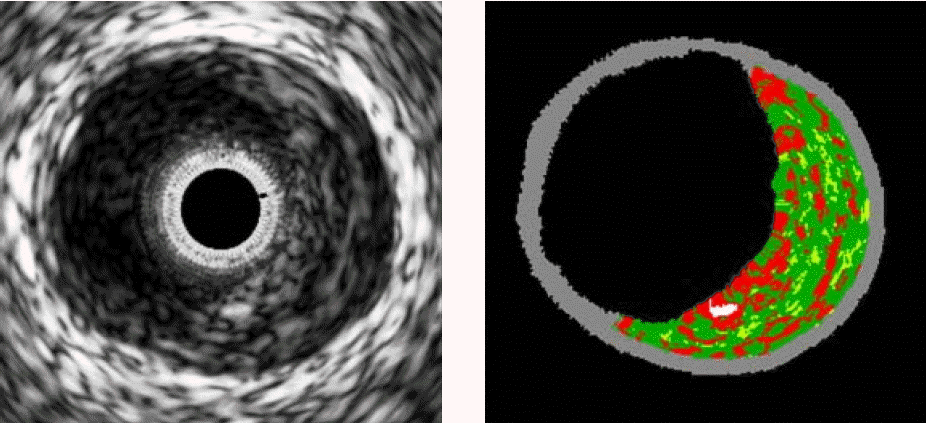
Gray-scale intravascular ultrasound (IVUS, left) and Virtual-Histology (VH)-IVUS findings (right) of thin cap fibroatheroma (TCFA). In right panel, green color represent for fibrous tissue, yellow for fibrofatty, red for necrotic core, white for dense calcium and gray for media. VH-IVUS findings represent one frame out of TCFA, in which necrotic core consisted of more than 10% of the total plaque area, plaque burden more than 40% and necrotic core contact with lumen without overlying fibrous cap.
OCT는 130 nm의 파장을(wave length) 가지는 근적외선(near-infrared light)을 사용하여 공간(spatial) 해상도는 4~16 μm이며 침투 깊이는 2~3 mm에 이른다24). OCT를 시행할 때 좋은 영상을 얻기 위해서는 풍선을 이용하여 혈류를 완전히 차단해야 하며 한 번 검사 시(pullback) 얻을 수 있는 영상의 길이가 35 mm로 제한되어 있고 직경이 큰 경우에 외막까지 충분히 검사를 할 수 없다는 단점도 있지만, 석회화 병변에서 음영 후향이 없으며, IVUS상 명확하지 않은 내막 증식이나 괴사성 핵을 명확히 관찰할 수 있고 특히 해상도가 약 9배 이상이라는 장점이 많다25). 또한, 면역 조직학적 검사와 비교한 연구에서 신내막(neointima)의 대식 세포 축적에 대한 정보도 제공하여 취약성 경화반의 중요한 특징을 나타내기도 한다26). 취약성 경화반의 주요 기준에서 염증상태, 얇은 막의 지질핵, 내피세포의 탈락과 균열을 확인할 수 있으며 부가 기준중 표면성 석회화 결절(superficial calcific nodule)에 대한 정보를 얻을 수 있다.
Palpography는 IVUS에 근거한 검사법으로 경화반의 형태나 성분뿐만 아니라 혈압에 의한 물리적 힘에 대한 조직의 반응을 보여주는 검사법이다27). 혈압에 의한 물리적 힘이 혈관벽에 가해졌을 때 괴사성 핵과 달리 섬유막은 방사상(radial)과 주위로(circumferential) 물리적 스트레스를 받게 되어 파열이 발생하게 되는데 이런 strain에 따른 수치를 색채로 표시를 하는 검사법이다27). Strain이 높은 부위는 조직학적으로 경화반이 크고 섬유막이 얇으면서 대식세포의 침윤이 많은 취약성 경화반에 대한 민감도와 특이도가 각각 88%와 89%에 이른다27). 그러나 palpography를 이용한 생체내 결과는 아직 부족하여 명확한 결론을 내리기에는 아직 어려움이 있다.
Intravascular MRI는 보통의 MRI가 가지는 흔들림으로 인한 오류(motion artifact)와 심도자실에서 사용하기 어려움 등을 극복하기 위해 최근 개발된 것으로서 경화반내 지질 성분이 혈관벽의 어느 부위까지 침범했는지를 보여주고 섬유막의 두께에 대한 정보를 제공해 준다28). 그러나 해상도가 IVUS에 비해 아직 좋지 않고 검출 코일(detector coils)의 부피가 큰 현실적인 어려움이 있는 단점이 있다. 취약성 경화반의 주요 진단 기준에서 얇은 섬유막의 지질핵, 경화반 균열과 협착 정도에 대한 정보를 제공해 줄 수 있으며 부가 기준중 석회화 결절, 경화반내 출혈과 양성 재형성(positive remodeling)에 대한 정보를 제공해 줄 수 있다.
Coronary angioscopy는 경화반을 직접 관찰하여 경화반 성분이나 섬유막의 안정성(stability)에 대한 간접적인 정보를 제공해 준다. 지질이 많은 경화반은 불규칙한 표면으로 노란색으로 보이며, 섬유조직이 많은 경우에는 하얀색으로 보이게 된다29). 노란색 경화반에서 표면에 광택이 나는 경우(glistening) 경화반 파열이 더욱 잘 발생한다30). 경화반 내부나 횡단면에 대한 관찰은 되지 않으나 취약성 경화반의 주요 기준 중 경화반 균열이나 표면에 혈소판이 부탁된 내피세포 탈락에 대한 정보를 제공해 주며, 부가 기준중 표재성 석회화 결절과 광택이 있는 노란색 경화반을 인지할 수 있는 장점이 있다. 그러나 적합한 영상을 얻기 위해 병변 하부를 막아야 하고 심한 협착이 있는 경우 도자가 병변 통과가 어렵다는 단점이 있어 이상적인 검사법이 될 수 없다31).
파열된 경화반의 임상경과
경화반 파열이 급성관동맥 증후군의 병태 생리에서 주요한 원인이지만, 모든 경화반 파열이 전부 급성 관동맥 증후군을 유발하는 것은 아니다. 관상동맥 조영술이나 IVUS 검사상 경화반 파열이 관찰되기도 하는데, 심한 협착을 동반하지 않는 경화반 파열의 치료 방침 결정 또한 어려운 문제이기도 하다.
급성 관동맥 증후군 환자에서 비원인(non-culprit) 병변에서 IVUS로 발견된 28개의 경화반 파열을 statin 40 mg과 항혈소판 제제를 복용하면서 평균 22개월째 IVUS를 재시행한 연구에서 보면 추적 기간 동안 심장 사고는 없었으며 50%에서 경화반 파열은 치유되었으며 협착 정도도 약간 감소하는 경향을 보였다(29±17%에서 22±17%, p=0.056)32). 그러나 불행히도 많은 임상의가 궁금해하는 경화반 파열이 치유되는 예측인자를 이 연구에서는 발견할 수 없었다. 비원인 병변에서 50개의 경화반 파열이 관찰된 병변을 intracoronary angioscopy로 평균 13개월째 추적관찰한 연구에서는 경화반 파열은 협착 정도가 약간 진행되면서(12.3±5.8% vs. 22.7±11.6%, p=0.0004) 치유되는 경향을 보였는데, 추적관찰 기간이 1년을 넘어선 경우 1년 이하인 경우에 비해서 치유되는 경우가 많았다(55% vs. 23%, p=0.044)33). 이 연구에서는 비원인 병변에서 경화반 파열이 치유되는 예측인자가 추적 시점에서의 C-reactive protein (CRP)와 statin의 사용이었다33). 최근, 대상군이 비교적 적지만 비원인 병변에서 경화반 파열이 관찰된 28명의 환자에서 statin 사용 유무에 따라 IVUS를 12개월째 시행하여 비교한 연구에서 보면, statin을 사용한 경우 사용하지 않은 경우보다 경화반 파열의 완전 치유가 많았으며(29% vs. 0%, p=0.049), 경화반 면적이 커지는 것과 혈관 내강이 좁아지는 것을 방지하였다34).
이들 연구를 종합해 보면 경화반 파열은 모두 급성관동맥 증후군을 야기하는 것은 아니며, 협착 정도가 심하지 않은 경우 대부분 치유되는 경향을 보이는데 염증 상태가 심하거나 statin을 사용하지 않는 경우 경화반의 크기가 증가하여 협착 정도가 심해져 혈관 확장술 등이 필요한 심장 사고와 관련이 있을 수 있음을 알 수 있다.
취약성 경화반의 치료
취약성 경화반과 급성관동맥 증후군과의 관계에 대한 많은 연구가 있고 취약성 경화반의 진단에 있어서 많은 진보가 있으나, 협착 정도가 심하지 않은 취약성 경화반이 발견되었을 때 정확한 치료 지침에 대해 정립된 바는 없는 실정이다. 최근, 협착 정도가 심하지 않은 병변에 대한 추적검사를 통해 임상적 심장 사건과 관련이 있는 예측인자를 확인하기 위한 연구가 PROSPECT (the multicenter, prospective, international Providing Regional Observations to Study Predictors of Events in the Coronary Tree, ClinicalTrials.gov identifier NCT-00180466)를 비롯하여 진행 중이다35). 이런 연구의 결과가 확립되어야 이들 병변에 대한 치료 지침이 확립될 수 있을 전망이다.
심하지 않은 중등도의 관상동맥 협착이 있을 경우 치료 지침의 판정을 위해 현재까지 인정되고 있는 방법들로는 IVUS와 분획혈류 예비력(fractional flow reserve, FFR)을 이용한 기준이 제시되고 있다36-40). IVUS상 혈관 내강이 4 mm2 이하인 경우 심근관류 핵의학 검사 및 분획혈류 예비력의 검사상 유의한 협착을 나타내는 소견과 관련이 있었다36,37). 357명의 중등도의 협착이 있는 병변을 1년 이상 추적한 연구에서 혈관확장술에 대한 독립적 예측인자로는 IVUS상 최소혈관 내경(minimal lumen area)과 면적의 협착 정도(area stenosis)였다38). 실제 IVUS상 최소혈관 내경이 4.0 mm2 이상인 경우 추적 기간 동안 3~4%에서만 혈관 확장술이 필요했으나 4.0 mm2 미만인 경우 20~31%에서 혈관 확장술이 필요했음을 보고하기도 했다38). 심근 분획혈류 예비력이 0.75 미만인 경우 가역성 심근 허혈과 관련이 있으며 민감도는 88%이고, 특이도는 100%에 이르는 가역성 심근 허혈의 진단에 우수한 검사법으로 여겨진다39). 실제 325명의 관상동맥 중재술 예정이었던 환자에서 심근분획 혈류 예비력이 0.75 이상인 경우 심장 사건은 관상동맥 중재술을 시행한 군과 약물 치료만 한 군 사이에 차이가 없었으며 협심증의 발생 빈도도 비슷하게 나타났다40). 따라서 관상동맥 중재술의 시행 여부를 판별하는 데도 심근 분획 혈류 예비력이 중요한 판단 기준으로 여겨지고 있다.
관상동맥 협착 정도가 심하지 않은 경우 IVUS나 심근 분획 혈류 예비력이 중요한 역할을 하고 있지만, IVUS의 경우 관상동맥의 직경의 차이가 사람마다 다르고 관상동맥의 근위부와 원위부에 따라서 다르므로 4 mm2를 일률적으로 적용하기에는 어려움이 있으며 심근 분획 혈류 예비력인 경우 0.75에서 0.80 사이는 명확히 판별하기에 어려운 점이 있다. 또한, 이들 두 가지 방법 모두에서 문제점으로 여겨지는 것은 취약성 경화반인 경우 협착 정도가 50% 미만인 경우가 68%이므로1) 급성관동맥 증후군의 원인 병변을 사전에 인지하기에는 어렵다는 점이 있다.
70% 미만의 협착을 보이는 관상동맥 병변에서 급성관동맥 증후군을 예방하기 위해 관상동맥 중재술을 시행하는 것은 이론적 배경이 아직 없으며 비용 효과 측면이나 손실 대비 이득을 고려해 볼 때 아직까지 금기로 여겨지고 있고 이들 병변에서 관상동맥 중재술을 포함한 적극적인 치료을 하는 임상 연구를 하기에는 윤리적 측면에서 문제점이 있다. 따라서 PROSPECT 연구 등의 장기간 연구 결과가 나와서 급성 관동맥 증후군을 유발하는 취약성 경화반에 대한 진정한 예측인자가 나올 때 비로소 치료 지침이 어느 정도 밝혀질 수 있으리라고 판단된다. 저자 등이 발표한 연구에서35) 70% 미만의 협착을 보이는 97명의 환자에서 100병변을 약 1년간 추적관찰한 연구에서는 IVUS상 4.0 mm2는 여전히 추후 심혈관 사건의 예측인자였으며, VH-IVUS상 관찰이 되는 TCFA 혹은 섬유석회화 경화반(fibrocalcific atheroma)도 심혈관 중재술을 예측하는 인자로 밝혀졌으며 이들 두 가지 인자를 동시에 보이는 경우 더욱 심혈관 중재술의 필요성이 높아짐을 보고하였으며, PROSPECT 연구에서도 아직 출판되지는 않았으나 2009년 미국 심장학회에서 이와 비슷한 연구 결과를 발표하기도 했다. 따라서 VH-IVUS에서 보이는 TCFA는 관상동맥 조영술 시행 시 치료 지침을 정하는 데 IVUS나 심근혈류 분획과 같이 중요한 판단 기준으로 사용될 가능성이 높다고 할 수 있다.
현재까지 경한 관상동맥 협착을 가지는 환자에서 statin을 이용한 적극적인 약물 치료 후 IVUS를 추적검사하여 경화반의 양상 변화를 연구한 결과가 있는데, 고용량의 statin을 사용 시 경화반의 진행 억제 혹은 호전을 보고하기도 했다41,42). 경한 관상동맥 협착을 가지는 502명의 환자는 대상으로 고용량의(80 mg atorvastatin)의 statin을 복용하고 18개월째 IVUS를 추적검사한 결과 상용량의 statin (40 mg pravastatin)보다 저밀도 지단백 콜레스테롤은 유의하게 감소했으며(-46.3% vs. -25.2%, p<0.001), 전체 경화반 부피(total atheroma volume)는 상용량인 경우 증가를 보였으나 고용량인 경우 증가가 없었고 오히려 약간 감소하는 경향을 보여(-0.4% vs. 2.7%, p=0.02) 고용량의 statin 복용이 관상동맥 경화반의 진행을 억제한다는 결과를 보고했다41). 관상동맥 조영술상 50% 미만의 협착을 가지는 349명의 환자를 대상으로 또 다른 statin인 rosuvastatin 40 mg을 복용 후 IVUS를 추적검사한 연구에서는 경화반 부피 백분율(percent atheroma volume)을 기저치에 비해 유의하게 감소시킴을 보고하였다(-0.79%, p<0.001)42). 특히, 병변이 가장 심한 부위를 비교했을 때 9.1%의 감소를(p<0.001) 보여 statin의 고용량 사용이 경한 관상동맥 협착 환자에서 병변의 호전을 보일 수 있음을 보여준다. 경화반 파열 병변을 보이는 경우에서도 statin의 사용 유무가 병변의 호전에 도움이 되는 결과를 보인 연구와32-34) 비슷하다고 할 수 있다.
취약성 경화반이 경한 관상동맥 협착에서 주로 관찰되는데 경한 협착에서의 추적연구는 앞에서의 기술과 같이 있지만, 취약성 경화반 특히 TCFA가 관찰된 경우 약물 치료 혹은 관상동맥 중재술과 같은 치료에 대한 무작위 연구는 아직 없어 명확한 치료 방침을 현재 언급하기에는 어려움이 있다.
결 론
급성관동맥 증후군은 혈관 내 갑작스런 혈전 형성으로 인하며 경화반 파열, 경화반 미란 그리고 석회화 결절 등이 그 원인 병변에 해당된다. 경화반 파열은 급성관동맥 증후군의 가장 흔한 원인 병변으로 경화반 파열이 잘 되는 병변 그리고 병변의 협착 정도의 진행이 빠른 병변을 현재 취약성 경화반으로 정의하고 있다. 취약성 경화반증 가장 흔한 형태인 TCFA의 진단을 위한 방법이 최근 많은 발전과 연구가 지속되고 있는데, 그 중 VH-IVUS와 OCT가 많은 연구가 되고 있다.
그러나 TCFA를 비롯한 취약성 경화반이 발견이 되었을 때 이의 임상경과는 다양하며 협착 정도는 심하지 않은 것으로 알려져 있어 실제 급성관동맥 증후군으로 발전하는 병변에 대한 명확한 진단 기준이 없어 이에 대한 치료 지침은 명확하지 않지만, 경한 협착을 지닌 취약성 경화반의 경우 스텐트 삽입술은 추천되지 않으므로 statin을 포함한 적극적인 약물 치료가 현재로서는 좋겠다. 취약성 경화반의 발견 시 치료 지침의 명확한 정립을 위해서는 아직 많은 전향적 연구가 필요한 실정이다.
