폐암의 조기진단
Screening for Lung Cancer
Article information
Abstract
폐암을 조기에 발견하는 것이 가능한가라고 질문한다면 아마도 그 대답은 “예”일 것이다. 그러나 폐암의 검진으로 폐암에 의한 사망률을 감소시킬 수 있는가 혹은 바꾸어 말해서 “폐암 검진이 효과가 있을까”라고 질문한다면 “아직까지는 밝혀진 바 없다”라고 하는 것이 적절한 대답일 것이다. 현재까지 저선량 CT 사용을 폐암 검진에 권장해야 한다는 과학적 증거는 없다.그러나 저선량 CT를 이용하여 폐암 검진을 시행한 결과 흡연과 관련된 질환에 대한 이해와 폐암의 생명 작용(biology)에 대해서 좀 더 알게 된 것은 사실이다. 최종 목표를 검진으로 인한 폐암의 사망률 감소는 현재 진행되고 있는 RCT의 좀더 장기적인 추적검사가 필요하며 RCT의 결과가 나올 때까지 개별적으로 검진하는 것은 피해야 한다는 것이 권장 사항이다.
Trans Abstract
Lung cancer is the primary cause of cancer mortality in worldwide. However, early lung cancer screening with chest radiography and sputum cytology in 1970s, have failed in reduction of lung cancer mortality, despite the higher proportion of early-stage cancer detection on screening. Therefore, screening for lung cancer has not been recommended. Low dose CT has been recently assessed as a screening tool in observational studies suggesting better impaction than the one obtained with chest radiography. Eight randomized controlled trials are currently under way to evaluate low dose CT as a screening tool for lung cancer. No current data exist to suggest that lung cancer screening with CT will reduce lung cancer mortality. (Korean J Med 79:231-236, 2010)
서 론
폐암은 전세계적으로 암으로 인한 사망의 가장 흔한 원인이며 2008년 통계에 의하면 약 152만명이 폐암으로 진단되었고, 131만명이 폐암으로 사망하였다1). 우리나라 중앙 암등록 통계에 의하면 2007년에 65세 이상에서 폐암의 발생은 위암 다음으로 발생률이 높고 남자에서는 폐암이 1위이다2). 폐암으로 인한 사망은 꾸준히 증가추세에 있어서 1993년도에 10만명당 17.3명이 폐암으로 사망하였고 전체 암에 의한 사망의 15.7%였는데 2005년에는 10만명당 28.4명이 사망하였고 전체 암에 의한 사망의 21.1%였다3).
폐암의 5년 생존율은 15% 이하로 지난 수십년간 수술법, 항암요법, 방사선 치료 등의 발달에도 불구하고 의미있는 호전이 없었다. 폐암 검진의 주요 대상이 되는 비소세포폐암의 경우 수술적 제거가 가능하고 제 1병기 폐암의 5년 생존율은 약 70% 정도이다4). 따라서 폐암을 조기에 발견해서 치료할 수 있다면 생존율 향상에 도움이 될 것이다.
그러나 1970년대 초 흉부 X-선 검사와 객담 세포진을 이용한 폐암 검진의 결과는 검진 대상군이 대조군에 비해 폐암의 병기가 낮고, 절제 가능한 폐암이 더 많고, 이들의 5년 생존율이 더 높았지만 질병-특이 사망률의 감소에는 영향이 없었다5). 이에 따라 폐암 검진을 권장하지 않았었다. CT는 흉부 X-선 검사에 비해 폐결절을 발견하는 데 더 민감하며 저선량 CT는 흉부 X-선에 비해 조기 폐암이 약 3~10배 정도 더 발견된다6-18). 저선량 CT에서 발견되는 폐암의 60~100%가 제 1병기로 실제 임상에서 제 1병기 폐암의 진단은 16%에 불과하고 이 시기에 수술적 절제로 치유가 가능함을 생각하면 검진의 결과는 꽤 유망하다고 생각할 수 있다. 그러나 폐암은 질병 자체의 특성과 검진 방법의 한계 때문에 폐암 검진은 매우 복잡한 문제로 폐암 검진이 폐암 사망률을 감소시키는 결과를 가져올지, 현재 검진의 대상을 어떻게 하여야 비용 효과가 있을지 아직까지 밝혀진 바 없다.
폐암의 발생은 흡연과 밀접한 관계가 있고 금연을 하더라도 흡연을 한 경력이 있는 사람은 여전히 폐암의 고위험군이지만 금연으로 폐암의 유병율이 감소하고 특히 남성에서 폐암으로 인한 사망도 감소한다19). 따라서 현재 진행되고 있는 저선량 CT의 폐암 검진 무작위 조절연구(randomized control trials, RCT)도 대부분 흡연자를 대상으로 하고 있다.
폐암 검진은 아직까지 권장 사항이 아니므로 현재까지의 저선량 CT의 연구 결과들과 현재 진행되고 있는 RCT에 대해 소개하고 저선량 CT의 제한점에 대해서 이야기하고자 한다.
저선량 CT를 이용한 폐암 검진의 결과
효과적인 검진을 위한 10가지 기준은 다음과 같다. 1) 검진대상 질환은 그 결과가 심각해야 한다. 2) 검진 대상은 질환이 임상적으로 발현되기 전에 발견율이 높아야 한다. 3) 검진 방법이 위양성 질환을 적게 발견해야 한다. 4) 검진 방법이 전임상기에서 질환을 높은 정확도로 발견해야 한다. 5) 검진 방법이 결정적인 시점 전에 질환을 발견해야 한다. 6) 검진 방법에 의한 이환율(morbidity)이 적어야 한다. 7) 검진 방법은 가격이 적당해야 하고 이용 가능해야 한다. 8) 치료법이 존재해야 한다. 9) 치료는 증상에 의해 발견되기 전에 실행했을 때 더 효과적이어야 한다. 10) 치료는 너무 위험하거나 독성이 없어야 한다.
그러나 저선량 CT는 검진 방법으로서 위의 기준을 만족시키지 못한다. 그럼에도 불구하고 현재 폐암을 작은 크기에서 빨리 발견할 다른 방법이 없고, 그래도 조기 발견의 가능성이 높은 방법이기 때문에 저선량 CT를 이용한 여러 연구가 진행 중이다.
1. 관찰 연구(observational trials) 결과들
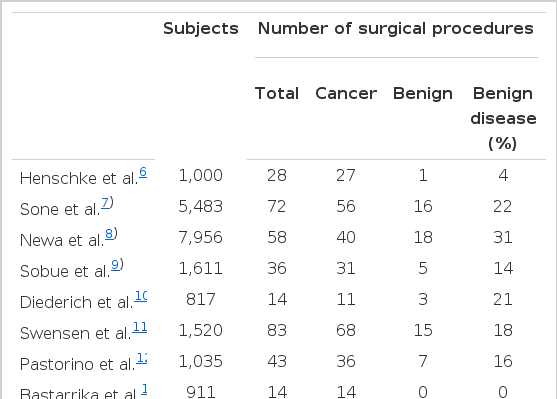
통제군 없이 관찰 시도를 한 저선량 CT를 이용한 폐암 검진의 연구결과에서 폐암의 유병율(prevalence)은 0.3~2.3%로 보고되며, 이는 검진 대상의 연령과 비흡연자 포함 여부에 따라 차이를 보인다(표 1)6-18,20). 그 후 검진에서는 폐암의 발생은 약 2~3배 정도 감소한다. 제 1병기의 폐암은 처음 기준 저선량 CT에서는 55~85%, 일년 후 추적검사에서 60~100%이다. 우리나라 정 등의 보고에 의하면 45세 이상의 대상군 6,406명 중 23명(0.36%)이 폐암으로 진단되었고, 이 중 62%가 제 1A병기였다14).
뉴욕 코넬대를 중심으로 전세계 여러 기관이 협조하여 형성된 I-ELCAP은 31,567명의 참가자 중 412명의 임상적 제 1병기 폐암 환자에서 수술받은 302명의 생존율이 92%이고, 8명의 치료받지 않은 환자 모두가 5년 내 사망하였으며 매년 CT 검진으로 치료 가능한 폐암을 발견할 수 있다라고 보고하였다17). Sone 등은 저선량 CT가 침습적인 치료를 되도록 적게 하면서도 폐암의 10년 생존율을 호전시킨 것으로 보이며 그들이 보고한 폐암 중 약 13% 정도가 과잉진단(over-diagnosis)일 수 있고, 17%의 환자에서 치료 실패를 보였다고 보고하였다21). Bach 등은 저선량 CT로 폐암의 진단과 치료율을 증가시켰으나 진행된 폐암이나 폐암에 의한 사망의 위험은 의미있게 감소시키지 못했다고 보고하였다22).
이러한 관찰 연구는 병기의 분포와 검진한 대상의 생존에 대한 정보는 제공하지만 질병 특이적 사망률을 알기에는 불충분하며 검진 시 생존율은 lead time, length time, overdiagnosis bias 등 여러 통계적 편향(bias)에 의해 영향을 받는다23). Lead time bias란 대상군에서 질병이 조기에 발견되었기 때문에 더 오래 생존하는 것처럼 보이지만(lead-time) 실제로 대조군과 사망하는 시간은 다르지 않음을 말한다. 단지 대상 환자가 좀 더 오랜 기간 동안 환자로 살게 된다. 이는 암이 조기에 발견되었어도 시술이 질병의 자연 경과에 영향을 주지 못하였을 때 발생한다. Length time bias는 질병을 발견할 가능성은 종양의 성장율과 관계된 것으로, 빨리 자라는 종양은 잠재적인 검진기간이 짧고(발견 가능 시기와 증상 발현의 간격), 따라서 검진을 짧은 기간에 반복하지 않는 한 이러한 환자는 증상이 생겼을 때 발견될 확률이 높다. 천천히 자라는 종양은 좀더 긴 잠재적 검진 기간을 갖고 있으며, 증상이 없을 때 발견될 확률이 높다. 따라서 천천히 자라는 종양이 검진에서 많이 발견되어, 마치 생존율이 증가한 것처럼 보일 수 있다. Overdiagnosis bias는 length time bias의 극단적인 예로, 검진 대상군에서 아주 천천히 자라는 종양을 발견함으로 폐암 환자 수와 생존율이 증가한 것처럼 보이는 것을 말한다. 그러나 사망율에는 영향이 없고 대조군에서 폐암이 있더라도 환자의 생존에 영향이 없이 평생 발견되지 않은 채 사망하게 된다.
이러한 편향을 배제하고 저선량 CT가 폐암 검진에 유용한 방법인지 증명하기 위해서는 무작위 추출 통제 실험(randomized control trials, RCT)이 필요하다.
2. 무작위 추출 통제 실험(Randomized Control Trials, RCT)
현재 미국과 유럽에서 저선량 CT의 폐암 검진에서의 유용성을 증명하기 위해서 여러 RCT가 진행 중이다(표 2)20,24-31). 미국에서 약 53,000명을 대상으로 시행중인 National Lung Screening Trial은 2006년에 등록을 마쳤으며, 90% 통계력으로 저선량 CT군에서 폐암 사망률을 20% 이상 감소를 보고자 하였고, 현재 추적검사 중이며 2011년에 그 결과가 나올 것을 기대하고 있다26). 단기간의 추적검사에 의하면 RCT의 결과가 저선량 CT군에서 기대했던 것만큼 폐암 사망률을 낮추지 못했고 장기간의 추적검사가 필요하다.
저선량 CT 폐암 검진의 문제점
1. 위양성 결절
검진은 그 질환에 대한 고위험군의 대상이 무증상일 때 그 질병을 찾아내는 검사를 적용하는 것을 말한다. 검진은 확진이 아니라 질환이 있음을 배제하거나 질환이 의심되는 대상에서 확진을 위한 검사로 유도하는 정보를 제공하는 것이다. 따라서 효과적인 검진 방법은 매우 민감해야 하고 특정 질병에 대하여 최소한 중간 정도의 특이도가 있어야 한다. 검진에서 양성으로 판명되면 진단을 위해 조직검사 등 침습적인 검사를 시행해야 하므로 검진 방법은 위양성으로 판명되는 경우가 적어야 한다. 이러한 위양성의 결과로 대상은 불안하게 되고 확진을 위해 조직 검사 같은 침습적인 진단을 시행하여야 하며 이에 따른 합병증과 추가 비용이 발생한다. 저선량 CT로 비석회화 결절의 발견은 20~50% 정도이며 여기서 발견되는 결절의 90% 이상이 양성(benign)이다(표 3)6-18,21). 저선량 CT의 관찰 연구에서 비석회화 결절을 침습적인 진단 과정까지 가게 된 경우는 약 17~22% 정도이다.
2. 서서히 자라는 종양의 과잉진단
천천히 성장하는 질환의 발견과 치료를 과잉진단이라 부르며, 이는 흉부 X-선 검진에서 절제술의 빈도와 제 1병기 폐암의 부분이 증가했음에도 폐암으로 인한 사망률을 낮추지 못한 결과를 설명할 수 있는 하나의 원인이다32). 1983년부터 1987년 SEER 데이터에 의하면 선암은 32% 정도인데 저선량 CT 검진 연구에서 선암이 70% (55~95%)로 보고되는 것을 보면 과잉진단을 의미하는 것으로 생각할 수 있다33,6-18). CT 검진에서 발견된 선암의 대부분이 BAC 부분을 포함하고 있으며 이러한 선암의 5년 생존률이 매우 높으며 BAC 부분을 포함하는 선암의 갑작스러운 빈도 증가는 담배 소비 역학으로만 설명하기는 어려운 부분이 있어서 CT 검진이 서서히 자라는 질환을 과도하게 발견하는 경향이 있음을 시사한다21).
3. 실제 임상에서의 폐암 검진
폐암 검진의 효용성이 증명되지 않고 폐암 검진을 권장하고 있지 않음에도 불구하고 실제로 해마다 흉부 X-선 검사를 시행하는 경우가 많으며, 많은 병원의 검진센터에서 폐암의 조기 발견을 목적으로 저선량 CT를 시행하고 있다.
수검자에게 알려주어야 할 사항들은 1) 폐암 검진의 유용성을 증명하기 위한 연구가 진행 중이고 아직까지 증명된 방법은 아니다라는 것을 알려 주어야 할 것이다. 2) 관찰 연구의 결과는 흡연자인 고위험군에서 폐암이 더 많이 발견되며 치료 가능한 상태인 제 1병기에서 발견되는 경우가 많았다. 3) CT 검진에서 발견된 비석회화 결절들 중에 폐암으로 발견되는 경우는 매우 적다. 4) 이러한 결절을 평가하는데 있어 진행되는 침습적인 검사들은 비용을 유발하고 또한 심각한 합병증을 일으킬 수 있다. 5) 이러한 검사를 하는데 있어서 경험이 많은 전문가가 하는 것이 적절한 결과를 얻을 수 있다. 6) 흡연자에게는 금연이 그들의 건강 증진을 위해 가장 효과적인 방법이다. 7) 폐암을 절제한 후에도 다른 폐암이 생길 위험성은 있다는 것 등이다34).