병발된 그레이브스병과 중증근무력증 환자에서 진단된 모야모야병 1예
A case of Graves' disease associated with myasthenia gravis and complicated with moyamoya disease
Article information
Abstract
중증근무력증과 그레이브스병이 동시 발병한 30세 여자 환자에서 대뇌허혈 증상 발생으로 모야모야병을 진단하고 항갑상샘 약물치료와 혈관문합술을 시행한 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다. 중증근무력증의 근위약과 모야모야병에 의한 대뇌허혈 증상을 예방하기 위해 동반된 그레이브스병에서의 갑상샘기능 안정화가 중요한 치료 전략으로 고려되어야 한다.
Trans Abstract
Moyamoya disease (MMD) is a cerebrovascular disorder characterized by bilateral stenosis or occlusion of the terminal portions of the internal carotid arteries. MMD is also accompanied by typical net-like collateral vessels in the basal ganglia. Although the etiology of MMD remains unknown, hereditary, immunogenic, and hemodynamic factors have been implicated as underlying mechanisms of MMD. Here, the authors report on one patient with a rare combination of Graves' disease-associated thyrotoxicosis, myasthenia gravis, and MMD, where cerebrovascular ischemic events occurred during a thyrotoxic state. (Korean J Med 79:195-200, 2010)
서 론
모야모야병은 속목동맥(internal carotid artery) 말단부에 협착, 폐색의 양상이 나타나는 폐쇄성 뇌혈관 질환의 일종으로, 속목동맥 끝부분이 막혀서 뇌기저부에 아지랑이처럼 수많은 가는 비정상 혈관이 만들어지는 병이다1,2). 모야모야병의 원인은 잘 알려져 있지 않으며, 더욱이 후천성인지 선천성인지에 대하여도 논란이 되고 있을 뿐만 아니라, 시상하부-뇌하수체 기능이상, 다운증후군과 같은 다양한 질환과 동반될 수 있음이 보고되었다2).
그레이브스병은 갑상샘자극호르몬(TSH) 수용체에 대한 자가항체가 갑상샘을 자극하여 갑상샘과다증(hyperthyroidism)을 초래하며, 여성에서 더 호발하는 자가면역 질환이다. 갑상샘과다증에서 치매, 우울증, 불안, 신경과민과 같은 다양한 신경정신 소견을 보일 수 있을 지라도 대뇌허혈발작이 동반되는 경우는 매우 드물다. 저자들의 문헌고찰에 의하면 그레이브스병과 모야모야병의 동시 발생은 드물며 국내에서도 몇몇 증례 보고만 있다3-9). 또한, 국내외 문헌고찰에서 그레이브스병과 중증근무력증이 병발된 환자에서 모야모야병을 진단한 증례는 현재까지 없다. 이에 저자 등은 그레이브스병과 중증근무력증이 병발된 환자에서 우측 상하지의 감각이상이 발생하여 모야모야병을 진단받은 1예를 경험하였기에 문헌고찰과 함께 보고하고자 한다.
증 례
환 자: 박○○, 30세, 여자
주 소: 1주일 전부터 심한 두통, 우측 상하지의 저린감
현병력: 내원 18개월 전 걷거나 계단을 오를 때 근력저하, 양측 안검하수와 심계항진을 보여 시행한 검사에서 그레이브스병과 동시에 병발한 중증근무력증의 진단(표 1)받고 prednisolone 일일 60 mg, pyridostigmine 일일 180 mg, methi-mazole 일일 20 mg 복용을 시작하였다. 항갑상선제와 항콜린에스테라제, 스테로이드를 투여한 후 근무력증과 갑상샘중독증 증상이 호전되어 가고 있었으나 내원 4개월 전 갑상샘과다증이 악화되었다. Prednisolone 일일 15 mg, azathioprine 일일 50 mg, pyridostigmine 일일 180 mg, methimazole 일일 20 mg 치료에도 불구하고 약물 복용에 대한 순응도 감소, 진행되는 근력저하와 불안정한 갑상선기능때문에 내원 8일 전 18 mCi로 방사성요오드(I131) 치료를 시행하였다.
과거력: 경구 피임제 등의 약물 복용 기왕력과 다른 특이소견 없었다.
가족력: 가족 중 특이한 병을 지닌 사람은 없었다.
신체 검사 소견: 내원 당시 혈압 130/80 mmHg, 맥박 100 회/분, 체온 37.2℃, 호흡수 19회/분이었고, 신장은 154 cm, 체중 50 kg, 체질량지수 21 kg/m2이었다. 의식은 명료하였고, 지남력장애는 없었으며 흉부 청진에서 호흡음 및 심음은 정상이었다. 전경부에서 갑상샘비대가 보였고, 청진시 잡음이 청취되었다. 동공 크기는 양쪽 모두 정상이었고, 직접 및 간접 대광 반사는 정상이었다. 안구 돌출은 보이지 않았고 양안 안검하수를 보이고 있었다. 흉부청진상 호흡음은 정상이었고, 심복부 검진에서 특이소견은 관찰되지 않았다. 신경학적 검사에서 근육의 운동기능은 정상이었으나 우측 상하지의 촉각과 통증 자극에 대한 감각저하를 보였다.
검사실 소견: 말초혈액검사에서 백혈구 3,900/mm3, 혈색소 13.2 g/dL, 혈소판 227,000/mm3이었다. 생화학검사는 혈액요소질소 10 mg/dL, 크레아티닌 0.6 mg/dL, 총 단백 5.8 g/dL, 알부민 3.8 g/dL, 아스카르트산아미노전이효소(AST) 34 IU/L, 알라닌아미노산전이효소(ALT) 42 IU/L, 알칼리인산분해효소 IU/L, 나트륨 141 mEq/L, 칼륨 4.0 mEq/L, 무작위 혈청 포도당이 90 mg/dL였다. 총 콜레스테롤 106 mg/dL, 트리글리세라이드 54 mg/dL , HDL-콜레스테롤 51 mg/dL이었으며 자가항체검사에서 류마티스 유사인자, 항핵항체, 항 cardiolipin 항체, anti-neutorphil cytoplasmic antidodies (ANCA)는 음성이었다. 소변검사에서 이상소견 보이지 않았다. 갑상샘기능 검사는 총 T3 9.77 ng/mL (0.8~2.2 ng/mL), 유리 T4 9.05 μg/dL (0.8~2.2 ng/dL), 갑상샘자극호르몬 0.17 μIU/mL (0.34~3.5 μ IU/mL)이었다.
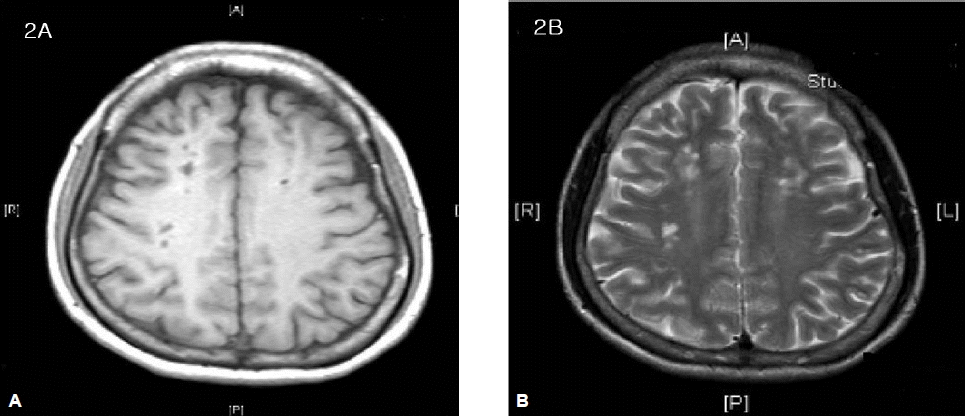
방사선 소견: 경부 및 흉부 X-ray는 정상이었고, 자기공명영상 촬영에서 양측 전두엽의 백질과 좌측 기저핵 부위에 만성 다발성 허혈성 경색 소견이 보였다(그림 1A, 그림 1B). 자기공명뇌혈관조영술에서 양측 내경동맥이 폐쇄, 전대뇌동맥과 중대뇌동맥의 협착 소견을 보이고 있고 주변에 전그물망과 같은 모야모야 혈관들이 보이고 있었다(그림 1C, 그림 1D).

Magnetic resonance (MR) imaging scans (A: T1-weighted scan, B: T2- weighted scan), showing cerebral infarction in the both frontal white matters and left basal ganglia. MR Cerebral angiograms (C: coronal view, D:sagittal view) , showing near total occlusion of the bilateral distal portions of internal carotid artery and invisualization of anterior cerebral artery and middle cerebral artery. Net-like moyamoya vessels are seen.
치료 및 경과: 환자는 뇌혈관 형태학적 변화를 일으킬 만한 다른 2차적인 요인이 보이지 않아 모야모야 혈관변화에 의한 일과성 허혈성 발작으로 의심하여 항혈소판제 등 보존적 약물 치료와 중증근무력증에 대하여 prednisolone 일일 15 mg, pyridostigmine 일일 180 mg 복용을 유지하였고, PTU 일일 200 mg 복용을 다시 시작하였다. 2주가 경과하면서 우측 상하지의 저린감은 호전되었다. 그러나 2개월 후 우측 상하지의 편마비(grade IV/V)와 보행장애가 발생하여 응급실을 통해 입원하였다. 입원 당시 PTU 일일 150 mg을 복용하면서 갑상선기능은 유리 T4 0.78 ug/dL (0.8~2.2 ng/dL), 갑상샘자극호르몬 0.11 μIU/mL (0.34~3.5 μIU/mL)이었다. 두번째 뇌허혈증상 발생시 자기공명영상 촬영에서는 좌측 마루관자뇌(temporoparietal lobe)과 좌측 이마엽(frontal lobe)에 급성 열공경색 소견이 보이고 있었다(그림 2). 허혈발작의 위험을 줄이기 위하여 타병원에서 좌측 두개내외 혈관 문합술(intra-extracranial arterial bypass)을 시행하였다. 수술 24개월 후에 우측 상하지의 운동기능은 호전(grade V/V)되었으나 우측 발목 관절의 구축으로 보행장애는 남아 있다. 마지막 허혈발작 후 30개월 동안 대뇌허혈증상의 재발은 없었으며 항갑상샘 약물복용없이 정상 갑상샘기능을 유지하고 있다. 갑상샘기능의 추적검사와 함께 일일 pyridostigmine 180 mg 복용으로 중증 근무력증 증상의 악화없이 현재 외래에서 추적관찰 중이다.
고 찰
모야모야병은 1963년에 일본에서 최초로 보고되었으며1), 대뇌에 혈류를 공급하는 내경동맥이 대뇌 기저부에서 양측으로 협착 또는 폐쇄되고 기저핵(basal ganglia)으로 그물망과 같은 부행혈관(collateral vessel)이 형성되는 만성 진행성 혈관질환이다. 아직도 그 원인은 밝혀지지 않고 있으며 후천성인지 선천성인지에 대해서도 계속적인 논란이 있지만, 일본과 한국 등에서 다발되는 것과 유전적질환, 예를 들면 낫적혈구 빈혈, Fanconi 빈혈, Von-Recklinghausen씨 병들과 관련되어 나타난다는 점 그리고 가계 내에서 비특징적으로 발현된다는 점 등은 유전적 소인이 있음을 간접적으로 보여주고 있다10). 후천성 병인을 뒷받침하는 가설로 면역학적 기전에 의하여 내경 동맥의 원위부에 단계적 폐색이 진행된다는 보고가 있으며, 임상적으로는 국소 염증성 질환 및 전신 감염과의 관련성이 보고되었고, 실험적으로 성장인자 및 사이토카인과의 관련성이 보고되었다11,12).
지금까지 그레이브스병과 병발한 모야모야병에 대한 보고가 드물게 있었고, 그레이브스병에 의한 갑상샘중독증과 관련하여 모야모야병의 병인을 유추해내려는 노력이 있었다. 원인과 결과의 상관관계는 아직 불명확하나 이 경우에서 몇 가지 고려해 볼 수 있는 사항이 있다. 첫째로, 모야모야병에서 나타나는 세포의 증식 및 혈관의 이상조절(dysregulation)과 그레이브스병에서 보이는 갑상샘에 대한 면역학적 자극이 T임파구의 이상조절을 포함하는 공통의 병리학적 관련이 있을 것이라는 주장이 있다7). 갑상샘 자가면역질환에서 출현하는 림프구세포독성(lymphocytotoxic) 항체들로 인해 항원-연관 억제 T-세포 기능에 결손을 초래할 수 있다13). Utku 등은 그레이브스병에서 발생한 모야모야 유사 혈관염 변화가 스테로이드와 혈장반출술(plasmapheresis)로 갑상샘자가 항체 제거 후에 점차적으로 호전됨을 보고한 바 있다14). 두 번째로 가능한 연관고리는 동맥경화증이다. Colleran 등15)은 유리 싸이록신이 호모시스테인, 메틸말로닉 산(methylmalonic acid)과 양의 상관관계가 있음을 증명하여 갑상샘중독증이 고호모시스테인혈증을 유발할 수 있다고 보고하였다. 고호모시스테인혈증은 동맥경화와 혈전을 유발하기 때문에 모야모야병의 병인으로 고려될 수 있다. 셋째로, 혈역학적인 인자로 연관지을 수 있다. Suzuki 등은 국소적인 교감신경의 자극이 내경동맥의 병적 변화를 초래할 수 있다는 가설을 제시하였다2). Sato 등은 모야모야병에서 상부 경부 신경절(ganglion)을 박리시킨 후에 대뇌혈류가 18.8% 증가했다고 보고했다16). 그레이브스병에 의한 갑상샘과다증은 교감신경 활성을 강화시키고 총경동맥의 경직도(stiffness)를 증가시키는 것으로 알려져있다17). Kushima 등은 Suzuki의 보고를 바탕으로 갑상샘과다증에서 갑상선호르몬이 교감신경계의 민감도를 증가시키고 결과적으로 비정상적인 혈관형성을 촉진시킬 수 있다고 하였다4).
그러나 이 두 질환이 단지 부대징후(epiphenomena)로써 우연히 병발하고 있는 것으로 생각할 수도 있다. 병인론적으로 연관성이 없이 병발하고 있다가 무증상의 모야모야병의 환자가 갑상샘중독 상태에서 뇌졸중이 발생한 것으로 생각할 수 있을 것이다. 임상적인 관점에서는 공통 병인에 대한 접근 외에 모야모야병에 의한 허혈성 발작을 예방하고 치료하는 것이 중요하다. 모야모야병은 주요 대뇌 동맥의 진행성 협착에 의한 대뇌혈류 흐름의 결손을 부행혈관이 보상하지 못했을 때 증상이 나타난다. 일반적으로 과환기를 유발하는 활동에 의해 뇌허혈 증상이 촉발된다. 갑상샘중독증과 모야모야병이 함께 있는 경우에 있어서3-9), 뇌허혈 발작은 갑상샘중독증에 의해 악화되었고, 갑상샘기능의 정상화가 이러한 허혈 증상을 호전시켰다4,7,8). 갑상샘과다증 치료 초기 혹은 재발로 갑상샘호르몬이 상승되어 있거나 방사성요오드치료 등으로 과다한 갑상샘호르몬에 갑작스럽게 노출되었을 때 급성 허혈성 발작이 발생하였다. 본 증례의 경우도 항갑상샘 약물을 중단하고 방사성요오드 복용 후 갑상샘조직의 파괴로 인한 급격한 갑상샘호르몬 상승(surge)이 뇌허혈 증상을 발생하게 한 방아쇠(trigger)로서 작용했을 것으로 생각된다(그림 3). 갑상샘중독증에 의한 뇌혈류의 혈류역학적 변화와 갑상샘과다증에 기인한 과응고성(hypercogagulability)이나 심방세동에서 발생한 색전이 뇌허혈 발작에 영향을 줄 수 있을 것이다19,20). 또한 과다한 갑상샘호르몬은 간, 심장뿐 아니라 대뇌에서의 대사와 산소소비를 증폭시켜 대뇌 혈류예비능(reserve capacity)이 감소된 모야모야병 환자의 경우 대뇌 혈류 장애를 초래한다7).
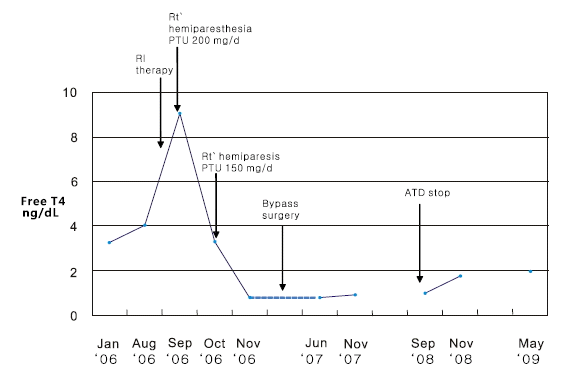
Relation between cerebrovascular accidents and thyroid status of the patient. RI therapy, radioiodine therapy; ATD, antithyroid drug.
그레이브스병을 동반한 모야모야병의 경우 갑상샘호르몬의 갑작스런 상승을 피하는 것이 뇌졸중을 예방하는 가장 좋은 방법이다. 항갑상샘 약제의 복용으로 갑상샘기능을 안정화시키는 것이 필요하다. Tendler 등은 준완전갑상샘절제술(subtotal thyroidectomy)이 빠른 치료효과를 얻을 수 있기 때문에 모야모야병을 동반한 경우 갑상샘과다증의 안전한 치료 전략이라고 하였다7). 그러나 이 치료법은 갑상샘절제술과 연관된 합병증과 수술 후에도 갑상샘과다증이 재발할 수도 있다는 것이 제한점이다. 본 증례의 경우 갑상샘과다증이 중증근무력증에 의한 사지 근력약화를 악화시킨다고 생각하여 항갑상샘 약물 복용 중 갑상선절제술을 권유하였으나 중증근무력증이 병발된 예에서는 갑상샘절제술의 수술 사망률이 높기 때문에 방사성요오드 치료를 시도하게 되었다. 모야모야병 환자에서 방사성요오드 치료가 고려되어 진다면 갑상샘염의 조기진단과 처치를 위한 각별한 추적관찰이 필요하겠다.
모야모야병에 대한 치료방법으로는 임상관찰, 약물요법 및 수술요법 등이 있으나 임상관찰 및 약물치료로는 이 질환의 진행을 막을 수 없기 때문에 직접법 및 간접법 등 재관류수술법이 유일한 치료방법이라고 할 수 있다. 이와 같은 재관류수술의 목적은 효과적인 재관류로 뇌허혈 증상을 개선시키고 나아가서 모야모야 혈관의 혈류량을 줄임으로써 출혈을 예방하는 데 있다. 임 등8)은 모야모야병과 조절되지 않은 갑상샘과다증을 동반한 뇌졸중의 고위험군의 경우 혈관조영술이나 SPECT에서 심한 대뇌 관류장애와 대뇌 혈관예비능이 감소되어 있는 환자라면 재관류수술법이 필요하다고 하였다. 즉, 갑상샘기능의 조절과 함께 이러한 혈관문합술이 잠재적인 뇌졸중 위험을 줄이는 데 효과적이라는 것이다. 그러나 수술 전후 조절되지 못한 갑상샘기능에 의해 재관류수술과 연관된 뇌졸중이 발생한 증례도 함께 보고되었으므로 수술 전후에 안정된 갑상샘호르몬 유지가 중요하겠다. 본 증례에서는 갑상샘기능이 안정화된 후 뇌혈관 문합술이 시행되었고, 수술 전후 뇌허혈 증상은 없었다.
결론적으로, 그레이브스병과 모야모야 형태의 혈관 변화는 동시에 일어날 수 있다. 이러한 두 가지 병태가 유전적 그리고 면역학적인 공통병인을 가지는지, 단순한 부대징후(epiphenomena)인지, 분자 모방(mimicry)의 결과인지는 좀 더 연구가 필요할 것이다. 고찰된 환자수가 적은 제한점이 있지만, 두 질환이 동시에 발생했을 때 갑상샘호르몬의 급상승은 피하는 것이 좋을 것으로 생각된다. 갑상샘기능악화의 재발을 막기 위한 장기간 관해 치료가 대뇌허혈 증상의 악화를 예방하기 위해 중요하며, 반대로 모야모야병의 추적관찰 중 대뇌허혈 증상 재발이나 악화시 갑상샘기능이상 동반 여부가 고려되어야 한다.