무증상 제2형 당뇨병 환자에서 관상동맥석회 점수와 혈청 osteoprotegerin농도의 상관 관계
Association of serum osteoprotegerin with coronary artery calcification scores in patients with asymptomatic type 2 diabetes
Article information
Abstract
목적:
본 연구는 심혈관 증상이 없는 제2형 당뇨병 환자에서 불현성 관상동맥 죽상경화증의 유병률을 알아보고, 혈청 OPG 농도와 관상동맥석회 점수와의 상관관계를 분석하여 혈청 OPG가 관상동맥질환의 혈청 표지자로 이용될 수 있을지 알아 보았다.
방법:
심혈관 증상이 없는 제2형 당뇨병 환자 140명을 대상으로 MSCT를 이용하여 관상동맥석회 점수를 정량하고 혈청 OPG 농도를 측정하여 상관관계를 분석하였다.
결과:
심혈관 증상이 없는 제2형 당뇨병 환자에서 관상동맥 석회화는 67.1%에서 관찰되었다. 상관분석에서, 관상동맥 석회화 점수와 혈중 OPG농도는 양의 상관관계를 보였으나, 다변량 회귀분석에서는 허리둘레(p=0.003), 당뇨병의 유병기간(p=0.005), 혈청 creatinine 농도(p=0.011)가 관상동맥 석회화의 유의한 독립변수로 나타났으며, 혈청 OPG 농도(p=0.082)는 제외되었다.
결론:
심혈관 증상이 없는 제2형 당뇨병 환자에서 관상동맥 석회화는 흔하게 관찰되며, 혈청 OPG 농도는 관상동맥석회 점수에 비례하여 증가하나, 관상동맥석회 점수의 독립적인 위험인자가 아니므로, 관상동맥 석회화를 반영하는 혈청 지표로 이용될 수는 없을 것으로 생각된다.
Trans Abstract
Background/Aims:
Osteoprotegerin (OPG), a member of the tumor necrosis factor (TNF) receptor superfamily, is involved inbone metabolism and vascular calcification. However, the relationship between serum OPG levels and coronary calcification is notwell elucidated. The present study investigated whether serum OPG levels are associated with coronary artery calcification scores (CACs) in patients with type 2 diabetes.
Methods:
A total of 140 type 2 diabetic outpatients without previous evidence of clinical cardiovascular disease were recruited. CACs were obtained using multi-slice spiral computed tomography and categorized as minimal (0), mild (1-99), moderate(100-399), or severe (≥ 400). Serum OPG levels were measured by enzyme-linked immunosorbent assay.
Results:
A total of 94 of 140 (67.1%) patients with type 2 diabetes showed coronary calcification. A Pearson’s correlation analysisshowed a positive correlation between serum OPG levels and CACs. However, multivariate regression analyses revealed that waistcircumference, duration of diabetes, and serum creatinine concentration were significant independent determinants of CACs.
Conclusions:
The present study demonstrates that coronary calcification is common (67.1%), and serum OPG levels are correlatedwith CACs but are not an independent determinant of CACs in patients with asymptomatic type 2 diabetes. (Korean J Med79:163-170, 2010)
서 론
제2형 당뇨병 환자에서 심혈관 질환은 높은 유병률과 함께 주요한 사망원인 중의 하나로 알려져 있다1). Haffner 등2)은 역학연구를 통해 제2형 당뇨병 환자의 심근경색 발생 위험 및 사망률이 심근경색을 이미 경험한 일반인과 동등하다고 보고한 바 있다. 또한 제2형 당뇨병 환자에서는 무증상 심근 허혈 질환의 발생률이 높으며1,3,4), 이를 선별할 수 있는 검사방법으로, 관상동맥에서 관찰되는 석회를 전산화단층촬영을 이용하여 측정하는 방법이 널리 이용되고 있다. 관상동맥 석회화는 전자선 전산화단층촬영(electron-beam computed tomography)이나 다중박편 나선형 전산화단층촬영(multi-slice spiral computed tomography, MSCT)을 통해 정량화할 수 있는데, 이를 이용하여 얻은 관상동맥석회 점수(coronary artery calcification score, CACs)는 죽상경화반의 유무 및 중증도, 심근경색의 위험을 반영하고, 대규모 역학연구에서 심혈관 질환의 독립적인 위험인자로 알려져 있다5-7).
혈관석회화의 발생과 진행에는 고지혈증이나 고혈압, hs-CRP (high sensitivity C-reactive protein)와 같은 심혈관 질환의 전통적인 위험인자 외에 fetuin-A (α2-Hereman-Schmid Glycoprotein, AHSG)와 같은 석회화 억제 단백질이나 osteoprotegerin(OPG)과 같은 골 대사 관련 물질들이 혈관석회화와 밀접한 상관관계를 보인다는 사실이 알려지면서 죽상경화증의 발생과 진행에서 비전통적 위험인자들이 상당한 역할을 하고 있는 것으로 생각되고 있다8). 관상동맥석회 점수는 이러한 여러 인자들의 종합적 영향으로 만들어지는 죽상경화반의 칼슘을 측정하는 것이므로 유전적, 혈청학적 영향을 전체적으로 반영하는 임상적으로 유용한 지표로 생각된다.
OPG는 종양괴사인자 수용체(tumor necrosis factor receptor) 상과(super-family)에 속하며 골 재형성 과정에서 핵심적인 역할을 하는 단백질로9), 파골세포의 분화 및 활성화 물질로 알려진 RANKL (receptor activator of nuclear factor ΚB ligand)의 작용에 길항하는 유인 수용체(decoy receptor)로 작용해 파골세포의 분화와 성숙을 억제하는 작용을 한다10). OPG가 혈관석회화 과정에 관여한다는 증거로는 여러 실험 연구와 역학 연구들이 있는데, 실험동물에서 OPG 유전자를 결손시키면 대동맥과 신장 동맥혈관이 석회화되고, 골다공증이 유발되며11), 반대로 OPG 유전자를 과발현시켰을 경우 석회화가 예방되었다12). 사람을 대상으로 한 역학연구13)에서는 혈청 OPG 농도의 증가가 관상동맥 질환의 존재 및 중증도와 상관관계가 있다고 보고된 바 있다.
제2형 당뇨병 환자에서 혈청 OPG 농도와 혈관석회화의 상관성을 분석한 연구들에서는 혈청 OPG의 증가가 혈관석회화와 밀접한 상관관계가 있다고 이미 보고된 바가 있다14). 우리나라에서도 혈청 OPG 농도와 혈관석회화의 상관관계를 분석한 연구들이 있으나 일반 인구집단을 대상으로 하거나15), 제2형 당뇨병 환자를 대상으로 한 경우에도 관상동맥이 아닌 대동맥의 석회화를 석회화의 표지자로 하여 분석한 연구16)들이어서 관상동맥 죽상경화증과의 직접적인 관련성을 증명하기에 제한점이 있었다.
본 연구는 위와 같은 배경에서 심혈관 증상이 없는 제2형 당뇨병 환자를 대상으로 MSCT를 이용하여 관상동맥석회 점수를 정량하고 혈청 OPG 농도를 측정하여, 이들 환자에서 불현성 관상동맥 죽상경화증의 유병률을 알아보고, 혈청 OPG 농도와 관상동맥석회 점수와의 상관관계를 분석하여 혈청 OPG 농도가 관상동맥 질환의 혈청 표지자로 이용될 수 있을지 알아보았다.
대상 및 방법
1. 연구 대상
2007년 3월부터 동년 7월까지 강원대학교병원 내분비내과 외래를 방문한 제2형 당뇨병 환자에서 연구의 목적과 과정에 대해 설명을 듣고 연구에 참여할 것을 동의한 150명의 환자를 대상으로 연구를 시행하였다.
제2형 당뇨병의 진단은 1997년에 제정된 미국당뇨병학회의 진단기준에 따랐으며, 연구 참여 당시 30세 이상이며 당뇨병으로 진단된 지 1년 이상 경과한 환자를 대상으로 하였다. 진단 당시부터 인슐린을 사용하였거나 케톤산혈증의 병력이 있는 경우는 제1형 당뇨병으로 간주하여 제외하였으며, 전형적인 허혈성 심질환의 증상이 있거나 과거에 심혈관조영술이나 심혈관중재술을 받은 경우는 이미 확립된 심혈관질환을 가진 것으로 보아 연구에서 제외하였다. 만성 간질환이나 혈청 creatinine이 2.0 mg/dL 이상인 만성 신장질환, 만성 폐쇄성 폐질환, 만성 관절염 등의 만성 질환이 동반된 경우도 연구에서 제외하였으며, 갑상선기능항진증, 갑상선 기능저하증, 쿠싱증후군 등과 같은 내분비 질환이 동반된 경우도 연구에서 제외하였다.
본 연구는 강원대학교병원 임상연구위원회(IRB)의 승인을 받았으며 150명의 환자가 본 연구에 동의하였고 이들로부터 문서화된 동의서를 받았다. 150명의 환자 중에서 연구에 동의한 후 검사를 받지 않은 8명과 갑상선 기능저하증과 특발성 부갑상선기능저하증이 연구 종결 후 확인된 2명을 제외한 140명의 환자를 대상으로 결과를 분석하였다.
2. 연구 방법
모든 환자에서 문진 및 신체검사를 시행하였고 의무기록지를 조사하였다. 심혈관질환 유무, 흡연력, 당뇨병의 유병기간을 조사하였고, 신장과 체중을 측정하여 체질량지수를 구하였으며, 대상자의 허리둘레를 측정하였다. 환자의 혈압은 자동화된 혈압 측정기(Omrom, HEM-780)를 이용하여 안정 상태에서 5분 간격으로 2회 측정하였고, 평균값을 분석에 이용하였다. 관상동맥 석회화 점수(Coronary artery calcium score, CACs)는 MSCT (LightSpeed Plus, GE Medical Systems, Milwaukee, USA)를 이용하여 면적과 부피 모두를 측정하였으며 이 중 부피로 측정한 값을 통계처리에 이용하였다.
혈액 채취는 8시간 이상 공복 후 일반화학검사, 혈청 지질검사를 시행하였고, 혈청 hs-CRP와 혈청 OPG 농도를 측정하였다. hs-CRP는 최하 0.01 mg/dL까지 검출할 수 있는 Latex agglutination법(Denka, Tokyo, Japan)으로 측정하였는데 급성 염증성 질환에 이환된 경우 1개월 이내의 검사치는 분석에서 제외하였다. 혈청 OPG 농도는 상업화된 ELISA 키트(Oscotech, Seoul, Korea)를 이용하여 측정하였고, 시험 내(intra-assay) 변이계수(Coefficient of variance, CV)는 4.8~8%, 시험 간(inter-assay) 변이계수는 4.3~5.6%이었다.
3. 통계 분석
모든 측정값은 평균±표준편차 또는 중앙값과 범위로 표시하였다. 관상동맥 석회화 점수(CACs), 당뇨병의 유병기간, 혈청 중성지방, hs-CRP, 미세알부민뇨는 비정규 분포를 보이므로 로그 변환하여 분석하였다. 이 과정에서 CACs가 0인 경우 로그 변환을 시행하면 결측치로 처리되어 분석에서 누락되므로 CACs에 1을 더한 값을 로그 변환하여 통계분석에 이용하였다.
CACs와 혈압, 혈청 creatinine, 혈청 OPG 농도 등 여러 변수들 간의 상관관계는 Pearson 단순상관분석을 이용하여 알아보았다. 다변량 회귀분석은 CACs를 종속변수로 하고, Pearson 단순상관분석에서 유의한 상관관계를 보였던 연령, 당뇨병 유병기간, 허리둘레, 맥압, 혈청 creatinine, 혈청 OPG 농도를 입력변수로 하여 분석하였으며 입력 선택방법(enter selection)을 사용하였다. 또한 연구 대상자들을 Rumberger 등17)의 제안에 따라 CACs가 0인 경우(최소), 1~99인 경우(경미), 100~399 (중등도), 400 이상(중증)으로 분류하여 분석하였다. 최소 또는 경미한 경우 폐쇄성 관상동맥 질환이 있을 가능성이 낮고, 중등도인 경우는 관상동맥 질환의 동반 가능성이 비교적 높으며, 중증인 경우는 심하고 광범위한 관상동맥 질환이 있음을 의미한다. CACs 분류에 따른 임상적, 생화학적 인자들의 비교는 일원배치 분산분석(one-way ANOVA)을 이용하여 검증하였다. 통계처리는 SPSS 12.0 소프트웨어를 사용하였고, 모든 통계치는 양측 검정으로 p-value가 0.05 미만일 때 유의한 것으로 판정하였다.
결 과
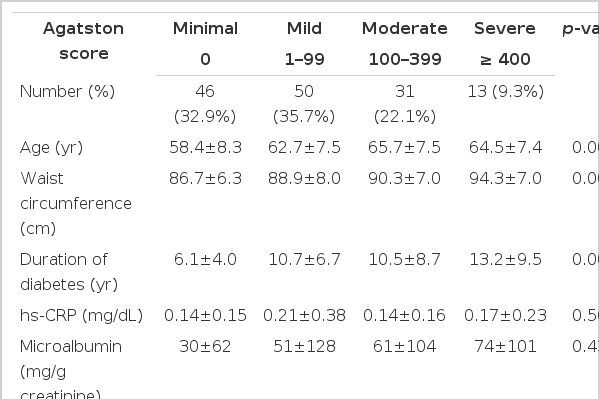
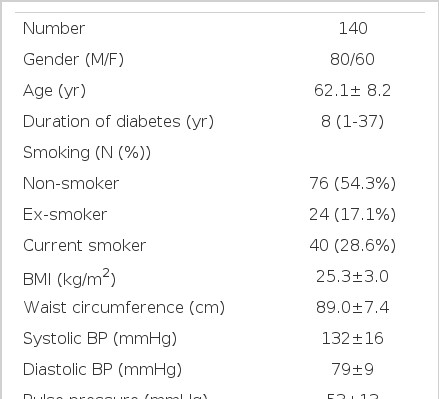
대상자의 나이는 평균 62.1±8.2세였으며, 당뇨병의 유병기간은 평균 9.4±7.1년이었다. 혈청 OPG 농도의 평균값은 634±370 pg/mL이었으며, CACs의 중앙값은 16.50 mm3 (사분위수 0.00-128.75)이었고, 전체 140명의 연구대상자 중 94명(67.1%)에서 혈관석회화가 관찰되었다. Rumberger 등17)의 제안에 따라 대상자를 관상동맥석회 점수가 0인 경우(최소), 1~99인 경우(경미), 100~399인 경우(중등도), 400 이상인 경우(중증)로 나누었을 때 각각의 빈도는 최소 32.9%, 경미 35.7%, 중등도 22.1%, 중증 9.3%였다(표 4). 연구 대상자들의 자세한 임상적, 생화학적 특성들은 표에 나타내었다(표 1).
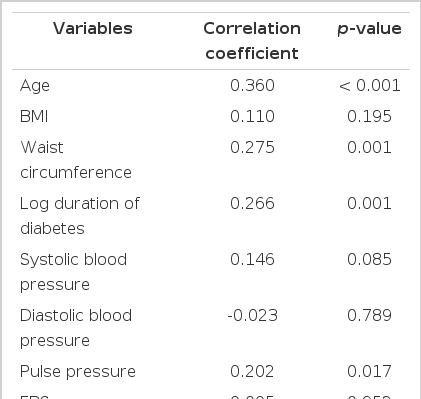
Pearson 단순상관분석에서 관상동맥석회 점수는 혈청 OPG 농도와 유의한 양의 상관관계(r=0.303, p<0.001)가 있었고, 연령(r=0.360, p<0.001), 당뇨병의 유병기간(r=0.266, p=0.001), 허리둘레(r=0.275, p=0.001), 맥압(r=0.202, p=0.017), 혈청 creatinine 농도(r=0.251, p=0.003)가 관상동맥석회 점수와 유의한 양의 상관관계가 있었다(표 2). 또한 Pearson 단순상관분석에서 혈청 OPG 농도는 연령, 당뇨병의 유병기간, 맥압과 유의한 양의 상관관계를 보였다(Data were not shown).
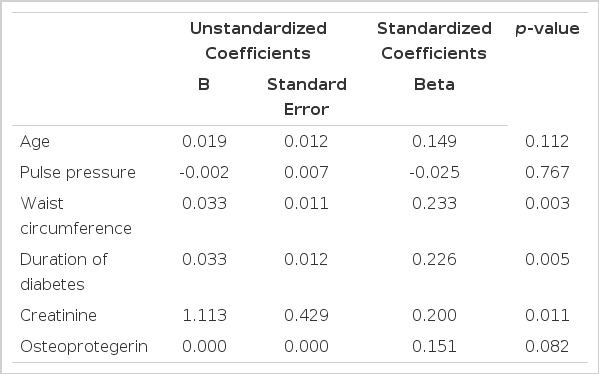
이상의 상관분석 결과에서 유의하게 나타난 변수인 연령과 당뇨병의 유병기간, 허리둘레, 맥압, 혈청 creatinine 농도, 혈청 OPG 농도를 입력변수로, CACs를 종속변수로 한 다변량 회귀분석에서는 허리둘레(p=0.003), 당뇨병의 유병기간(p=0.005), 혈청 creatinine 농도(p=0.011)가 유의한 독립변수로 나타났으며, 혈청 OPG 농도(p=0.082)는 CACs와 유의한 상관관계를 보여주지 않았다(p=0.0082).
대상자들을 Rumberger 등17)이 제안한 바와 같이 CACs에 따라 최소, 경미, 중등도, 중증의 4집단으로 나누어 임상적 특성을 비교하였을 때 중증 집단에서 연령, 허리둘레, 당뇨병의 유병기간, 혈청 creatinine 농도, 혈청 OPG 농도가 높게 나타났으며, HDL 콜레스테롤은 유의하게 낮았다(표 4).
고 찰
본 연구의 결과 관상동맥 석회화는 연구대상자의 약 2/3 에서 관찰되었고, 관상동맥석회 점수는 연령, 당뇨병의 유병기간, 허리둘레, 맥압, 혈청 creatinine 농도, 혈청 OPG 농도와 유의한 양의 상관관계를 보여주었다. 이 중 허리둘레, 당뇨병의 유병기간, 혈청 creatinine 농도는 다변량 회귀분석에서 관상동맥석회 점수의 독립적인 위험인자로 나타났으나 혈청 OPG 농도는 제외되었다.
제2형 당뇨병 환자에서 관상동맥 죽상경화증과 무증상 심근허혈의 유병률은 일반인구집단과 비교하여 상당히 높은 것으로 알려져 있다1,3,4). 일반인구집단에서 관상동맥 석회화의 유병률에 대해서는 최 등18)이 한국인 건강검진 수진자 1,000명을 대상으로 시행한 연구에서 18%라고 보고한 것이 있다. 제2형 당뇨병 환자에서 관상동맥 석회화의 유병률에 대해서는 최근 Rivera 등19)이 심혈관계 증상이 없는 한국인 제2형 당뇨병 환자 217명을 대상으로 시행한 연구에서 64%라고 보고하였다. 본 연구에서는 대상 환자의 67.1%에서 관상동맥 석회화를 관찰할 수 있었는데 Rivera 등이 보고한 것과 일치하는 결과로 생각된다.
이처럼 제2형 당뇨병 환자들에서 불현성 죽상경화증은 높은 유병률을 보이고 있으나 현재까지 심혈관 증상이 없는 당뇨병 환자들에 대한 적절한 선별검사나 치료방법에 대해 확립된 지침은 없는 상태이다. 현재 심혈관 증상이 없는 관상동맥 질환의 선별검사를 위한 방법으로 답차운동부하검사(exercise treadmill test), 부하 심초음파(stress echocardiography), 단일광자방출 전산화단층촬영(Single photon emission computed tomography, SPECT), 경동맥 내막-중막 두께 측정(carotid intima-media thickness, cIMT), 관상동맥석회 점수(coronary artery calcification score, CACs) 등의 방법들이 사용되고 있으며, 이 중 CACs는 관상동맥 질환과의 연관성이 잘 알려져 있고, 쉽게 정량화가 가능하며, 높은 민감도와 음성예측력을 가지고 있어 최근 많은 연구에서 활용되고 있다.
혈관석회화와 밀접한 관련을 가지는 것으로 알려진 혈청 OPG 농도는 장기간 혈액투석 치료를 받는 환자들에서 혈관석회화의 진행 정도, 관상동맥 질환의 존재 유무 및 중증도, 그리고 일반인 대상의 연구에서는 심혈관계 위험도와의 관련성을 보여주었다13,20,21). 심혈관 증상이 없는 제2형 당뇨병 환자를 대상으로 혈장 OPG 농도와 관상동맥 석회화와의 관계를 알아본 Anand 등의 연구14)에서는 OPG 농도의 상승은 불현성 죽상경화증과 심혈관계 합병증 발생의 예측인자라고 밝히고 있으며, 고위험군 환자에서 OPG 농도 측정이 심혈관계 위험도에 대한 적절한 평가에 도움을 줄 수 있을 것이라고 제안하고 있다.
하지만 본 연구에서 혈청 OPG 농도는 관상동맥석회 점수와 통계적으로 유의한 양의 상관관계가 있었으나 독립적인 위험인자로 나타나지는 않았다. 반면, 혈청 creatinine 농도가 독립적인 위험인자로 나타난 점은 흥미롭다.
투석 중인 말기 신부전증 환자를 대상으로 혈청 OPG 농도와 관상동맥석회 점수와의 상관관계를 분석한 김 등22)의 연구에서는 연구 대상자들의 혈청 OPG 평균 농도는 3,561±1,160 pg/mL였다. 이는 본 연구 대상자들에서 나타난 혈청 OPG의 평균 농도보다 약 5배 이상 높은 수치로, 본 연구에서 혈청 OPG 농도가 관상동맥석회 점수와 유의한 상관관계를 나타내지 못한 이유가 혈청 OPG의 농도가 혈관석회화에 영향을 미치기에는 그 농도가 매우 낮았을 가능성을 시사한다. 이는 본 연구에서처럼 비교적 신장기능이 정상으로 생각되는 환자에서는 혈청 OPG 농도가 혈청 표지자로서 사용하기에는 제한점이 있음을 보여주는 결과로 생각된다.
본 연구에서 혈청 크레아티닌이 증가하는 경우 관상동맥석회 점수와 밀접한 양의 상관관계를 나타내고 또 독립적 위험인자로 나타난 점은 특기할 만한 사실이다. 본 연구는 전향적 연구가 아닌 후향적 연구로서 인과관계를 증명할 수는 없으나, 신장 기능이 비교적 정상일 것으로 생각되는 혈청 크레아티닌 농도 2.0 mg/dL 이하인 경우에도 관상동맥 혈관석회화가 혈청 크레아티닌 농도와 밀접한 상관관계가 있는 반면, 심혈관 질환의 전통적 위험인자로 알려진 hs-CRP, 저밀도지단백 콜레스테롤, 혈압 등은 오히려 통계적으로 유의한 상관관계를 보여주지 못한 점을 생각할 때, 관상동맥 혈관석회화에는 신장 기능의 이상이 중요한 위험인자로 재평가되어야 함을 시사하는 결과로 생각된다. 이를 증명하기 위해서는 정상 신기능을 가진 제2형 당뇨병 환자를 대상으로 장기간에 걸친 전향적 연구가 필요할 것으로 생각된다.
한편, OPG는 형질전환 생쥐 연구12)에서 혈관 석회화를 억제하는 혈관보호인자의 역할을 하는 것으로 밝혀졌지만, 사람을 대상으로 한 여러 연구13,20,21)에서는 OPG 농도의 증가가 관상동맥 질환의 중증도와 관련되어 있어 사람과 동물에서 상반된 결과를 보여주고 있다. 심혈관 증상이 없는 제 2형 당뇨병 환자를 대상으로 한 정 등의 연구에서도23), 관상동맥혈관 석회화와 연관된 독립인자로 스타틴의 사용과 흡연, 그리고 동맥경화도를 측정한 맥파 혈류속도가 관련성이 있음을 보였으나, 혈청 OPG와의 연관성은 보이지 않았다.
이는 OPG가 혈관석회화의 원인 물질이 아닐 가능성을 생각해 보게 하는데, 연구자에 따라 혈청 OPG가 혈관 경직도의 상승 같은 혈관 질환의 진행에 대한 반응성 또는 방어적 인자로 과잉 분비되었을 가능성을 제시하고 있다24,25).
다변량 회귀분석에서 허리둘레, 당뇨병의 유병기간이 독립적인 위험인자로 나타났는데 이는 다른 역학연구26)에서 나타난 결과와도 일치하는 결과로 생각된다. 허리둘레의 증가는 중심성 비만을 시사하며 내장지방의 증가는 제2형 당뇨병에서 인슐린 저항성을 높이고 심혈관 질환 발생 위험을 높인다고 알려져 있다27).
본 연구의 제한점으로는 첫째, 본 연구는 횡단면적 연구로 관상동맥혈관 석회화에 영향을 미칠 것으로 추정되는 여러 위험인자들과의 상관관계만을 확인할 수 있었다. 둘째, 일개 병원 당뇨병 외래에 내원한 환자를 대상으로 실시한 연구로 한국인 제2형 당뇨병 환자 일반으로 확장하여 일정한 결론을 내리기에는 무리가 있을 것으로 생각된다. 셋째, 여성환자에서의 비스포스포네이트의 사용이나 에스트로겐 사용이 관상동맥혈관 석회화와 연관이 있을 수 있으나 이에 대한 자료가 없어 제한점이 있다.
이상의 연구 결과를 통해 관상동맥 혈관석회화는 연구대상자의 2/3에서 관찰되었으며, 허리둘레, 당뇨병의 유병기간, 혈청 creatinine 농도가 관상동맥 혈관석회화의 독립적인 위험인자임을 알 수 있었다. 혈청 OPG 농도는 관상동맥 석회화의 독립적인 위험인자는 아니어서 관상동맥 혈관석회화의 혈청 표지자로 이용할 수는 없을 것으로 생각된다.