특발성 폐섬유증 환자에서 폐 섬유모세포 증식의 클론성에 관한 연구
Clonality analysis of fibroblast proliferation in patients with idiopathic pulmonary fibrosis
Article information
Abstract
목적:
특발성 폐섬유증(Idiopathic pulmonary fibrosis, IPF)의 조직학적 소견인 usual interstitial pneumonia (UIP)는 섬유모세포 집단병소(fibroblast foci) 형성이 특징이다. 특발성 폐섬유증은 폐포염(alveolitis)으로 시작된 폐조직의 염증반응이 중요한 병인으로 여겨져 왔으나, 최근에는 폐 상피세포 손상에 대한 치유과정의 이상으로 처음부터 섬유화가 진행한다는 가설이 대두되었다. 본 연구는 특발성 폐섬유증환자의 섬유모세포 집단병소를 구성하는 섬유모세포가 신생물(neoplasm)과 같이 단일클론성(monoclonal) 증식을 하는지 여부를 검증하였다.
방법:
일곱 명의 특발성 폐섬유증 여자 환자에서 개흉폐생검을 통해 얻은 폐 조직의 파라핀 블록을 사용하여 현미해부(microdissection) 방법으로 섬유모세포 집단병소에서 증식된 섬유모세포들을 분리하였다. 단일클론성 검정의 양성대조로는 특발성 폐동맥 고혈압 환자에서 관찰되는 총상병변(plexiform lesion)내 ‘증식된 혈관내피세포’를 이용하였다. 클론성 분석은 인간 남성호르몬 수용체 유전자 메틸화 검사(human androgen-receptor gene methylation assay, HUMARA) 방법을 이용하였다. 현미해부로 얻은 조직을 proteinase K buffer 처리 후 제한 핵산내부가수분해효소(Restriction endonuclease) HhaI로 분해한 조직과 분해하지 않은 조직을 각각 중합효소연쇄반응(polymerase chain reaction, PCR)으로 증폭하였다. 증폭된 중합효소연쇄반응 생성물은 6% denaturing polyacrylamide sequencing gel로 전기영동 후 자가방사기록법(autoradiography)으로 분석하였다. 클론 비(Clonality ratio)는 검체의 대립유전자 불활성화 비(allele inactivation ratio)를 폐실질의 대립유전자 불활성화 비로 나누어 구하였다.
결과:
특발성 폐섬유증 일곱 예로부터 모두 24개의 섬유모세포 집단병소'에 대해 섬유모세포 증식의 클론성 분석을 시행하였다. 24개 병변의 클론 비는 0.70±0.18 (평균±표준편차) (범위 0.37~0.97)로 불균형 메틸화(unbalanced methylation, clonality ratio<0.25)를 보인 예는 없이 모두 다클론성이었다. 한편, 단일클론성의 양성 대조로 2예의 특발성 폐동맥 고혈압에서 10개의 총상병변내 내피세포의 클론성을 분석하였으며, 이 중 7개가 불균형 메틸화(clonality ratio<0.25)를 보여 단일클론성임을 확인하였다.
결론:
특발성 폐섬유증 환자 폐의 섬유모세포 집단병소를 구성하는 섬유모세포 증식은 다클론성임을 알 수 있었다. 즉, 특발성 폐섬유증 환자에서 폐 섬유모세포 증식은 창상치유에서와 같은 반응성과형성에 의한 것으로 여겨진다.
Trans Abstract
Background/Aims:
Idiopathic pulmonary fibrosis (IPF) is defined pathologically by usual interstitial pneumonia (UIP), and contains characteristic discrete areas of fibroblasts, myofibroblasts, and newly formed collagen, termed “fibroblast foci”. A new hypothesis postulates that IPF results from epithelial injury and abnormal wound repair without preceding chronic inflammation. We explored the hypothesis that fibroblasts in the fibroblast foci of IPF undergo neoplastic monoclonal proliferation rather than reactive polyclonal proliferation.
Methods:
We obtained fibroblasts from 24 fibroblast foci in seven female patients with IPF, endothelial cells from ten plexiform lesions of two female patients with idiopathic pulmonary arterial hypertension (IPAH) as a positive control for monoclonality, and lung parenchymal cells by microdissection of each formalin-fixed paraffin-embedded block of lung. To analyze clonality, we performed the human androgen-receptor gene methylation assay (HUMARA). DNA released by protein K digestion was subjected to polymerase chain reaction (PCR) amplification with prior digestion with and without the methylation-sensitive restriction enzyme HhaI. Then, we calculated the clonality ratio after electrophoretic analysis of the PCR amplification product. A clonality ratio <0.25 was considered evidence of monoclonal proliferation.
Results:
All of the patients included, i.e., the seven females with IPF and the two females with IPAH, showed polymorphism in the human androgen-receptor gene. The mean clonality ratio of the 24 fibroblast foci was 0.70 (SD: 0.18). All of the fibroblast foci had clonality ratios >0.25, suggesting polyclonality, whereas 7 of 10 plexiform lesions had clonality ratios <0.25 suggesting monoclonality.
Conclusions:
The polyclonality of the fibroblast foci in IPF suggests that the fibroblast proliferation in IPF is not neoplastic, but is reactive in nature. (Korean J Med 79:32-40, 2010)
서 론
특발성 폐섬유증(Idiopathic Pulmonary Fibrosis, IPF)은 아직 밝혀지지 않은 원인에 의해 폐섬유화가 진행하여 절반이상의 환자가 진단 후 5년 이내에 폐기능 부전으로 사망하는 질환이다1). 이 질환의 병리기전은 잘 알려져 있지 않으나 일반적으로 폐포염(alveolitis)으로 시작된 폐조직의 염증반응이주 병리기전이며, 섬유모세포(fibroblast)의 증식과 폐섬유화는 단순히 염증에 따른 폐조직 손상의 치유과정(wound healing)에 발생하는 이차적 현상으로 이해되어 왔다2-7). 이러한 가설을 근거로 특발성 폐섬유증 환자의 치료에 스테로이드를 비롯한 여러 항염증제가 사용되고 있으나, 실제 임상에서 이에 호전을 보이는 환자는 10~20%에 불과하고 나머지 대부분 환자들은 치료에도 불구하고 계속 진행되는 섬유화로 결국 사망하게 된다8). 이 같은 사실은 아직 우리가 특발성 폐섬유증의 병리기전을 제대로 이해하고 있지 못함을 시사하며, 따라서 새로운 치료방침을 개발하고 특발성 폐섬유증 환자의 생존을 증가시키기 위해서는 특발성 폐섬유증의 병리기전에 대한 기존의 가설과 다른 새로운 방향의 접근이 필요하다.
특발성 폐섬유증의 조직학적 소견인 usual interstitial pneumonia(UIP)은 초기변화로 섬유모세포 집단병소(fibroblast foci) 형성이 특징이다8). 섬유모세포 집단병소는 폐포벽내에 섬유모세포와 근섬유모세포(myofibroblast)가 모여 덩어리를 이루고 있으며 주변에 염증세포의 침윤은 거의 찾아볼 수 없다. 최근 연구 결과 섬유모세포가 단순히 외부자극에만 반응하는 피동적 세포가 아니라 여러 사이토카인(cytokines)들을 분비하는 능동적 세포임이 알려졌고, 특발성 폐섬유증 환자들의 섬유모세포는 정상인의 섬유모세포와는 분열속도나 여러 조절인자들에 대한 반응이 다르다는 것이 알려져 있다9). 이와 같은 사실은 다음과 같은 새로운 가설을 가능하게 한다. 초기에 폐조직에 어떤 자극이 가해지면 이로 인해 여러 섬유모세포 아형 중 섬유화 활성이 강한 세포군이 선택적으로 증식하게 되고 이 세포군은 마치 신생물(neoplasm)과 같이 항상성 조절기전(homeostatic regulatory mechanism)에 반응하지 않고 지속적으로 증식하여 폐섬유화를 유발하는 것이다. 이 가설의 진위를 가늠할 수 있는 연구결과는 현재 전혀 알려진 바 없다. 이에 본 연구자들은 특발성 폐섬유증 환자의 섬유모세포 증식의 클론성(clonality) 검정을 통해 위 가설을 증명하고자 하였다.
대상 및 방법
일곱 명의 특발성 폐섬유증 여자 환자에서 개흉폐생검을 통해 얻은 폐조직의 파라핀 블록(paraffin block, 서울아산병원 진단병리과 보관)을 사용하여 현미해부(microdissection) 방법으로 섬유모세포 집단병소에서 증식된 섬유모세포들을 분리하였다. 단일클론성 검정의 양성대조(positive control)로는 특발성 폐동맥 고혈압(Idiopathic Pulmonary Arterial Hypertension, IPAH) 환자에서 관찰되는 총상병변(plexiform lesion)내 증식된 혈관내피세포를 이용하였다. 특발성 폐동맥 고혈압 환자의 총상병변내 내피세포는 단일클론성 증식을 하는 것으로 알려져 있다10). 두 명의 여자 특발성 폐고혈압 환자의 폐조직 파라핀 블록은 Rubin Tuder (Department of pathology, University of Colorado, Denver, USA) 박사로부터 기증받았으며, 모두 부검을 통해 얻은 조직이었다. 이 환자들의 임상정보는 표 1과 같다.
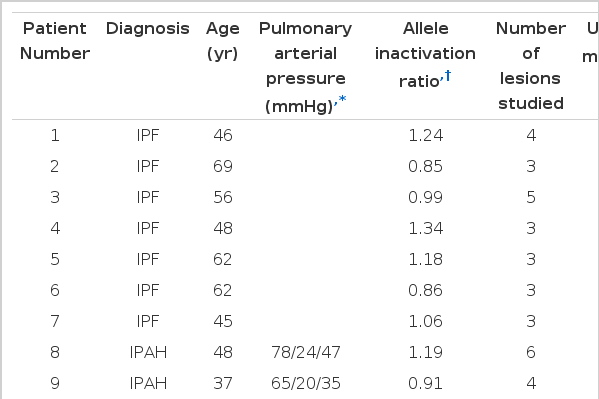
Selected clinical and clonality data for seven women with idiopathic pulmonary Fibrosis (IPF) and two women with idiopathic pulmonary arterial hypertension (IPAH)
1. 조직과 현미해부(microdissection)
특발성 폐섬유증 환자 각각에서 2~8개(평균 3개)의 파라핀 블록을 사용하였다. 포르말린 고정 파라핀 블록으로부터 10 μM 두께로 50개의 연속적인 조직 절편을 얻은 후, 이들 중 매 여섯 번째 슬라이드를 hematoxyline과 eosin 염색을 하여 섬유모세포 집단병소(fibroblast foci) (그림. 1)를 찾고 이를 삼차원으로 재구성하였다. 또한 알파 민무늬근육섬유 액틴(α-smooth muscle actin) 면역염색으로 근섬유모세포를 확인하였다. 선택된 병변이 보이는 나머지 슬라이드는 모두 eosin염색을 하고 각각의 슬라이드로부터 현미해부 기법으로 증식된 섬유모세포를 선택적으로 분리해 모두 하나의 튜브에 모았다. 현미해부는 40배 해부현미경(40×dissecting microscope)을 사용해 30 게이지(gauge) 바늘로 섬유모세포를 분리한 후 글리세롤내에 부유시켜 진공조절 피펫으로 부유세포들을 모았다. 각 환자에서 인간 남성호르몬 수용체 유전자 이형 유무를 알아보기 위해 폐실질을 현미해부하였다. 같은 방법으로 특발성 폐동맥 고혈압 환자의 폐동맥 총상병변내에 증식된 혈관내피세포를 분리하여 단일클론성의 양성대조로 이용하였다. 총상병변이 있는 슬라이드 중 하나는 factor VIIIr. Ag으로 면역 염색하여 총상병변내의 내피세포 증식을 확인하였다.

Assessment of the clonality of fibroblasts in a fibroblast focus in idiopathic pulmonary fibrosis (patient 1) and of endothelial cells in a plexiform lesion in idiopathic pulmonary arterial hypertension (patient 8). (A) (left) Morphology of a fibroblast focus in IPF, showing prominent proliferating fibroblasts (hematoxylin and eosin staining, ×200) (arrowheads); (middle) the proliferating fibroblasts were harvested selectively by microdissection for subsequent PCR amplification (eosin staining, ×100)(arrowheads); (right) morphology of a plexiform lesion in IPAH showing proliferating endothelial cells (hematoxylin and eosin staining, ×200) (arrowheads). (B) HUMARA data for the fibroblast focus and plexiform lesion in panel (A). The presence of one band after restriction endonuclease HhaI digestion (HhaI +column) represents monoclonality and the presence of two bands after HhaI digestion represents polyclonality. The fibroblast focus showed two bands after HhaI digestion, which indicates that the proliferating fibroblasts in this fibroblast focus were polyclonal. By contrast, in the analysis of the plexiform lesion and HEC-1-A cells (adenocarcinoma cells) we can see only one band after HhaI digestion, which indicates that these cells are monoclonal.
2. 클론성 분석(Analysis of clonality)
클론성 검정은 X염색체의 메틸화 형태(methylation pattern)를 이용하였다. 여성에서는 태아발생 초기에 서로 다른 메틸화에 의해 각 세포내 두 개의 X염색체 중 하나만이 활성도가 유지되며(Lyon hypothesis), 이러한 메틸화 형태는 이후의 세포분열 과정 중에도 일정하게 유지된다. 인간 남성호르몬 수용체(Human androgen receptor) 유전자는 X염색체상에 존재하며 메틸화에 의해 비활성화된다. 메틸화는 무작위로 진행되어 세포의 반은 아버지로부터 받은 유전자가 메틸화되고 나머지 반은 어머니로부터 받은 유전자가 메틸화된다. 따라서 다클론성 조직에서 세포의 반은 어머니의 유전자가 메틸화되고, 나머지 세포의 반은 아버지의 유전자가 메틸화된 혼합 양상을 보인다. 반면 단일세포에서 유래한 단일클론성 조직은 어머니 또는 아버지 어느 한쪽 유전자의 메틸화 형태만을 보이게 된다. 본 연구에서는 인간 남성호르몬 수용체 유전자 메틸화 분석(human androgen-receptor gene methylationassay, HUMARA) 방법으로 클론성 검정을 하였다11). 인간 남성호르몬 수용체 유전자는(CAG)n (n=11-31) 염기배열의 단기일렬반복(short tandem repeat)을 가지고 있고, 90%에서 다형성(polymorphism)을 보인다12). 삼뉴클레오티드(Trinucleotide)의 100 염기 쌍(base pair) 상류(upstream)에 두 개의 메틸화 민감핵산내부가수분해효소(Methylation-sensitive endonuclease)인 HhaI의 작용부위가 존재하며, 이곳의 메틸화 상태는 X염색체의 불활성화(inactivation)와 관련되어 있다11). HhaI으로 유전체 디엔에이(genomic DNA)를 처리하면 불활성화된 X염색체상의 인간 남성호르몬 수용체 유전자는 분해되지 않으나 활성 X염색체상의 인간 남성호르몬 수용체 유전자는 HhaI에 의해 분해되어 이후의 중합효소연쇄반응(polymerase chain reaction, PCR)에 의해 증폭되지 않는다. 이러한 원리로 단일클론성 조직에서 추출한 DNA를 HhaI으로 처리하면 어머니 또는 아버지 중 한쪽의 메틸화 인간 남성호르몬 수용체 유전자만이 중합효소연쇄반응으로 증폭되어 겔 전기영동상 단일 띠(band)를 형성한다. 반면에 다클론성 조직에서는 HhaI처리 후에 아버지와 어머니로부터 유래한 두 가지의 인간 남성호르몬 수용체 유전자가 존재하며, 이 경우 중합효소연쇄반응과 겔 전기영동 후 두 개의 띠를 형성하게 된다(그림 2).
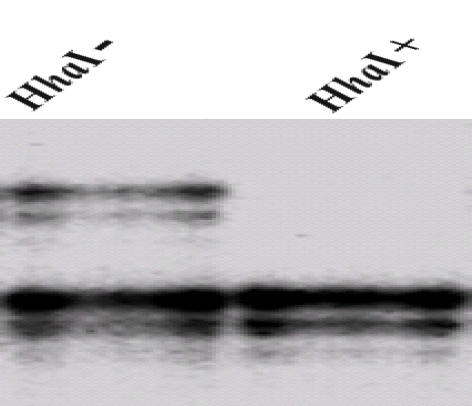
Clonality analysis based on HUMARA of DNA from proliferating cells (Monoclonal cell shows a single band on electrophoresis after digestion with the methylation-sensitive restriction enzyme HhaI).
1) 현미해부로 얻은 조직의 처리
현미해부로 얻은 조직을 단백분해효소K 완충액(proteinase K buffer, 0.2 mg/mL proteinase K, 1 mM EDTA, 50 mM Tris HCl, pH 8.4, 0.5% Tween) 20 μL로 부유해 37℃로 밤새(overnight) 항온 반응한 후 98℃에서 8분간 불활성화하였다.
2) X염색체의 제한 핵산내부가수분해효소 처리(Restriction endonuclease HhaI digestion of active X-chromosome)
1)에서 얻은 DNA 혼합물(DNA preparation)을 두 개의 튜브에 10 μL씩 나누어 담고, 한쪽 튜브에는 20 U HhaI과 1.0×중합효소연쇄반응 완충액(20 mM Tris HCl, pH 8.4, 50 mM KCl, 1.5 mM MgCl2, GIBCO BRL)로 최종용량을 25 μL로 하고, 37℃에서 12시간 항온 반응시켰다. 이후 HhaI 20 U을 추가하여 2시간 동안 두 번째 처리를 마친 후 70℃에서 20분간 항온 반응하여 불활성화 하였다. 다른 하나의 튜브는 HhaI없이 같은 반응을 진행하였다.
3) 중합효소연쇄반응
본 연구에 사용되는 조직은 신선하지 않고 화학처리과정(formalin fixed, paraffin embedded block)을 거쳤으며, 현미해부로 얻어진 조직은 50개 내외의 세포로 구성된 아주 작은 조직이다. 이러한 문제점으로 중합효소연쇄반응 증폭이 쉽지 않다. 중합효소연쇄반응 증폭의 민감도와 특이도를 높이기 위해 hot start protocol을 이용한 two step ‘nested’ primer approach13)를 시행하였다. 일차 중합효소연쇄반응은 primer 1 (5'-GCTGT GAAGGTTGCTGTTCCTCAT-3')과 primer 3 (5'-CGTCCAAGACCTACCG AGGAGCTT-3')을 이용하고 이차 중합효소연쇄반응은 primer 2 (5'-TCCAGAATCTGTT CCAGAGCGTGC-3')와 primer 4 (5'-ATGGGCTTGGGGAGAACCATCCTC-3')를 이용하였다13). 일차 중합효소연쇄반응은 dNTPs(50 μM), primers 1,3 (각각 10 nM), MgCl2 (1.5 mM), Tris-HCl, pH 8.4 (20 mM), KCl (50 mM), Taq polymerase (0.25 U), 0.01% gelatin과 HhaI digest 10 μL로 최종용량 50 μL로 하였다. 94℃에서 3분간 초기 변성(initial denaturation) 후 32회 증폭하고(thermal profile: 1 min at 94℃, 1 min at 60℃, 2 min at 72℃) 72℃로 10분간 최종 증폭(final extension)을 하였다. 이차 중합효소연쇄반응은 일차 중합효소연쇄반응과 같은 온도 프로필(thermal profil)을 사용하며, 일차 중합효소연쇄반응 생성물 1.0 μL, primer 2,4 (각각 500 nM), dNTPs (200 uM), 0.1 uL of [a-32P] deoxycytidine triphosphate (3000 Ci per millimole), MgCl2 (1.5 mM), Tris-HCl, pH 8.4 (20 mM), KCl (50 mM), Taq polymerase (0.25 U), 0.01% gelatin으로 최종용량 50 μL로 하였다. 각각의 중합효소연쇄반응은 PCR gem (Perkin Elmer, Norwalk, CT)을 사용한 hot start protocol을 이용하였다.
4) 인간 남성호르몬 수용체 유전자 단기일렬반복 증폭 생성물의 전기영동 분석
중합효소연쇄반응 생성물은 6% denaturing polyacrylamide sequencing gel로 전기영동 후 자가방사기록법(autoradiography)으로 분석하였다14). 중합효소연쇄반응 생성물의 정량분석은 겔 분석용 프로그램 SigmaGel™ (Jandel Corporation, San Rafael, CA, USA)을 이용하여 밀도분석(densitometric analysis)을 하였다. Polyacrylamide 전기영동상 HhaI 처리를 하지 않은 중합효소연쇄반응 생성물은 두 개의 띠를 보이며, 각각 아버지와 어머니로부터 받은 대립유전자(allele)를 나타낸다. HhaI처리 후 다클론성 조직의 중합효소연쇄반응 생성물은 두 개의 띠로 나타나고, 단일클론성 조직의 중합효소연쇄반응 생성물은 하나의 띠를 형성한다. 각 검체(sample)에 대해 HhaI처리 검체의 대립유전자 증폭 비(allele amplification ratio, allele 1/allele 2)를 HhaI 미처리 검체의 대립유전자 증폭 비로 나누어 대립유전자 불활성화 비(allele inactivation ratio)를 구하였다. 대립유전자 불활성화 비는 두 대립유전자의 길이에 많은 차이가 있을 때 생길 수 있는 선택적 증폭(preferential amplification)을 교정하기 위해 이용된다15). 한편, 정상조직의 대립유전자 불활성화 비를 이용해 unequal Lyonization에 의한 비정상적 X염색체 불활성화(aberrant X-chromosome inactivation)를 교정하였다. 클론 비(Clonality ratio)는 검체의 대립유전자 불활성화 비를 폐실질의 대립유전자 불활성화 비로 나누어 구하였다. 이론적으로 다클론성 조직에서는 두 대립유전자가 모두 메틸화(methylation)되어 있어 클론 비는 1이 된다. 반면에, 단일클론성 조직은 하나의 대립유전자가 선택적으로 메틸화되어 있어 클론 비는 0이 된다.
5) 단일클론성의 양성대조
단일클론성 검정의 양성대조로는 특발성 폐동맥 고혈압 환자에서 관찰되는 총상병변내 ‘증식된 혈관내피세포’를 이용하였다. 또한 자궁내막 선암종(adenocarcinoma) 세포 HEC-1-A(American Type Culture Collection, Rockville, MD)에서 추출한 DNA도 양성대조로 사용하였다. 이 세포는 인간 남성호르몬 수용체 유전자 단기일렬반복에 다형성(polymorphism)을 갖고, 제한 핵산내부가수분해효소 처리 후 하나의 대립유전자가 완전 소실된다. 중합효소연쇄반응 생성물에 의한 오염을 감시하기 위해 표적 DNA (target DNA)가 없는 시약(reagent control)을 음성대조(negative control)로 사용하였다.
결 과
특발성 폐섬유증 여자 환자 일곱 명과 특발성 폐동맥 고혈압 여자 환자 두 명의 폐조직을 연구에 사용하였으며, 이들 모두 인간 남성호르몬 수용체 유전자의 다형성을 보였다. 이들 폐조직의 대립유전자 불활성화 비는 1.07±0.18 (평균±표준편차)로 uneven lyonization의 가능성은 배제할 수 있었다(표 1). 특발성 폐섬유증 일곱 예로부터 모두 24개의 섬유모세포 집단병소에 대해 섬유모세포 증식의 클론성 분석을 시행하였다. 병변의 클론비는 0.70±0.18 (평균±표준편차) (범위0.37~0.97)로 불균형 메틸화(unbalanced methylation, clonality ratio<0.25)를 보인 예는 없이 모두 다클론성이었다(그림 1,3). 한편 단일클론성의 양성 대조로 2예의 특발성 폐동맥 고혈압에서 총상병변내 내피세포 증식의 클론성 분석을 시행하였다. 모두 10개의 병변을 분석하였으며 이 중 7개가 불균형 메틸화(clonality ratio<0.25)를 보여 단일클론성임을 확인하였다. 10개 총상병변의 클론 비는 0.17±0.23 (평균±표준편차) (범위 0~0.65)이었다(그림 1, 3).
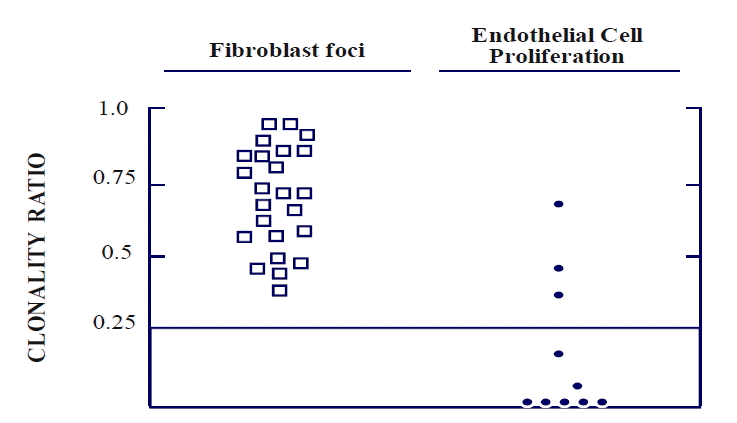
Summary of the HUMARA clonality analysis of fibroblast proliferation in the fibroblast foci in idiopathic pulmonary fibrosis and the endothelial cell proliferation in the plexiform lesions in idiopathic pulmonary arterial hypertension (IPAH). All 24 fibroblast foci showed balanced methylation by HUMARA (clonality ratio >0.25), diagnostic of the polyclonal composition of the proliferating fibroblasts. By contrast, in IPAH, unbalanced methylation, diagnostic of the monoclonal composition of the proliferated endothe lial cells, was found in 7 (70%) of 10 plexiform lesions.
고 찰
특발성 폐섬유증의 발생기전은 아직도 확실히 규명하지 못하였으나 면역기전이 중요하게 작용하리라고 추측되어 왔다1-3). 그 동안 폐포세척(bronchoalveolar lavage)액 분석 및 분자생물학적 기법으로 시행된 연구에서 특발성 폐섬유증의 발병기전은 여러 가지 사이토카인 및 성장인자가 분비되어 폐포염과 섬유화가 계속 진행되기 때문인 것으로 알려졌다2-6). 즉, 어떠한 원인으로 폐조직이 손상을 받게 되면 이에 의해 폐포대식세포(alveolar macrophage)가 자극되어 여러 가지 단백분해효소 및 독성이 심한 유리 산소기(oxygen free radical)들이 유리되어 조직손상을 심화시킨다. 또한 폐포대식세포에서 Interleukin (IL)-1β, tumor necrosis factor-α, IL-6, IL-8 등 여러 가지 사이토카인들이 분비되어 염증(inflammation)이 유발된다. 이러한 조직손상의 치유(wound healing) 기전으로서 transforming growth factor-β, insulin-like growth factor, platelet derived growth factor 등 여러 가지 성장촉진 인자들이 폐포대식세포 등에서 분비되어 섬유모세포들의 증식과 섬유모세포에서의 교원질 생성이 촉진되기 때문에 섬유화가 남게 되는 것으로 생각되고 있다7). 이러한 사이토카인과 성장인자들을 분비하는 세포를 규명하기 위한 그 동안의 연구가 주로 폐포세척 방법으로 쉽게 얻을 수 있는 폐포대식세포에 대해서 행해졌기 때문에 폐포대식세포가 특발성 폐섬유증의 발생기전에 주 역할을 하는 세포로 알려져 왔다5). 즉, 특발성 폐섬유증은 폐포대식세포를 중심으로 하는 폐조직의 염증을 주 병리기전으로 하는 질환이며, 섬유모세포의 증식과 폐섬유화는 단순히 염증에 따른 폐조직 손상의 치유과정에 발생하는 이차적 현상이라는 것이 지금까지 널리 통용된 가설이었다. 이러한 가설을 근거로 특발성 폐섬유증 환자의 치료에 스테로이드를 비롯한 여러 항염증제가 사용되어 왔으나, 실제 임상에서 이에 호전을 보이는 환자는 10~20%에 불과하고 나머지 대부분 환자들은 치료에도 불구하고 계속 진행되는 섬유화로 결국 사망하게 된다8). 폐포대식세포 등 염증에 관여하는 세포들은 작용은 뚜렷하나 그 수명이 짧아서, 특발성 폐섬유증과 같이 수년에 걸쳐 진행하는 질병의 기전을 단순히 일과성으로 존재하는 이들 염증세포와 이에서 유리되는 매개물질만으로 설명하기 힘들다. 이로 인해 지속적으로 폐조직에 존재하는 즉, 폐조직의 구조를 형성하는 세포들이 병리기전에 관여할 가능성이 대두되었다. 그 중에서도 특히 섬유모세포는 지속적으로 폐조직에 존재하며, 섬유소원을 합성하여 폐섬유화 과정에서 중심역할을 하는 세포이기 때문에 더욱 관심의 대상이 되었다. Katzenstein과 Myers는 특발성 폐섬유증의 특징적인 조직학적 소견인 usual interstitial pneumonia (UIP)의 초기변화로 섬유모세포 집단병소(fibroblast foci) 형성을 들고 있다8). 섬유모세포 집단병소는 폐포벽 내에 섬유모세포와 근섬유모세포가 모여 덩어리를 이루고 있으며 주변에 염증세포의 침윤은 거의 찾아볼 수 없다. 근래에는 섬유모세포가 다른 세포에서 분비된 사이토카인의 작용을 받아 증식하고 섬유소원이나 기타 세포외 기질(extra-cellular matrix) 물질을 만들어 낼 뿐만 아니라, 이들이 직접 여러 가지 사이토카인 들을 분비하여 자기 자신(autocrine) 또는 인접한 다른 세포들의(paracrine) 증식이나 기능에 영향을 미치는 능동적 세포로도 작용한다는 사실들이 밝혀졌다16-19). 또한 특발성 폐섬유증환자들의 폐에서 분리된 섬유모세포는 정상인 폐의 섬유모세포와는 분열속도나 여러 조절 인자들에 대한 반응이 다른 것으로 알려져 있다9). 그러므로 특발성 폐섬유증 환자들에서는 폐 섬유모세포 자체가 정상인의 세포와는 다르기 때문에 마치 신생물과 같이 섬유화가 계속 진행할 가능성도 있다. 특히 특발성 폐섬유증의 발병에 유전적 인자가 중요한 역할을 할 것이라는 여러 증거들은 이를 뒷받침 한다20). 그러나 특발성 폐섬유증 환자의 섬유모세포의 성상이 정상인의 그것과 다르다는 사실만으로 특발성 폐섬유증환자의 섬유모세포에 신생물과 같은 유전적 결함이 있을 것으로 추론하기는 힘들다. 왜냐하면 신체의 여러 장기에 섬유모세포가 존재하는데 이러한 섬유모세포들은 장기의 종류에 따라 특성이 다르며, 특히 같은 장기에서도 모든 섬유모세포가 단일한 성분의 한 가지 세포로만 존재하는 것이 아니라 그 성상이 다른 여러 종류의 섬유모세포로 구성되어 있다는 것을 암시하는 사실들이 알려져 있기 때문이다13,15,21-25). 갓 태어난 소의 폐혈관 섬유모세포는 저산소 자극에 의해 증식하는 속도에 따라 몇 개의 군으로 나눌 수 있고, 저산소증에 의해 폐고혈압이 발생한 소의 폐혈관 섬유모세포는 정상 대조군과는 달리 주로 ‘저산소 자극에 의해 증식이 빠른 군’으로 구성되어 있음이 알려져 있다26,27). 따라서 특발성 폐섬유증 환자들에서 분리된 폐 섬유모세포의 성상이 정상인의 세포와는 다른 것은 단순히 이러한 일부(정상적으로 존재하는 여러 섬유모세포 아형 중)의 선택적 증식의 결과일 수도 있다.
세포의 단일클론성(monoclonal) 증식은 하나의 세포 또는 동일한 성상을 가진 하나의 세포군이 선천성 유전적 변화 또는 체세포돌연변이(somatic mutation)와 같은 후천성 유전적 변화에 의해 주위의 다른 정상세포에 비해 잘 자랄 수 있는 성질을 갖게 되어 생기며, 이 세포의 증식이 질병의 병리기전에 일차적 역할을 할 것으로 이해할 수 있다28). 반면에, 창상치유(wound healing)와 같은 반응성과형성(reactive hyperplasia) 조직에서 관찰되는 세포증식은 다클론성으로, 이러한 세포의 증식은 질병의 진행과정에 부수적으로 수반되는 이차적 현상으로 이해될 수 있다. 결장샘 증식증(Colonic gland hyperplasia)에서 샘종(adenoma)을 거쳐 결장암(colon cancer)에 이르는 일련의 과정을 분석해 보면 단일클론성 증식은 신생물(neoplasm) 형성의 가장 초기단계임을 알 수 있다29). 단일클론성 증식은 다른 종류의 암에서도 관찰되며30-33), 데스모이드종양(desmoid tumor)34)이나 평활근종(leiomyoma)35)과 같은 중간엽종양(mesenchymal tumor)에서는 이 조직이 신생물인지 또는 반응성 과형성인지를 감별하기 위해 클론성을 조사하기도 한다.
본 연구의 초점은 특발성 폐섬유증에서 관찰되는 폐 섬유모세포 증식이 ‘폐포대식세포를 중심으로 하는 폐염증에 의한 조직손상’의 치유과정에 동반된 이차적 ‘반응성과형성’인지 또는 폐 섬유모세포가 마치 신생물과 같이 독립적인 증식을 하는 ‘일차적 병리현상’인지를 검정하는 것이었다. 본 연구 결과, 특발성 폐섬유증 환자 폐의 섬유모세포 집단병소를 구성하는 섬유모세포 증식은 다클론성임을 알 수 있었다. 즉, 특발성 폐섬유증 환자에서 폐 섬유모세포 증식은 창상치유에서와 같은 반응성과형성이며, 특발성 폐섬유증 환자 폐 섬유모세포의 성상이 정상인과 다른 것은 외부자극에 대한 폐 섬유모세포 일부 아형의 선택적 증식에 의한 것으로 사료되고, 이에 대해서는 추후 지속적인 연구가 필요하다.