원발 중추신경계림프종의 단일 기관 현실 세계 21세기 경험
Single-Center Real-World Experience with Primary Central Nervous System Lymphoma in the 21st Century
Article information
Abstract
목적
대한민국에서 원발 중추신경계림프종(primary central nervous system lymphoma, PCNSL)의 발생이 증가하고 있고, 자가 조혈모세포 이식술(autologous stem cell transplantation, ASCT)이 젊은 환자들의 생존 성적을 호전시켜 왔다. 이에 서울아산병원(Asan Medical Center, AMC)의 PCNSL 환자 현실 세계 경험을 분석하고자 하였다.
방법
환자 자료를 전향적으로 수집, 기록 중인 AMC 림프종 등록을 이용하였다. 2002년부터 2019년 8월까지 279명의 환자를 분석하였다.
결과
AMC의 PCNSL 발생은 점진적으로 증가하여 최근 4년 동안은 매해 전체 비호지킨림프종 신규 환자의 7.4-8.9%를 차지하였다. 중앙 연령은 60세(범위, 17-85)였고, 남자가 55%였다. 65세 미만(n = 183)은 후두엽 침범이 보다 적고, 베타-2 저분자글로불린 수치가 낮다는 것 외에는 65세 이상과 비교해 의미 있는 차이를 보이지 않았다. 리툭시맵, 메토트렉세이트, 프로카르바진, 빈크리스틴(rituximab, methotrexate, procarbazine, and vincristine, R-MPV) 복합 유도 요법의 전체 반응률이 95%로 가장 우수하였다. 전체 환자의 중앙 생존 기간은 3.8년, 5년 생존율은 41.5%, 10년 생존율은 30.2%였다. 비교 시 젊은 연령군과 ASCT 시행군의 생존이 더 우수하였다. 싸이오테파, 부설판, 사이클로포스퍼마이드(thiotepa + busulfan + cyclophosphamide, TBC) 고용량 요법이 여타 조합보다 성적이 우수하였다. 기존의 PCNSL 예후 점수 체계가 본 연구에서도 유효하였다. 연령과 수행도가 독립 예후 인자였다. 중추신경계 외에서만 실패하는 경우는 전체 107명의 실패 중 6명(5.6%)이었다.
결론
PCNSL의 발생은 증가 추세를 보이고 있다. R-MPV 유도 요법 후 TBC 고용량 요법을 동반한 ASCT 시행이 젊고 적응증에 해당하는 PCNSL 환자의 생존 성적을 향상시켜 왔다.
Trans Abstract
Background/Aims
In Korea, the incidence of primary diffuse large B-cell lymphoma of the central nervous system (PCNSL) is increasing and autologous stem cell transplantation (ASCT) has improved the survival of younger patients. We explored our real-world experience with PCNSL at Asan Medical Center (AMC).
Methods
We used the AMC lymphoma registry to collect patient data prospectively. We analyzed 279 patients diagnosed from 2002 until August 2019.
Results
The PCNSL incidence at AMC increased progressively and comprised 7.4-8.9% of new non-Hodgkin lymphoma patients annually during the most recent 4 years. The median age was 60 years (range, 17-85) and males comprised 55%. Patients under 65 years of age (n = 183) had no significant differences in characteristics compared to those aged 65 years or over, with the exception of less occipital lobe involvement and lower beta-2 microglobulin levels. Rituximab, methotrexate, procarbazine, and vincristine (R-MPV) combination induction had the best overall response, of 95%. The median overall survival was 3.8 years with 5- and 10-year survival rates of 41.5% and 30.2%, respectively. Survival was better in younger patients and those treated with ASCT. Thiotepa, busulfan, and cytoxan (TBC) conditioning chemotherapy had better survival than other combinations. The International Extranodal Lymphoma Study Group and Memorial Sloan Kettering Cancer Center prognostic score systems were valid in this cohort. Age and performance status were independent prognostic factors. Exclusive extra-central nervous system failure occurred in six patients (5.6%) among 107 failures.
Conclusions
The incidence of PCNSL is rising. R-MPV induction therapy followed by ASCT with TBC has improved the survival of young, fit PCNSL patients.
서 론
2017년 발간된 세계보건기구(World Health Organization, WHO)의 제4판 조혈 및 림프 조직 종양 분류에서 처음으로 중추신경계 원발 광범위 큰B-세포림프종(primary diffuse large B-cell lymphoma [DLBCL] of the central nervous system, PCNSL)을 독립 비호지킨림프종(non-Hodgkin lymphoma, NHL)으로 인정하였다. PCNSL의 정의는 뇌, 척수, 연질뇌척수막, 또는 눈 안에서 발생하는 광범위 큰B세포림프종이다[1]. 경막의 림프종, 혈관 내 큰B세포림프종, 전신질환이나 2차 림프종의 증거 동반 림프종 그리고 모든 면역 결핍 연관 림프종은 제외한다. 저자들 또한 최근 보고에서 해당 정의를 사용하였다[2]. 원발 림프절 외 림프종의 정의는 논란의 여지가 있는데[3], 정규 병기 결정에서 림프절 침범은 없거나 미미하고, 림프절 외 병변이 임상적으로 주된 요소이며, 1차 요법의 주 치료 목표인 경우 원발 림프절 외 림프종이다[4].
중앙암등록본부 자료를 기반으로 한 보고에 의하면, 1999년부터 2009년까지 우리나라 PCNSL의 연령 표준화 발생률은 인구 10만 명당 0.17명이었고 매년 8.8% (p< 0.001)의 증가 추세를 보였다[5]. 1997-2016년 사이 삼성서울병원에서 진단한 8,615명의 림프계 종양 환자의 분류 보고에서는 PCNSL가 235명으로 전체 림프계 종양의 2.7%를 차지하였다[6].
전신형 DLBCL과 달리, 안트라사이클린 기반 복합 화학 요법의 PCNSL 치료 성적은 매우 절망적이다. 따라서 국제적으로 학자들은 혈액-뇌-장벽을 통과하는 약제 치료를 연구하였고, 현재 고용량 메토트렉세이트(methotrexate, MTX) 기반 화학 요법이 PCNSL 관해 유도 요법의 근간이 된다[7]. 적응증에 해당하는 PCNSL 환자에서의 자가 조혈모세포 이식술(autologous stem cell transplantation, ASCT)은 장기 생존 성적을 향상시켰다[8].
저자들은 1999년 보고에 이미 PCNSL 임상 양상을 살펴보았고[9], ASCT 치료 결과[10,11], 예후 인자 분석[2,12], 나아가 재발 양상에 대하여 보고하는 등 꾸준히 PCNSL를 연구해 왔다[13]. 저자들의 보고와 여러 국제 연구 결과들을 종합하면, 특히 젊은 연령층의 PCNSL는 잠재적으로 완치 가능하다. 그러나 고령 환자의 치료 성적 향상, 분자 및 영상 기법의 발전을 통한 진단 및 반응 평가 개선에 의사들의 노력이 요구되는 상황이다[7]. 이에 앞으로 PCNSL 진단과 치료의 발전을 도모하고자 2022년 서울아산병원 단일 기관에서 실제로 경험한 PCNSL의 각종 임상 양상, 치료 성적 등을 종합적으로 분석하여 보고한다.
대상 및 방법
대상
서울아산병원이 견고한 PCNSL 등록 자료를 갖기 시작한 2002년부터 최소 2년의 생존 경과를 살필 수 있는 2019년 8월까지 서울아산병원에서 PCNSL로 진단받은 환자 279명을 대상으로 하였다. 중추신경계 병리 조직 진단이 DLBCL이 아닌 경우는 제외하였다. PCNSL 진단은 서론에서 언급하였듯이, 중추신경계림프종이 주된 요소이면서 중추신경계 외의 림프종 침범은 없거나 미미하고, 유도 요법이 중추신경계 병소를 겨냥하여야 하는 경우에 이루어졌다.
방법
전향적으로 작성해 오고 있는 서울아산병원 림프종 등록 자료에서 대상 환자들의 기본 특성, 치료 및 경과 자료 등을 추출하여 분석하였다. 연구 기간 동안 ASCT가 65세 미만에 서만 보험 적용되었기 때문에 65세를 기준으로 연령군을 나누어 분석하였다. 검사 수치의 이상 여부는 통상적 기준을 따랐다. 다만 뇌척수액(cerebrospinal fluid, CSF) 단백치의 경우 국제 림프절 외 림프종 연구회(International Extranodal Lymphoma Study Group, IELSG) 보고[14]에서는 예후 인자 보고 문헌을 인용하면서[15] 60세 이하에서는 45 mg/dL, 61세 이상에서는 60 mg/dL까지를 정상으로 하였다. 그러나 서울아산병원은 최근의 신경학 교과서를 근거로[16] 연령에 상관없이 50 mg/dL를 정상 상한치의 기준으로 하였다. 베타-2 저분자 글로불린(beta-2 microglobulin, B2MG) 수치는 2.0 mg/L 이하와 2.1 mg/L 이상으로 나눌 때 환자군의 경과가 가장 잘 구분되었기 때문에 이를 기준으로 하였다. 심부 구조 침범은 IELSG의 보고를 따라[14] 뇌실 주위 구역, 기저핵, 뇌량, 뇌간, 소뇌에 병변이 있는 경우로 하였다. 유도 요법은 원칙적으로 MTX를 기반으로 한 복합 화학 요법을 시행하였고, 65세 미만이면서 적용 가능한 임상 상태의 환자들에게는 유도 화학 요법 후 고용량 화학 요법 동반 ASCT로 공고 요법을 시행하였다.
통계 분석
범주형 변수들은 카이 제곱 검정으로 비교하였다. 진단 날짜부터 사망 또는 마지막 추적 날까지로 전체 생존 기간을 구하여 통상적 방법으로 분석하였다. 생존자들의 중도 절단 날짜는 2021년 8월 31일로 하였다. 여러 종류의 관해 유도 요법, ASCT 적용 여부, 서로 다른 구제 요법의 사용 등 치료의 조합이 다양하여 무재발, 무질병 내지 무진행 생존은 분석하지 않았다. Cox 회귀 분석으로 생존 자료의 단변량, 다변량 분석을 하면서, 각 군별 생존 위험비를 비교하였다. 예후 인자 분석 때 IELSG 예후 점수 체계(연령 61세 이상, Eastern Cooperative Oncology Group [ECOG] 수행도 2 이상, 혈청 젖산탈수소효소[lactate dehydrogenase, LD] 상승, CSF 단백치 상승, 심부 구조 침범)와[14] Memorial Sloan Kettering Cancer Center (MSKCC) 예후 점수(1등급, 연령 < 50세; 2등급, 연령 ≥ 50세 및 Karnofsky 수행도 ≥ 70; 3등급, 연령 ≥ 50세 및 Karnofsky 수행도 < 70)를[17] 이용하였다. P-value가 0.05 미만일 때 통계적 의미를 두었고, 통계 분석은 SPSS ver. 27 (SPSS Inc., Chicago, IL, USA)을 사용하였다.
결 과
연구 대상의 특성
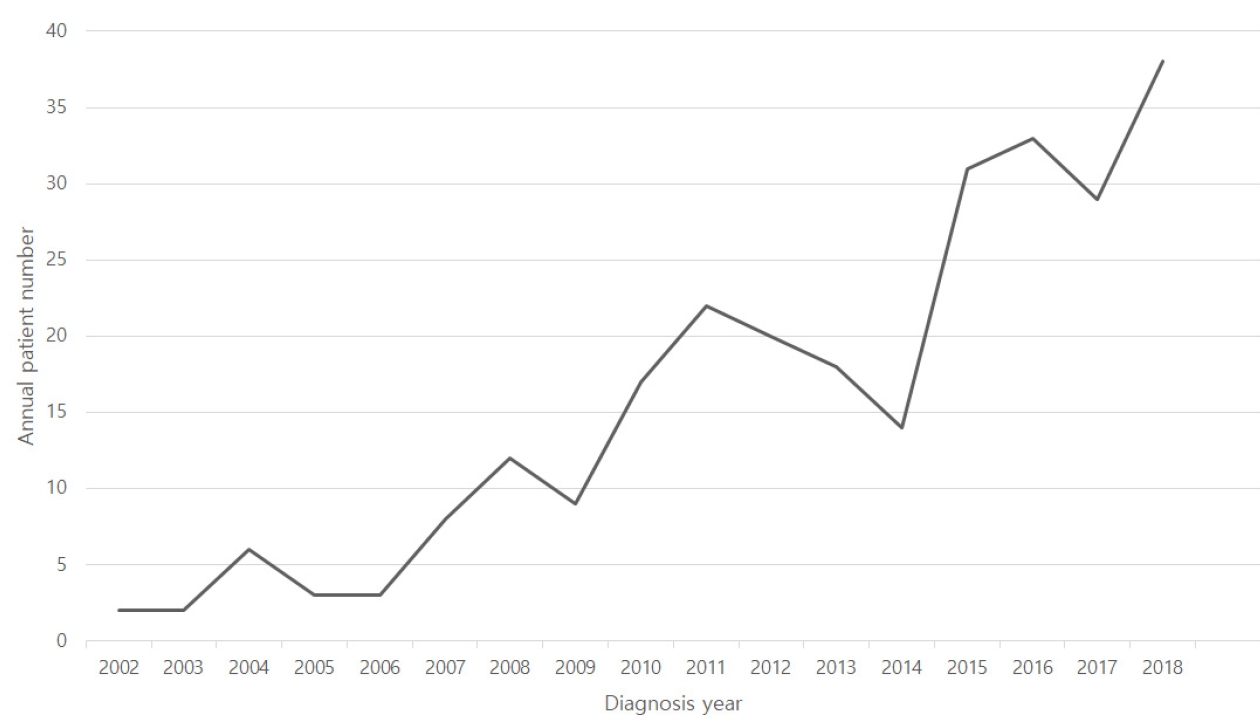
연구 기간 동안 서울아산병원 종양내과 림프종/골수종 프로그램의 PCNSL 초진 환자 수를 연도별로 살피면(Fig. 1) 2002년과 2003년에는 각 2명으로 당해 서울아산병원 NHL 전체 초진 환자의 1.3%와 1.4%를 차지하였다. 시간의 흐름에 따라 절대적 수치와 비율 모두 꾸준히 상승하여 2015년도 PCNSL 초진 환자는 31명으로 그 해 NHL 전체 환자 382명 중 8.1%에 해당하였다. 2016년에는 33명(7.9%), 2017년에는 29명(7.4%), 2018년에는 38명(8.9%)이었다. 즉 2015년 이후 2018년까지 매년 29-38명, 전체 NHL의 7.4-8.9% 수준을 유지하고 있다.
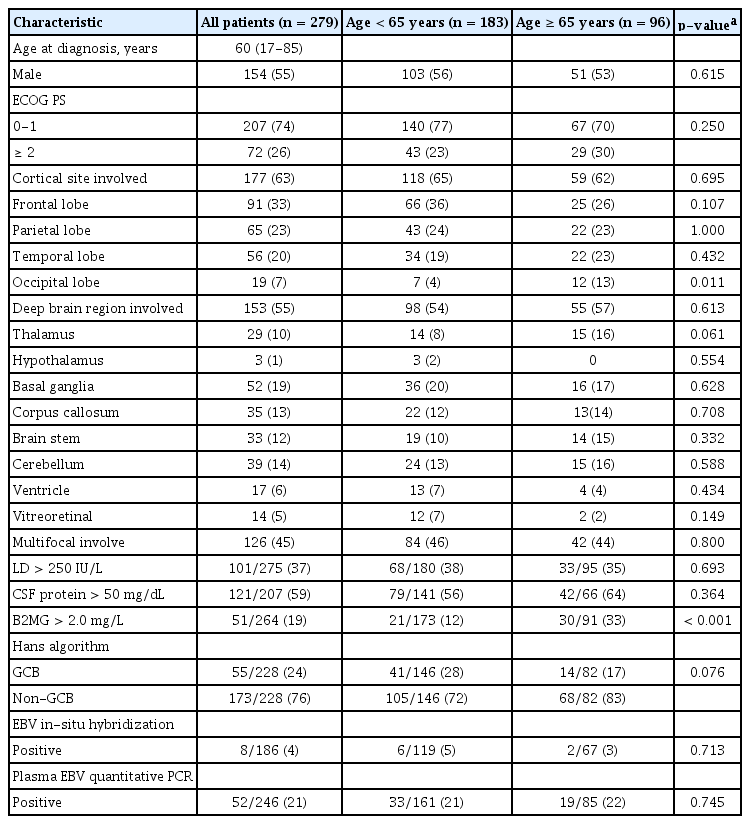
대상 환자 279명의 진단 당시 중앙 연령은 60세(범위, 17-85)였다. ASCT가 건강보험 적용되는 65세 미만은 183명, 65세 이상은 96명이었고 이 두 연령군으로 나누어 환자들의 특성을 비교하였다(Table 1). 전체 환자 중 남성은 154명(55%)이었고, 65세 미만군에서의 남성은 103명(56%), 65세 이상군에서는 51명(53%)이었다. ECOG 수행도는 65세 미만군에서 0-1이 140명(77%), 65세 이상군에서는 67명(70%)이었다. 전체 환자 중 뇌피질 침범은 177명(63%)에서 있었고, 65세 미만군에서는 65%, 65세 이상군에서는 62%로 두 군 간에 차이는 없었다. 뇌피질 침범 부위 빈도는 전두엽, 두정엽, 측두엽, 후두엽의 순이었고, 후두엽 침범 빈도가 65세 미만군에서 4%로 65세 이상군의 13%보다 유의하게 적었다. 심부 뇌 부위 침범은 전체 환자 중 153명(55%)에서 있었고, 65세 미만군은 54%, 65세 이상 군은 57%로 두 군 사이에 차이는 없었다. 유리체망막 침범은 전체 환자의 5%에서 있었는데 65세 미만군은 7%, 65세 이상군은 2%로 차이가 없었다. 다발 병소 침범도 65세 미만군에서 46%, 65세 이상군에서는 44%로 두 군 사이에 차이가 없었다. LD 수치 상승, CSF 단백치 상승 환자수 비율도 두 연령군 간에 차이가 없었다. B2MG 수치가 2.0 mg/L보다 상승된 환자는 측정된 264명 중 51명(19%)이었고, 65세 미만군은 12%, 65세 이상군은 33%에서 상승되어 있어서 유의한 차이를 보였다(p< 0.001). Hans 알고리듬 분류는 228명에서 자료 분석이 가능하였는데, 종자 중심 B세포군은 24%, 비종자 중심 B세포군은 76%였고, 연령에 따른 분포 차이는 없었다. 조직 검체의 제자리부합 검사, 혈장의 정량 중합효소사슬반응 검사로 살핀엡스타인-바 바이러스 양성률은 두 연령군 간에 차이가 없었다.
치료
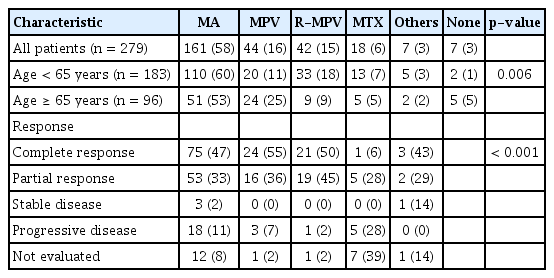
관해 유도 요법은 MTX를 기반으로 한 복합 화학 요법을 시행하였고, 시간의 흐름에 따라 그 조합이 달라졌다(Table 2). MTX, 사이타라빈 병용 요법(MTX + cytarabine, MA)이 2002년부터 시행되었는데, 65세 미만군 중 110명(60%), 65세 이상군 중 51명(53%)에서 시행되었다. MTX, 프로카르바진, 빈크리스틴 3제 병용 요법(MTX + procarbazine, + vincristine, MPV)은 2015년부터 시행되었고, 65세 미만군에서는 20명(11%), 65세 이상군에서는 24명(25%)에서 시행되었다. 리툭시맙, MPV (rituximab + MPV, R-MPV)는 2017년부터 사용하여, 65세 미만군에서 33명(18%), 65세 이상군에서 9명(9%)에게 투여되었다. MTX 단독 요법도 연구 시기 동안 환자의 상태 등에 따라 시행되었는데, 65세 미만군 중 13명(7%), 65세 이상군에서는 5명(5%)이 있었다. 전체 환자 중 7명에서 다른 유도 요법이 시행되었는데, 3명은 MTX, 싸이오테파, 빈크리스틴 3제 복합 요법이, 유리체망막 림프종 1예는 유리체망막 내 MTX 주사가 시행되었다. 나머지 3명은 DLBCL의 통상 복합 화학 요법을 받았다. 어떠한 항암 요법도 시행하지 않은 환자가 65세 미만군에서 2명(1%), 65세 이상군에서 5명(5%) 있었다. ASCT를 계획하는 경우, 최근 R-MPV가 주요 요법이 되면서 연령별 유도 요법 종류는 통계적으로 유의한 차이를 보였다(p= 0.006). 전체 반응률은 MA 요법이 80% (완전 반응 47%, 부분 반응 33%), MPV 요법은 91% (완전 반응 55%, 부분 반응 36%), R-MPV는 95% (완전 반응 50%, 부분 반응 45%)였다(Table 2). MTX 단독 요법은 완전 반응 6%, 부분 반응 28%로 전체 반응률이 34%였고, 그 밖의 요법들의 경우 완전 반응은 43%, 부분 반응이 29%였다. 질병 진행률은 MA 11%, MTX 단독 요법 28%로 MPV의 7% 및 R-MPV의 2%보다 많았고, 유도 요법 종류에 따른 반응 양상은 의미 있는 차이를 보였다(p< 0.001).
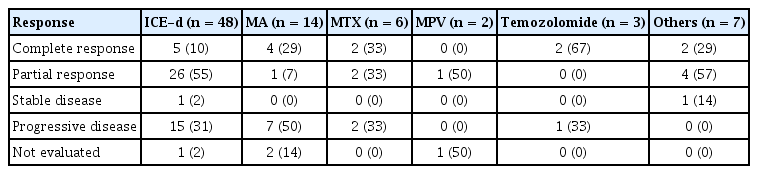
구제 요법은 이포스파마이드, 카보플라틴, 에토포사이드, 덱사메타존 복합 요법이 가장 많이 사용되어 48명에게 투여되었다. MA 요법 14명, MTX 단독 요법이 6명이었고, MPV가 2명, 테모졸로마이드가 3명에서 시도되었다(Table 3). 나머지 7명에서는 DLBCL의 통상적 구제 요법이 시행되었다. 그러나 최신 치료나 MTX 기반 치료의 예가 적고, 통상의 DLBCL 구제 요법이 다수여서 반응 양상에 대한 해석은 큰 의미가 없다.
생존 성적
전체 PCNSL 환자의 중앙 생존 기간은 3.8년, 5년 생존율은 41.5%, 10년 생존율은 30.2%였다(Fig. 2A).
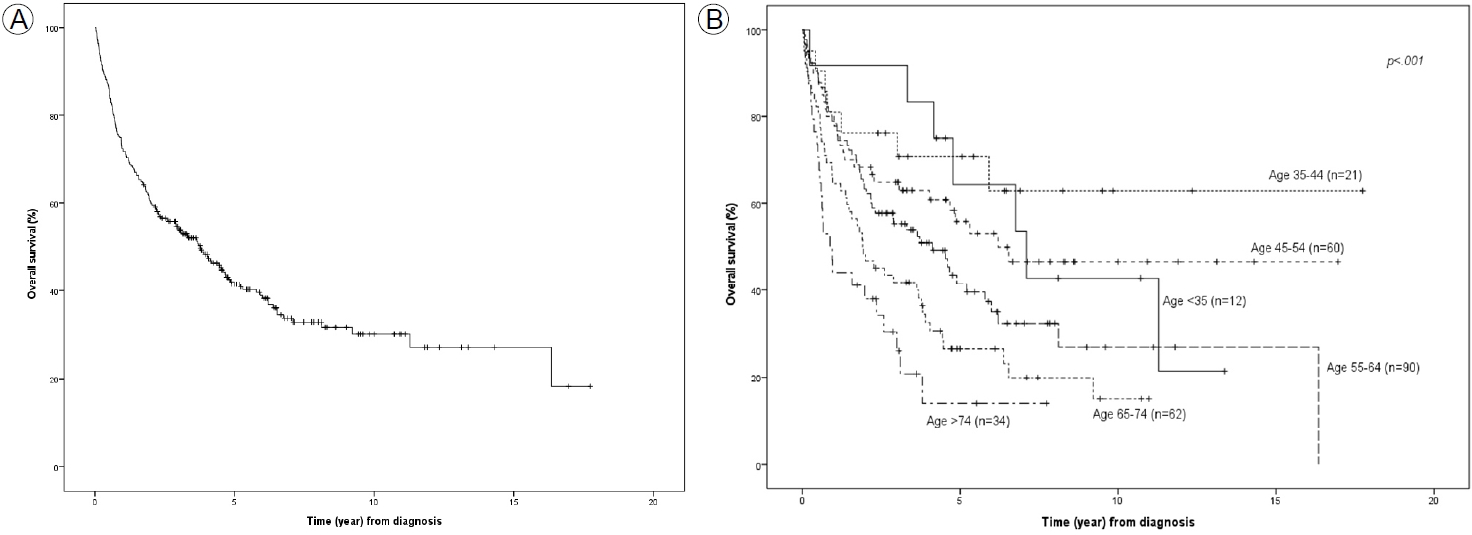
Overall survival (OS) of all patients (A) and of patients grouped by age at diagnosis of < 35, 35-44, 45-54, 55-64, 65-74, and ≥ 75 years (B).
진단 당시의 나이를 10년 단위로 나누어 연령대별 생존 곡선을 분석하였다(Fig. 2B). 35세 미만 12명의 중앙 생존 기간은 7.1년, 5년 생존율은 64.3%, 10년 생존율은 42.9%였다. 35-44세 21명은 중앙 생존 기간에 도달하지 않았고, 5년 생존율은 70.7%, 10년 생존율은 62.9%였다. 45-54세 60명의 중앙 생존 기간은 6.2년, 5년 생존율은 55.8%, 10년 생존율은 46.6%였고, 55-64세의 90명의 중앙 생존 기간은 4.1년, 5년 생존율은 41.5%, 10년 생존율은 26.9%였다. 65-74세 62명의 중앙 생존 기간은 1.9년, 5년 생존율은 26.5%, 10년 생존율은 14.9%였다. 75세 이상 34명의 중앙 생존 기간은 0.9년, 5년 생존율은 13.9%였으며, 7.7년이 최장기 생존으로 그 생존율은 13.9%였다. 진단 당시의 연령이 많으면 많을수록 생존 성적이 통계적으로 유의하게 나빴다(p< 0.001).
각 유도 요법별 생존 양상을 ASCT 시행 여부에 따라 환자군을 나누어 살펴보았다. 연구 기간 중 각 유도 요법의 동원 시기가 순차적으로 달라 추적 기간에 차이가 발생하였고, 따라서 요법별 생존 곡선 비교 해석에 제한이 있었다. ASCT를 시행한 R-MPV 유도 요법군 28명은 4.0년이 최장기 생존이고, 그 생존율이 85.7%였다. MPV 요법군 16명은 4.9년이 최장기 생존이고, 그 생존율이 55.6%였다(Fig. 3A). MA 요법 74명은 5년 생존율이 66.1%, 10년 생존율이 44.5%, 중앙 생존 기간은 9.2년이었다. MTX 유도 요법 후 ASCT를 시행한 1명은 ASCT 시행 1.1년 후에 사망하였다.

Overall survival of patients grouped by induction regimen. R-MPV, MA, MPV or MTX in those treated with (A) or without (B) autologous stem cell transplantation (ASCT); of patients treated with or without ASCT (C); and of patients grouped by high-dose conditioning regimen. BEAM, TBC, or BuCy(Mel)E for ASCT (D). R-MPV, rituximab, methotrexate, procarbazine, and vincristine; MPV, methotrexate, procarbazine and vincristine; MA, methotrexate and cytarabine; MTX, methotrexate; BEAM, BCNU, etoposide, cytarabine, and melphalan; TBC, thiotepa, busulfan, and cyclophosphamide; BuCy(Mel)E, busulfan, cyclophosphamide or melphalan, and etoposide.
ASCT를 시행하지 않은 경우 R-MPV 요법군 14명의 최장기 생존은 3.8년, 그 생존율은 64.3%였고, 중앙 생존 기간에는 도달하지 않았다(Fig. 3B). MPV 요법군 28명의 최장기 생존은 4.7년, 그 생존율은 14.4%였고, 중앙 생존 기간은 1.4년이었다. MA 요법군 87명은 중앙 생존 기간 1.9년, 5년 생존율 26.3%, 10년 생존율 18.2%였다. MTX 요법군 17명의 중앙 생존 기간은 0.2년, 5년 생존율은 5.9%, 10년 생존율은 5.9%였다. ASCT 시행 여부와 상관없이 R-MPV 유도 요법군의 생존 성적이 가장 우수하였다.
ASCT 공고 요법 시행 여부에 따른 생존 성적 분석 결과, ASCT 시행군 122명의 중앙 생존 기간은 9.2년, 5년 생존율은 66.9%, 10년 생존율은 47.9%였다(Fig. 3C). ASCT를 시행하지 않은 157명은 중앙 생존 기간 1.7년, 5년 생존율 22.0%, 10년 생존율 16.0%로 두 군의 생존 성적은 통계적으로 유의한 차이를 보였다(p< 0.001).
ASCT의 고용량 화학 요법 종류에 따른 생존 성적에서 연구 초기 카머스틴, 에토포사이드, 사이타라빈, 메토트렉세이트(BCNU + etoposide + cytarabine + melphalan, BEAM)를 투여받은 2명은 모두 15년 이상 생존하고 있다(Fig. 3D). 가장 많은 90예에서 시행된 싸이오테파, 부설판, 사이클로포스퍼마이드(thiotepa + busulfan + cyclophosphamide, TBC) 요법의 중앙 생존 기간은 11.3년, 5년 생존율은 73.1%, 10년 생존율은 65.3%였다. 부설판, 사이클로포스퍼마이드 또는 멜팔란, 에토포사이드(busulfan + cyclophosphamide or melphalan + etoposide, BuCy[Mel]E) 3제 고용량 요법은 모두 30예에서 투여되었는데, 중앙 생존 기간 4.9년, 5년 생존율 46.7%, 10년 생존율 26.3%로 3군의 생존 성적은 유의한 차이를 보였다(p= 0.005).
중추신경계 밖 병소 동시 침범된 39명과 중추신경계에만 림프종이 국한된 240명의 생존 성적을 비교하였을 때 두 군 사이에 통계적으로 의미 있는 차이는 없었다.
예후 인자 분석
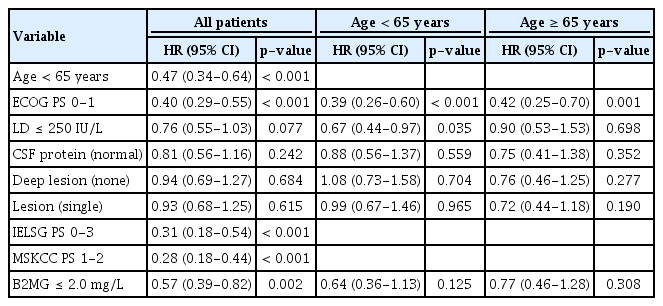
전체 환자에서 전체 생존의 단변량 Cox 회귀 분석을 시행한 결과(Table 4), 연령 65세 미만이 65세 이상에 비해 위험비가 0.47 (95% confidence interval [CI], 0.34-0.64)로 유의하게 낮았다(p< 0.001). ECOG 수행도가 0-1인 환자들은 2-4의 환자들에 비해 위험비가 0.40 (95% CI, 0.29-0.55)으로 낮았다(p< 0.001). IELSG 예후 점수는 0-3인 군이 4 이상인 군보다, MSKCC 예후 등급은 1-2인 경우가 3인 경우보다 위험비가 유의하게 낮았다(p< 0.001). B2MG 수치가 2.0 mg/L 이하인 군에서 위험비가 유의하게 낮았는데(p= 0.002), LD 수치, CSF 단백치, 심부 뇌 부위 침범 여부 그리고 다발 병소 침범 여부는 단변량 Cox 회귀 분석에서 통계적으로 유의하지 않았다. 65세 미만군에서의 단변량 Cox 회귀 분석 결과, ECOG 수행도 0-1인 환자들이 2 이상인 환자들에 비해(p< 0.001), LD 수치가 정상인 경우 상승한 경우에 비해(p= 0.035) 위험비가 의미 있게 낮았다. CSF 단백치, 심부 뇌 부위 침범, 다발 병소 여부 그리고 B2MG 수치는 통계적으로 유의하지 않았다. 65세 이상군의 단변량 Cox 회귀 분석은 유일하게 ECOG 수행도가 0-1인 경우만 위험비가 의미 있게 낮았기 때문에(p= 0.001) 65세 이상군에서는 다변량 Cox 회귀 분석을 시행할 수 없었다.
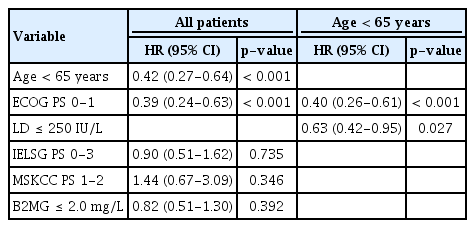
전체 환자에서 전체 생존의 다변량 Cox 회귀 분석 결과(Table 5), 연령 65세 미만(p< 0.001), ECOG 수행도 0-1 (p< 0.001)인 경우가 통계적으로 유의한 인자였다. 65세 미만 군에서는 단변량 분석에서 의미 있었던 ECOG 수행도(p< 0.001), LD 수치(p= 0.027) 모두 다변량 분석에서도 유의하였다.
IELSG 예후 점수에 따른 생존 곡선 분석에서(Fig. 4A) 0-1점군의 중앙 생존 기간은 6.2년이었고, 5년 생존율은 55.7%, 10년 생존율은 38.6%였다. 2-3점군은 중앙 생존 기간은 3.8년, 5년 생존율은 39.4%, 10년 생존율은 32.7%였고, 4-5점군은 중앙 생존 기간은 0.4년, 5년 생존율은 9.4%였고, 최장기 생존이 5.5년으로 그 생존율은 9.4%였다. IELSG 예후 점수 구분에 따른 세 군의 생존 성적 차이는 통계적으로 유의하였다(p< 0.001).
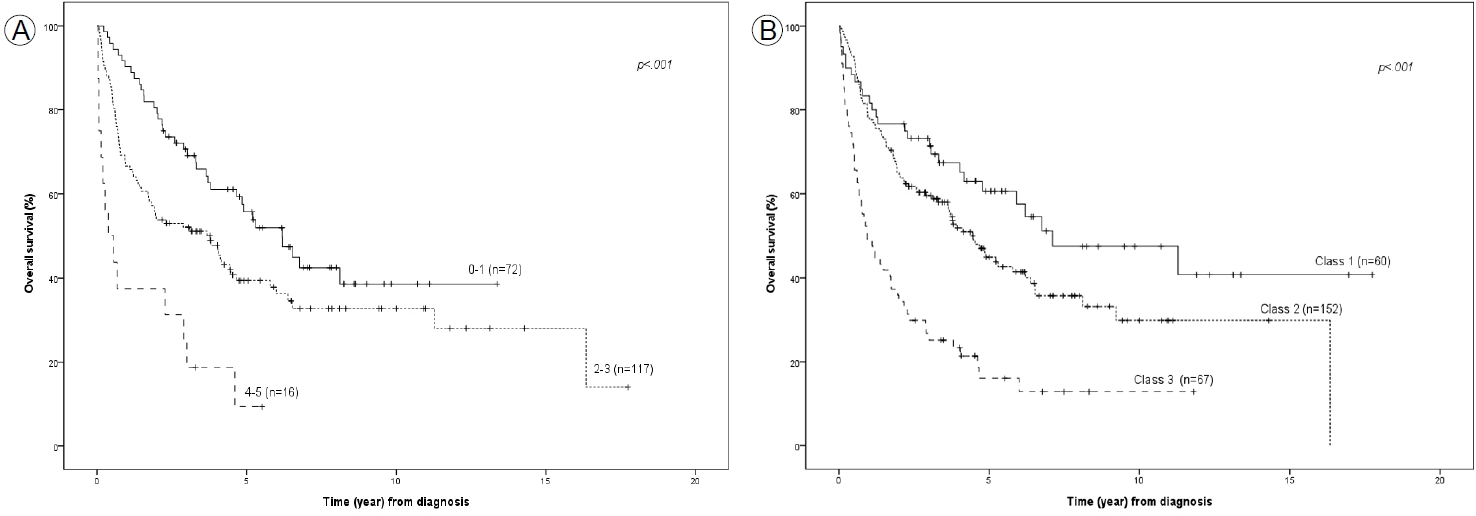
Overall survival of patients grouped by the International Extranodal Lymphoma Study Group (A) and Memorial Sloan-Kettering Cancer Center (B) prognostic score systems.
MSKCC 예후 점수 등급에 따른 전체 생존 곡선 분석 결과(Fig. 4B), 1등급의 중앙 생존 기간은 7.1년, 5년 생존율은 60.6%, 10년 생존율은 47.5%였다. 2등급의 중앙 생존 기간은 4.4년, 5년 생존율은 44.9%, 10년 생존율은 29.8%였다. 3등급의 중앙 생존 기간은 0.9년, 5년 생존율은 16.0%, 10년 생존율은 12.8%였다. 따라서 MSKCC 예후 점수에 의한 세 등급의 생존 곡선은 통계적으로 의미 있는 차이를 보였다(p< 0.001).
실패 양상
진행 또는 재발하여 치료 실패 부위가 확인된 경우가 모두 107명 있었는데, 그중 중추신경계 내부만의 실패가 98명(91.6%), 중추신경계 내부 및 외부 동반 실패가 3명(2.8%), 중추신경계 외부만의 실패는 6명(5.6%)이었다.
고 찰
서울아산병원에서 PCNSL로 진단받는 환자들의 수는 매년 증가하고 있고, 중앙암등록본부 자료를 기반으로 한 보고에서도 1999년부터 2009년까지 우리나라 전체 PCNSL 발생이 점진적으로 증가하였다[5]. 즉 우리나라에서 PCNSL의 발생은 증가하고 있으며, 우리의 더 큰 관심이 필요하다.
연령대 구분은 연구 기간 동안 ASCT 시술 적용이 가능하였던 65세 미만과 건강보험이 ASCT 시행을 인정하지 않은 65세 이상으로 구분하였는데, 이는 이번 보고에서 임상 특성을 분석함에 있어 가장 타당한 연령군 구분이었다.
서울아산병원의 20세기 PCNSL 경험 보고에서 방사선 요법이 사망에까지 이르게 하는 심각한 신경 독성을 경험하였고, 국외 보고에서도 방사선 요법에 기인하는 매우 심각한 지연 신경 독성 예들이 있다[18,19]. 이에 서울아산병원은 21세기부터 PCNSL 치료에 원칙적으로 방사선 요법을 동원하지 않았다. 대신 고용량 MTX 기반 관해 유도 화학 요법을 선행한 뒤 적용 가능한 환자에서는 ASCT로 공고 요법을 시행하는 흐름을 치료의 골격으로 삼았는데, 초창기에는 MA 요법으로[20] 관해 유도 치료를 하였다. 이어서 성적 향상을 도모하고자 MPV 요법[21], R-MPV 관해 유도 요법[22]을 순차적으로 적용하였다. IELSG는 무작위 2상 연구 결과들을[23,24] 토대로 고용량 MTX, 사이타라빈, 싸이오테파, 리툭시맵 4제 병용(MTX + cytarabine + thiotepa + rituximab, MATRix) 요법을 PCNSL에서 관해 유도 치료로 가장 추천하고 있다. 우리나라에서 PCNSL 치료를 위한 화학 요법 조합은 건강보험의 적응증 제한, 국내 유통 장애 문제로 희귀의약품센터를 통한 구매 가능성 여부, 이들에서 야기되는 환자의 재정 부담 등 여러 제약에 얽매인다. 전체 반응률, 생존 성적 등을 보면 본 연구의 환자군에서는 R-MPV가 가장 우수한 관해 유도 화학 요법이다. MA와 MPV는 전체 반응률에서 큰 차이가 없고, ASCT를 시행하지 않은 군에서의 생존 성적도 두 유도 요법 사이에 의미 있는 차이가 없다. 그러나 ASCT 시행 환자군에서는 MA 요법 시행 환자군이 MPV 요법 시행 환자군보다 5년 생존율이 우수하다. MPV 요법의 빈크리스틴이 PCNSL 치료에 얼마나 효과를 발휘하는지는 의구심이 드는 부분이다. PCNSL 치료 성적 보고들이 모두 강조하듯 무작위 3상 연구 결과가 없고, 무작위 2상 연구도 대상 환자 수가 적다는 점이 확고한 성적 결과 도출을 방해하는 장애물이다. 또한 ASCT 가능 환자군의 생존은 어느 유도 요법을 동원하였는지, 고용량 요법의 약제 조합은 무엇이었는지 등이 영향을 끼친다. 본 연구에서 R-MPV 대비 MPV 성적과 무작위 2상 연구에서 MATRix의 결과를 보면[23] 리툭시맵 병용은 생존 성적 향상에 반드시 필요하다고 판단된다. 이러한 저자들의 경험과 현재까지의 문헌을 살피면, 고용량 MTX 요법을 기반으로 사이타라빈을 병용하고 이에 리툭시맵을 추가하는 것이 PCNSL 유도 화학 요법의 근간으로 추천된다. 이 근간에 알킬화제 하나를 더 추가하는 R-MA + 1 알킬화제 요법의 성적이 우수하리라 기대되는데, MATRix가 바로 이에 해당한다. 그러나 우리나라 건강보험의 허용 여부, 약제 구입의 용이성 등에 문제가 있다. 이러한 제약으로 인하여 현재 서울아산병원은 PCNSL의 관해 유도 요법으로 리툭시맵을 비급여 동원하는 R-MPV를 사전 요법으로 권유하고 있다. 적응증에서 벗어나거나 비급여를 동의하지 않으면 MPV를 투여한다.
이전의 연구들을 보면 관해 유도 요법 후 공고 요법으로 방사선 치료와 ASCT의 성적을 비교한 연구가 있고[25], ASCT에 동원하는 고용량 요법의 비교 연구도 있다[26]. 이번 보고에서는 ASCT 시행군의 생존이 시행하지 않은 군보다 우수하였다. 그러나 한 보고에서는 PCNSL 환자에서 고용량 화학 요법 후 ASCT의 타당성과 효과에 의문의 여지가 있고 ASCT의 최적 대상 환자, 적절한 고용량 화학 요법 종류, 반응 평가의 적절한 시기, 급성 또는 만성 부작용 등도 더 밝혀져야 할 부분이라고 하였다[8]. 본 연구에서 BEAM 요법 시행 환자는 2명에 불과하여 그 성적을 그대로 받아들일 수는 없다. 그리고 Mayo Clinic의 보고[26]에 의하면 PCNSL의 고용량 요법에서 BEAM이 부설판, 싸이오테파(busulfan + thiotepa, BuTT) 2제 고용량 요법에 비해 더 우수하지 않고, BEAM의 중추신경계로의 침투성이 낮아 그 성적이 나쁘다고 한다[8,24]. 이전의 보고[11]와 본 연구 결과로 살필 때, TBC 고용량 요법이 BuCy(Mel)E 요법보다 성적이 우수하다. 따라서 서울아산병원에서는 PCNSL의 ASCT 치료에서 TBC를 표준 고용량 요법으로 사용한다. 그동안의 독성 경험을 바탕으로 TBC는 수행도가 좋은 50세 미만 환자에 적용하고, 그 밖의 환자에게는 BuTT를 투여하고 있다. BuTT의 본격 적용은 이번 연구 대상 환자군 이후인 2019년 하반기부터 시작하였기에 앞으로 2-3년 뒤의 임상 결과가 기대된다. 또한 최근 ASCT 대상이 65세 미만에서 70세 미만으로 확대 적용되었다. 따라서 65세 이상의 PCNSL 환자군에서 BuTT 고용량 요법 동반 ASCT 치료로 성적이 향상될지 기대해 본다. 한편 이전 연구의 PCNSL에서의 ASCT 치료 성적에서 조혈모세포 이식 특이 동반 질병 지수에 따른 생존 곡선은 각 군이 서로 교차하거나 역전하여 뚜렷한 추세를 보이지 않았다[27].
이번의 현실 세계 경험을 바탕으로, 보다 더 우수한 구제 요법을 구체적으로 제안하기는 어렵다. 최근까지의 연구에서도 재발 내지 불응 PCNSL 환자에 대한 표준 요법은 정립되어 있지 않고, 앞으로 임상 연구가 더 필요하다고 하였다. 그동안 MTX의 재치료, 이포스파마이드 포함 복합 요법, 템시로리무스, 이브루티닙, 면역 조정 약제 등의 시도가 있었다. 최근에는 항세포예정사단백1항체, 키메라항원수용체 T세포 치료가 시도되고 있다[7]. 우리나라 PCNSL 환자들도 이러한 새로운 기전의 구제 요법들을 시도할 수 있는 기회를 가질 수 있도록 건강보험 당국의 긍정적이고도 적극적인 조처가 절실하다.
Cox 회귀 분석에서 IELSG나 MSKCC의 예후 점수 분석은 본 연구 전체의 65세 기준과 무관하게 각각 본래 예후 점수의 연령 기준을 따랐다. IELSG 예후 점수는 0-3점 대 4-5점으로, MSKCC 예후 점수 구분은 해당 환자 수와 통계 수치들을 고려할 때 1-2등급 대 3등급으로 하는 것이 가장 합당하여 이를 따랐다. 생존 곡선을 보면 IELSG 예후 점수에 비해 MSKCC 등급이 연령과 수행도 2가지 간단한 항목만으로도 더 명료하게 구분해 준다. 이 두 예후 분석 체계와 이번 연구 분석의 연령군 구분이 다른데, 이는 앞으로 우리나라 PCNSL를 많은 기관에서 대규모 자료 분석을 통하여 가장 적절한 연령 구분 방법을 찾을 필요성을 제기한다.
최근 서울아산병원의 PCNSL 환자 163명의 자료를 분석한 연구에서 B2MG 1.8 mg/L 기준이 예후 인자임이 보고되었다[2]. 하지만 대상 환자 수가 늘어난 이번 분석에서 서로 다른 수치의 B2MG을 살폈을 때, 2.0 mg/L가 전체 환자군에서 의미 있는 예후 인자였다. B2MG은 종양 부하와 연관된다고 알려져 있으며, 앞으로 이 B2MG이 갖는 예후 지표로써 적정 기준, IELSG나 MSKCC와는 또 다른 예후 점수 체계의 요소가 될 수 있을지 등에 대한 연구가 필요하다.
저자들은 PCNSL의 치료 후 실패 양상을 보고하였는데[13] 이번 분석에서도 중추신경계 내부 실패 없이 중추신경계 밖에서만 진행, 재발하는 경우가 모든 실패의 경우인 107명 중 6명(5.6%)으로 극히 적었다. 미국 종합 암 네트워크(National Comprehensive Cancer Network, NCCN)의 PCNSL 진료 지침[28]도 완전 반응 획득 후 감시 추적 검사의 영상은 뇌 자기공명영상(magnetic resonance image, MRI)만 언급하고 있다.
PCNSL의 NCCN 진료 지침[28] 가운데 몇 가지 항목들에 관해 언급해 보고자 한다. NCCN 진료 지침은 PCNSL에서 적극적인 CSF 검사를 권하고 있다. CSF 검사 지표들의 정밀한 표준화, CSF의 액상 생검 조직 진단 등이 가능해지면 PCNSL의 진단이 더 용이해지고, 예후 예측의 여러 지표들이 발굴될 것이다. 60세 이상 남성 PCNSL 환자에서 고환 초음파를 권하고 있다. 여성의 원발 유방 광범위 큰B세포림프종과 남성의 원발 고환 광범위 큰B세포림프종에서 중추신경계 침범이 많은 것은 잘 알려져 있는 사실이다. 그러나 300여 명이나 되는 이번 연구 대상 중에 이에 해당하는 예가 없었던 점을 고려해 보면, 역으로 PCNSL을 진단받은 환자에서 고환이나 유방 부위를 따로 영상 검사해야 하는지에 대해서는 앞으로의 연구들이 검토할 필요가 있겠다. NCCN 지침은 공고 요법으로 ASCT 시행이 어려운 경우 저선량 전뇌 방사선 치료를 권하고 있다. 삼성서울병원의 보고에 의하면, MTX 유도 요법 후 불변 내지 진행을 보인 PCNSL 환자에서 23.4 Gy의 저선량 방사선 요법이 양호한 결과를 보였고, 리툭시맵이나 ASCT 치료가 어려운 경우 효과적일 것이라고 하였다[29]. 따라서 ASCT가 적절하지 않은 PCNSL 환자군의 공고 요법, 재발 후 구제 요법으로 저선량 전뇌 방사선 조사를 적극 검토할 필요가 있겠다. 그리고 NCCN은 완전 반응 획득 후 5년이 지나서도 매년 뇌 MRI를 하면서 영구적으로 추적할 것을 권하고 있는데, 이는 큰 규모의 전향 연구 결과가 필요하며, 저자들 역시 향후 주시해야 할 부분이다.
서울아산병원을 포함한 과거 국내 PCNSL 연구 보고들[2,10-13,27,29-34]은 PCNSL의 특정하고 한정된 일부 항목만을 연구 분석한 것들이 대부분이다. 이번 연구에서는 PCNSL의 전체 임상 양상, 치료 성적, 생존 양상, 예후 인자 등을 망라하려고 노력하였다. 또한 단일 기관의 보고이기 때문에 일정 기간 동안은 동일한 검사와 같은 치료법을 동원한 실제 현실 세계 경험이다.
그러나 이 연구는 단일 기관의 연구라는 것이 도리어 제한점이 될 수 있다. 또한 후향 연구라는 큰 제한점이 있다. 이 연구는 건강보험의 적응증 제한, 많은 비용을 부담하면서 희귀의약품 센터를 이용해야 구할 수 있는 약제에 대한 환자 측의 거부감 등으로 인해 보다 다양한 치료책을 적극적으로 동원하는 데 어려움을 겪은 제한적 임상 성적에 대한 연구이다.
우리나라 PCNSL의 발생은 증가 일로에 있고, 고용량 MTX를 기반으로 한 유도 요법들의 변화가 치료 성적의 발전을 가져왔다. 젊은 연령군에서는 ASCT 적용으로 생존 성적이 매우 항상되었다. 따라서 이러한 21세기의 단일 기관 현실 세계 경험을 여기에 보고한다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Conceived and designed the analysis: H Cho, C Suh.
Collected the data: H Cho, JY Hong, DH Lee, S Kim, K Lee, EH Kang, S Lee, JS Park, JH Kim, JR Ryu, J Huh.
Contributed data or analysis tools: H Cho, C Suh.
Performed the analysis: H Cho, C Suh.
Wrote the paper: H Cho, C Suh.
Acknowledgements
이러한 연구가 가능하도록 원발 중추신경계림프종 진단과 치료의 현실 세계 경험을 함께 해 주신 환자분들과 보호자분들께 고맙습니다. 환자분들의 안녕을 빕니다. 환자 진료 에 함께 애써 주신 간호사 분들, 전공의, 임상 강사, 동료 교수진들이 계셔서 이 일이 가능했습니다. 특히, 제가 이 일을 하도록 이끌어 주신 김상희, 홍창기 두 분 교수님께 이 논문을 바칩니다.