흉부 CT에서 우연히 발견된 다발성 낭성 폐병변을 가진 32세 여성
A 32-Year-Old Female with Incidentally Detected Multifocal Cystic Pulmonary Lesions on Chest Computed Tomography
Article information
Trans Abstract
Lymphangioleiomyomatosis (LAM) is a rare condition that exclusively affects women and is characterized by lung parenchymal destruction and the formation of cysts due to infiltration by LAM cells. It can also impact the lymphatic system, leading to the development of fluid-filled cystic structures and abdominal involvement, including renal angiomyolipomas (AML) or lymphangioleiomyoma. LAM can occur sporadically or be associated with tuberous sclerosis complex. Common symptoms include respiratory issues such as dyspnea, pneumothorax, chylothorax, along with other manifestations like renal AML and lymphatic involvement. The diagnosis of LAM relies on a combination of clinical, radiological, and laboratory findings, and treatment options vary depending on symptoms and patient status, with mTOR inhibitors being considered as a treatment option. This case outlines the diagnostic journey and clinical course of a 32-year-old female patient with LAM.
증례: 32세 여자가 흉부 컴퓨터단층촬영(computed tomography, CT) 검사에서 우연히 발견된 다발성 낭성 폐병변(multiple cystic lung lesion)으로 내원하였다. 환자는 1년 전 소화기내과에서 직장의 악성 carcinoid neuroendocrine 종양을 진단받아 내시경적 점막 절제술을 시행받았고, 주위 조직 침윤이나 원발 전이 소견이 확인되지 않아 추가 치료 없이 경과 관찰 중이었다. 종양 진단 당시 병기 확인을 위해 시행한 복부 CT에서 폐하부의 낭성 폐병변이 우연히 확인되었고, 이에 대한 정밀 검사를 위하여 내원하였다.
환자는 비흡연자이며, 가족력이나 특이한 노출력은 기록되지 않았다. 환자는 미혼이었으며 출산 및 임신 경험이 없었고 내원 당시 복용 중이거나 최근에 복용한 약물이 없었다. 또한 호흡기 증상을 포함한 다른 증상을 호소하지 않았다. 내원 당시 시행한 신체진찰 및 활력징후, 혈액 검사에서 이상 소견은 확인되지 않았다. 폐기능 검사 결과 1초간 호기량의 폐활량 (forced expiratory volume in the first second, FEV1)은 96%, 노력성 폐활량(forced vital capacity, FVC)은 97%로 정상 범위였으나, 폐확산능(diffusing capacity for carbon monoxide, DLCO)은 63%로 다소 감소되었다. 흉부 고해상 CT (high resolution CT, HRCT)에서 양 폐 전반적으로 크기가 2 mm 내외의 작고 둥글며 얇은 벽을 가진 낭성 병변들이 넓은 범위로 분포하였다(Fig. 1A). 또한 복부 CT에서 1년 전과 비교하여 대동맥정맥(aortocaval), 대동맥주위(para-aortic) 및 우측 외장골반(right external iliac) 부위의 작고 다발성인 림프절비대가 새롭게 확인되었다(Fig. 1B). 악성 종양으로 인한 림프절 침범을 고려하여 추가로 시행한 양전자방출단층촬영(positron emission tomography)에서 해당 부위 림프절비대가 관찰되었으나, 대부분의 경우 F-fluorodeoxyglucose 섭취가 감지되지 않거나 일부에서는 매우 미미한 증가만 관찰되었다.
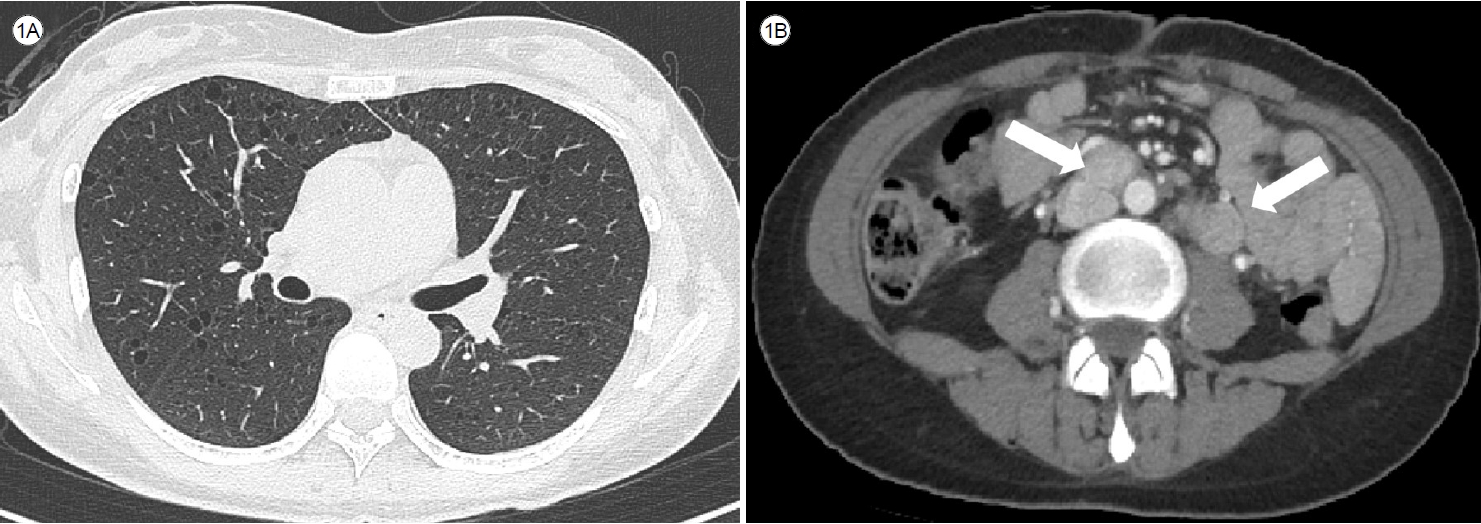
Computed tomography (CT) scan reveals numerous predominantly small, round, thinly-walled cysts diffusely distributed throughout both lungs (A). Additionally, multiple enlarged lymph nodes are observed in the aortocaval, para-aortic, and right external iliac area (arrows) (B).
환자는 흉부 CT에서 림프관평활근종증(lymphangioleiomyomatosis, LAM)이 의심되었으나 LAM의 동반된 합병증이 명확하지 않아 진단을 위해 조직 검사를 고려하였으며, 수술적 폐조직 검사를 시행하기 전 덜 침습적인 경기관지폐조직 검사(bronchoscopy-transbronchial lung biopsy, BFS-TBLB)를 시행하였다.
BFS-TBLB에서 cystic lesion이나 nodule 등 명확한 이상 소견은 관찰되지 않았으나, 획득한 폐조직에서 HMB45 양성 spindle cell이 확인되어 LAM cell의 침범이 의심되었다. 따라서 LAM 진단이 타당하다고 판단하였으며, 복부의 림프절비대는 LAM의 림프절 침범 때문일 가능성이 높다는 결론을 도출하였다. 환자는 DLCO가 다소 저하되었으나 FVC와 FEV1은 정상범위 내 있었으며, 특이한 호흡기 증상이나 합병증을 호소하지 않았다. 따라서 현재 합병증, 폐기능 그리고 복부 림프절비대에 대한 외래 추적 중이다.
서 론
LAM은 주로 가임기 여성에게 매우 드물게 발생하는 질환으로, 비정상적인 smooth muscle 세포와 유사한 LAM 세포의 침윤과 증식으로 인해 폐실질 파괴와 폐낭종 형성을 특징으로 한다[1]. 더불어 중추림프관(axial lymphatics)에 LAM 세포의 침윤으로 인해 림프관평활근종과 같은 유체가 가득한(fluid-filled) 낭성 구조물이 형성되며, 복부 침범으로 인한 신장 혈관근육지방종(angiomyolipomas, AML)과 같은 폐외 침범도 발생할 수 있다[2]. LAM은 산발적으로 발생할 수도 있고(sporadic LAM, S-LAM) 결절경화증(tuberous sclerosis complex, TSC)의 합병증으로 나타날 수 있다(TSC-LAM). TSC 환자의 최대 30%에서 LAM이 동반된다고 알려져 왔으나[3] 최근 연구 결과에 따르면 40세 이상의 TSC 환자에서 최대 80%까지 LAM의 유병률이 증가한다고 보고되었다[4]. LAM의 임상 증상은 침범하는 장기에 따라 다르지만, 주로 진행하는 호흡 곤란, 기흉, 유미흉(chylothorax)이나 AML을 포함한 복부 종양과 같은 증상을 나타낼 수 있다. 일반적으로 폐에 대한 증상이 우세하며, 종종 천식, 폐기종 또는 만성 폐쇄성 폐질환(chronic obstructive pulmonary disease, COPD) 등과 같은 다른 호흡기 질환으로 잘못 진단되어 진단과 치료가 지연될 수 있다.
본 론
LAM의 역학
S-LAM의 실제 발병률과 유병률은 알려지지 않았으나 대부분이 관찰 연구이며 TSC-LAM을 포함하기 때문에 실제 유병률이 과소평가되었을 가능성이 높다. 한 연구에서 LAM은 여성 1,000,000명당 약 3.4-7.8명에게 거의 독점적으로 발생한다고 보고되었으며[5], 남성에서는 매우 드물고 주로 TSC와 동반된다. LAM 환자 중 2/3는 발병 시기가 폐경 전 여성으로, 30-40대에서 가장 흔하게 나타나지만, 소아부터 노인까지 모든 연령에서 발생할 수 있다[6].
LAM의 병리생리학
LAM은 복잡한 질환으로, LAM 세포가 혈액 및 림프관을 통해 순환하고 폐에 침착하여 실질 파괴와 낭성 질환을 유발한다[2]. 종양 억제자 유전자인 TSC1 및 TSC2의 돌연변이는 mTOR 경로를 통한 부적절한 신호 전달을 유발하며, 이러한 돌연변이는 S-LAM 및 TSC-LAM 모두에서 나타난다[1]. 또한 LAM 세포는 림프관 생성을 증식하는 효과를 가진 혈관 내피 성장 인자(vascular endothelial growth factor, VEGF)-C 및 VEGF-D를 발현하며, 이는 LAM 세포의 전이 확산에 관여한다[7]. LAM은 주로 여성에서 발생하며 여성호르몬 수치가 급증하는 상황인 임신, 호르몬 피임 및 생리 중에 악화되며, 폐경 후에는 LAM 환자의 병세가 안정되는 경향이 있어 여성호르몬도 LAM의 병인 기전과 관련이 있을 것으로 추정된다[8].
LAM의 임상 양상
LAM은 여성에서 원인을 알 수 없는 호흡 곤란 및 원발성 자발성 기흉을 가진 경우에 고려해야 하는 질환이다. 그러나 LAM 환자 중 약 1/3은 기관지확장제 반응 양성인 기도폐색을 가지고 있어 종종 천식, 폐기종 또는 COPD와 같은 기도 질환으로 오진될 수 있다. 폐 전체에 다발성 폐낭종을 보이는 질환 중 감별이 필요한 진단은 폐랑게르한스세포조직구증(pulmonary Langerhans cell histiocytosis, PLCH), 폐기종, 소포성 세기관지염(follicular bronchiolitis), 림프구간질성폐렴(lymphoid interstitial pneumonia), Birt-Hogg-Dubé 증후군(Birt-Hogg-Dubé [BHD] syndrome), 경쇄침착 질환(light chain deposition disease) 등이 있다[6]. 폐낭종은 LAM의 특징적인 병변으로 흉부 HRCT 검사에서 확인되며, 얇은 벽을 가지고, 둥근 모양으로 양쪽 폐에 고르게 분포한다. 크기는 지름 2 mm에서 40 mm까지 다양하며, 내부에 다른 구조물과 관련이 없어서 비교적 깨끗하게 둘러싸여 있다. 이러한 특징들은 LAM 진단에 있어 특히 중요한 소견이다.
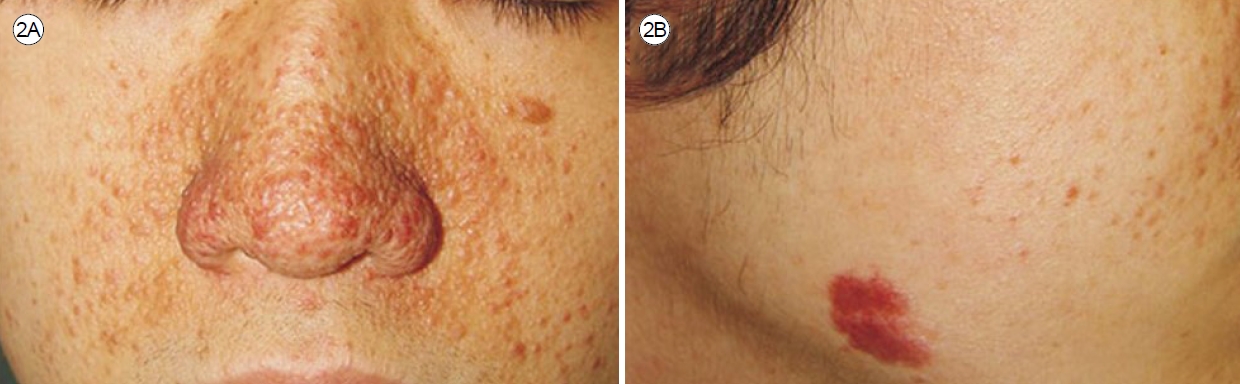
진단을 위해 모든 환자에게 흡연 및 직업력 이력을 확인해야 한다. 신체 검사에서는 대부분 정상이지만 일부 환자는 천명음, 수포음, 복부 종양 또는 TSC의 특징적인 증상을 보일 수 있다[3]. 2/3의 LAM 환자가 호흡 곤란을 경험하며, 호흡기 증상 중에는 기침, 감염 및 가슴 통증과 같은 증상이 약 25%에서 발생한다. 또한 객혈이나 림프관의 역류로 인한 기침, 피로감 등도 나타날 수 있다[6]. TSC의 피부징후인 안면혈관섬유종(angiofibroma, Fig. 2A), 샤그린 반점(shagreen patch, Fig. 2B), 조갑주위섬유종(periungual fibroma), 망막성 상세포종(astrocytoma) 등이 나타날 수 있으며[9] BHD 증후군의 특징인 안면섬유모낭종(fibrofolliculoma, Fig. 3A, B) 및 모원판종(trichodiscoma, Fig. 3C)과 같은 피부 징후가 관찰될 수 있다[10,11]. 또한 결체조직 질환의 소견을 찾아내기 위한 철저한 신체 검사가 필요하다.
기흉(pneumothorax)
LAM 환자 중 1/3은 기흉으로 발현하며, LAM에서의 기흉 발생 빈도는 일반 여성 인구에 비해 1,000배 높은 것으로 알려져 있다. 또한 LAM 환자의 50-80%가 질병 경과 중에 기흉을 경험하며, 재발이 빈번하게 발생한다[6].
흉수(pleural effusion)
흉수는 LAM 환자 중 10-30%에서 발생하며, 그중에서도 유미흉이 가장 흔하다. 이러한 흉수는 주로 일측(76%)이며 우측(63.2%)에 나타나지만 양측으로 발생할 수도 있다. 흉수는 림프구 우세의 삼출액이며 lactate dehydrogenase보다 단백질의 수치가 더 높고 고중성지방, 콜레스테롤 및 chylomicrons와 같은 특징을 가진다[12].
신장 AML
신장 AML은 S-LAM 환자 중 30%에서 발생하며 TSC-LAM 환자 중 최대 80%에서 발생한다[6,12]. S-LAM에서 AML은 일측성이며 대부분 증상이 없고, 양측성인 경우 주로 TSC와 관련이 있다. 신장 AML은 복부 CT 스캔에서 확인할 수 있다. AML로 인한 출혈은 소수의 LAM 환자에서 증상으로 나타날 수 있으며, 증상이 나타날 때 환자는 만져지는 복부 종괴나 복통을 호소한다[12].
림프관침범 증상(lymphatic involvement)
림프관평활근종(lymphangioleiomyomas)은 LAM 환자 중 16%에서 38%까지 나타나며, 무증상이거나 위치에 따라 관련 증상(통증, 하지부종, 복부팽만 등)이 나타날 수 있다. 림프절 비대(lymphadenopathy)는 주로 골반이나 후복막 부위에서 나타나며, LAM 환자 중 25%에서 77%까지 나타날 수 있다. 림프절비대는 중증도와 연관이 있다[12].
병리학적 소견
LAM의 병리학적 진단은 폐, 림프절 또는 체액에서 세포학적으로 LAM 세포를 확인해야 한다. 폐조직에서 LAM의 특징적인 병리학적 특징은 다양한 크기의 다수의 폐낭성 및 LAM 세포의 증식을 포함한다. 이러한 LAM 세포는 혈관 평활근과 유사하게 보이며, 멜라닌세포 표지자(HMB-45, Melan-A, tyrosinase, microphthalmia transcription factor, NKI/C3) 및 근육 표지자(smooth muscle actin, pan-muscle actin, muscle myosin, calponin)와 양성 반응을 나타낸다[12].
LAM의 진단
미국흉부학회와 일본호흡학회의 LAM 진단 및 관리 지침에 따르면, LAM의 확진은 임상적 특징, 영상 검사 및 혈액 검사 결과를 조합하여 수행된다[13].
LAM의 다학제적 진단 및 평가
LAM에 합당한 임상 병력은 주로 젊은 여성 또는 중년 여성에서 호흡 곤란, 기흉, 흉수 등의 증상을 보이며, 다른 낭성 폐질환과 관련된 증상, 예를 들어 눈과 입의 건조 증상, 결체 조직 질환 관련 소견, 상당한 흡연력, TSC 외 얼굴 피부 병변의 개인 및 가족력, 또는 신장 종양의 병력이 없어야 한다.
LAM의 진단은 기본적으로 LAM에 합당한 병력을 가진 자에서 HRCT를 통해 특징적인 폐낭성 변화를 확인함으로써 이루어진다. 이러한 조건을 충족하는 환자 중에서 TSC의 동반 여부, 신장 AML의 동반, 높은 농도의 VEGF-D (≥ 800 pg/mL), 유미성 액체 축적, CT에서 전형적인 림프관 침범 중 하나 이상이 관찰될 때 LAM의 임상적 확진이 가능하다[13].
LAM의 진단은 가능한 침습적이지 않은 방법을 사용하여 수립되어야 한다(Fig. 4). 흉부 HRCT에서 경미한 낭종 변화만 보이고 무증상인 환자의 경우, 침습적 검사를 고려하기 전에 환자가 잠재적인 LAM 진단 수용 여부를 확인해야 한다. 만약 환자가 잠재적 LAM 진단을 수용한다면 정기적인 추적 관찰만으로도 질병을 모니터링할 수 있다. HRCT는 간질성 폐질환의 폐병변을 진단하는 데 비침습적이고 정확한 검사로, LAM이 의심되는 환자에게는 1차 검사로 사용된다. 그러나 HRCT에서 LAM의 특징적인 양상이 나타나지만 추가적인 LAM 진단 특징이 없는 경우에는 HRCT 결과만을 기반으로는 낮은 특이도를 보이기 때문에 LAM의 확정 진단을 내리지 않기를 권장한다. 따라서 기능적 저하나 합병증이 동반되어 mTOR 억제제인 약물 치료를 사용하기 전에는 LAM 확진을 위한 조직 검사가 필요하다. 이러한 경우 수술적 조직 검사에 비해 덜 침습적인 BFS-TBLB를 먼저 시행 후 결과에 따라 필요시 수술적 조직 검사를 고려할 수 있다.
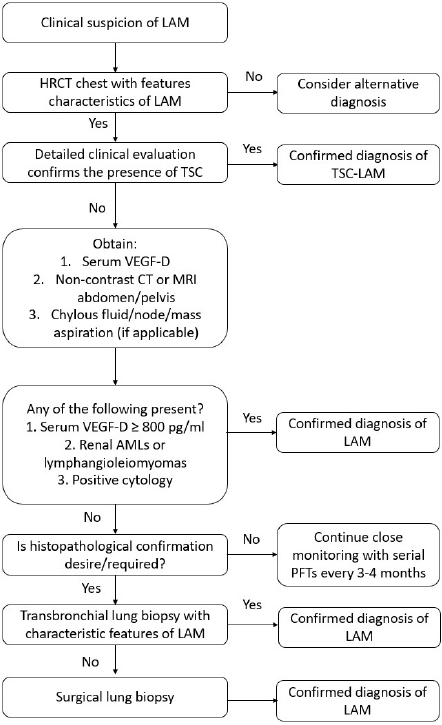
Proposed algorithm for the diagnosis of lymphangioleiomyomatosis (LAM) in a patient with compatible clinical history. The algorithm is designed as a step-wise, least-invasive approach to confirm the diagnosis of LAM. Modifications based on clinical judgment are often necessary, and diagnostic decisions should be tailored to each individual. Adopted from Gupta et al. [13] with permission. HRCT, high resolution computed tomography; TSC, tuberous sclerosis complex; VEGF-D, vascular endothelial growth factor-D; CT, computed tomography; MRI, magnetic resonance imaging; PFT, pulmonary function tests.
LAM의 치료 및 예후
LAM의 치료법은 증상의 심각성과 환자의 상태에 따라 다를 수 있다. 약물 치료로는 mTOR 억제제 중 하나인 sirolimus를 고려할 수 있다. Multicenter international lymphangioleiomyomatosis efficacy and safety of sirolimus (MILES) 임상시험 결과에 따르면, sirolimus를 복용한 환자군은 대조군에 비해 FEV1을 포함하여 FVC, 기능적 잔기량, 혈청 VEGF-D, 삶의 질 지표(EQ-VAS 점수)가 호전되었다. 그러나 6분 도보 검사 거리나 DLCO는 두 그룹 간에 유의한 차이가 나타나지 않았다[14]. MILES 하위 분석 결과에 따르면, 폐경 전 환자의 FEV1 감소 속도가 폐경 후 환자에 비해 5배 빨랐으며, 혈청 VEGF-D가 600 초과인 경우 FEV1 감소가 더 빨랐지만 sirolimus 치료에 더 잘 반응했다. 그러나 폐경 여부, 인종, 기관지확장제 반응성, 기저 FEV1, TSC 동반 여부는 FEV1 감소에 영향을 미치지 않았으며, sirolimus 치료는 이러한 요인과 상관없이 FEV1 감소를 안정화시켰다[15]. Sirolimus 사용은 3.5년 이상의 장기적 추적에서도 안정성이 입증되었지만 부작용이 나타날 수 있으며 질병 완치를 목표로 하지 않으므로 질병 진행 위험이 높은 환자를 신중하게 선별하고 치료 시기를 결정해야 한다. 폐기능이 정상 또는 경도 저하된 환자는 주로 추적 관찰이 권장된다. 그러나 중등도 FEV1 저하가 있거나 FEV1이 급속하게 감소하거나 chylous disease나 림프관평활근종과 같은 폐외 합병증이 동반된 경우 sirolimus 치료를 고려할 수 있다[7]. 다만 국내에서는 sirolimus 투약 시 FEV1이 70% 이하인 경우에만 급여 기준이 되므로, 치료 시작 시 환자의 FEV1 수치와 증상을 고려해야 한다. LAM 환자 중 70% 이상이 한 번 이상 기흉을 경험할 가능성이 높으며 재발 위험이 높다. 따라서 첫 번째 기흉 발생 이후 흉막유착술(pleurodesis)을 고려해야 한다. 이전 흉막 관련 시술은 폐 이식에 대한 금기가 아니며, 장기적으로 폐 이식이 필요한 경우 숙련된 흉부외과 이식 전문의와 상담이 필요하다[13]. 호르몬 치료는 효과가 없으며 일반적으로 사용되지 않는다. 또한 산소 치료 및 호흡 재활이 필요한 경우도 있으며, 중증 질환에서는 폐 이식을 고려할 수 있다[13].
결 론
LAM은 주로 여성에게 드물게 발생하는 질환으로 폐실질 파괴와 낭종 형성이 특징이다. LAM은 중추림프관에도 영향을 미치며 유체가 가득한 낭성 구조물 형성과 복부 침범, 신장 AML과 같은 복강 내 장기 침범도 가능하다. LAM은 산발적으로 나타날 수도 있고, TSC와 연관될 수 있다. LAM의 진단은 임상적, 영상학적, 혈액학적 검사 결과를 조합하여 이루어지며, 치료는 증상과 환자 상태에 따라 다양할 수 있다. 약물 치료로는 mTOR 억제제 투약을 고려하며, 비약물적 치료로는 호흡 재활 및 폐 이식을 고려할 수 있다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
This paper was supported by Soonchunhyang University Research Fund.
AUTHOR CONTRIBUTIONS
H.Y.Y. was responsible for study design, data collection and analysis, interpretation of results, and manuscript preparation.
Acknowledgements
None.