유방암의 호르몬 치료
Hormone Treatment for Breast Cancer
Article information
Trans Abstract
Hormone receptor-positive breast cancer accounts for 60-70% of all breast cancers and has a better prognosis than human epidermal growth factor receptor-2 (HER2)-positive or triple-negative breast cancer. Hormone treatment for breast cancer is an important treatment method that is effective and has few side effects for hormone receptor-positive breast cancer. Hormone therapy is performed as adjuvant therapy in early breast cancer and as palliative therapy in metastatic breast cancer. In the past decade, molecularly targeted agents against intracellular targets such as mammalian target of rapamycin (everolimus), cyclin-dependent kinase 4 and 6 (palbociclib, ribociclib, abemaciclib), and phosphatidylinositol 3-kinase (alpelisib) has offered patients effective therapeutic options, and combination of hormone treatment with the molecular agents have continued to improve the outcome of breast cancer.
서 론
유방암은 우리나라 여성에서 가장 흔한 암으로 2020년 국내 통계에 의하면 10만 명당 96명에서 발생하고, 발생률이 지속적으로 증가 추세를 보이는 암종이다[1]. 유방암은 종양의 분자생물학적 특성에 따라 네 가지 아형(subtype)으로 구분되며 각 아형에 따라 치료와 예후에 차이가 있다[2]. 유방암의 아형 중에 에스트로겐수용체(estrogen receptor, ER)나 프로게스테론수용체(progesteron receptor, PR)와 같은 호르몬 수용체 양성인 유방암이 가장 흔하고, 전체 유방암의 60-70%의 빈도를 보인다. 호르몬수용체 양성 유방암은 호르몬 치료를 시행하는 아형으로, 호르몬수용체 음성 유방암에 비해 예후가 좋다[3,4]. 본 논문에서는 유방암 치료에 사용되고 있는 호르몬 치료제의 종류와 현재 임상적으로 사용하는 호르몬 치료 방법에 대해 알아보고자 한다.
본 론
호르몬 치료제의 종류
유방암에서 사용하는 호르몬 치료제는 에스트로겐의 작용을 방해하거나 에스트로겐의 생산을 막음으로써 ER 양성인 종양의 성장을 저해한다. 이는 에스트로겐이 유방 종양의 발달과 성장에 관여하는 주된 호르몬이기 때문이다.
먼저 에스트로겐의 작용을 방해하는 약제에는 선택적에스트로겐수용체조절제(selective estrogen receptor modulator, SERM)와 선택적에스트로겐수용체분해제(selective estrogen receptor degrader, SERD)가 있다[5]. SERM에는 tamoxifen, raloxifene, toremifene 등이 있고, 이 약제들은 유방에서 ER에 대해 에스트로겐과 경쟁적으로 결합하여 에스트로겐길항제(estrogen antagonist) 역할을 한다. SERD에는 근육 주사를 하는 fulvestrant가 있고, SERM과 달리 길항제의 활성이 없이 에스트로겐수용체에 결합하여 수용체 단백질의 분해를 가속화시킴으로써 에스트로겐의 효과를 억제한다. 최근에는 SERD 경구 제제들인 elacestrant, camizestrant, amcenestrant, giredestrant 등이 개발되어 유방암에 대한 효과를 보고하고 있다[6].
에스트로겐의 생산을 막는 약제로는 아로마타제억제제(aromatase inhibitor, AI)가 대표적이다[7]. 폐경 후 여성에서는 아로마타제에 의해 안드로겐에서 에스트로겐으로 변화되어 에스트로겐이 생성되는데, AI는 이에 필요한 효소인 아로마타제를 억제함으로써 혈중 에스트라디올의 농도를 낮춘다. 현재 사용되는 3세대 AI 중 anastrozole과 letrozole은 비스테로이드성 제제로 아로마타제와 가역적 반응을 보이는 반면, exemestane은 스테로이드성 제제로 비가역적으로 반응하는 제제이다. 폐경 전 여성에서는 에스트로겐의 주요 생산 장소인 난소의 기능을 억제함으로써 혈중 에스트로겐의 농도를 낮출 수 있다. 영구적으로 난소의 기능을 억제하는 방법으로는 난소절제술이나 방사선 요법이 있고, 생식샘자극호르몬방출호르몬작용제(gonadotropin-releasing hormone agonist, GnRH agonist)는 뇌하수체로부터 나오는 신호를 방해하여 기능적으로 난소 기능을 억제하도록 한다[8].
보조 호르몬 치료(adjuvant hormone treatment)
보조 요법은 조기 유방암에서 수술 후 완치의 가능성을 높이기 위해 시행하는 치료로, 호르몬수용체 양성 유방암에서 보조 호르몬 치료를 시행한다[9]. 폐경 후 유방암 환자에서는 AI를 5년간 사용하는 방법[10,11], tamoxifen을 2-3년간 사용한 후 AI로 변경하여 5년간 호르몬 치료를 시행하는 방법[12,13], tamoxifen을 4.5-6년간 사용한 후 AI로 변경하여 5년을 추가로 투여하는 방법을 시행한다[14].
폐경 전 유방암 환자에서는 tamoxifen을 5년간 사용하는 방법, GnRH agonist와 tamoxifen을 병용하여 5년간 사용하는 방법, GnRH agonist와 AI를 병용해서 5년간 사용하는 방법이 있다[8,15]. 장기 추적에서 GnRH agonist를 병용하는 요법에서 재발률이 낮아졌으나 병용하는 약제의 부작용을 고려하여 젊은 여성, 림프절 양성, 나쁜 분화도 등 고위험군에서 선택하도록 권고한다[16]. 진단 당시 폐경 전 유방암 환자는 선행 항암 치료 혹은 보조 항암 치료 이후와 tamoxifen 복용 중 무월경 상태를 나타낼 수 있기에 황체형성호르몬(luteinizing hormone, LH), 난포자극호르몬(follicle-stimulating hormone, FSH), 에스트라디올(estradiol)을 측정하여 확실한 폐경 여부를 확인해야 한다. 5년간의 tamoxifen 보조 요법 이후 폐경이 된 경우는 5년간 AI를 추가로 투여하는 것을 권하고, 폐경되지 않은 경우는 10년간의 tamoxifen 연장 요법을 고려할 수 있다[17].
호르몬수용체 양성, human epidermal growth factor receptor-2(HER2) 음성의 조기 유방암에서 림프절 전이가 4개 이상 있거나 림프절 전이가 1-3개가 있고 종양 크기가 5 cm 이상 혹은 조직학적 3등급을 보이는 경우를 재발 고위험군으로 정의한다. 재발 고위험군에 대하여 cyclin-dependent kinase (CDK) 4/6 inhibitor인 abemaciclib의 2년 병합 치료의 효과를 보고하였고[18] 2기 이상의 조기 유방암에서 CDK 4/6 inhibitor인 ribociclib의 병합 치료의 효과를 보고하기도 하였기 때문에 치료 선택에 고려할 필요가 있다.
완화 호르몬 치료(palliative hormone treatment)
호르몬수용체 양성, HER2 음성의 전이성 유방암 환자의 경우 우선적으로 완화 호르몬 치료를 시행한다[4]. 최근 호르몬수용체 양성 전이성 유방암의 치료 효과가 많이 개선되었는데, 이는 호르몬 치료와 표적 치료를 병행함으로써 유의한 생존율의 향상을 보이는 연구들이 발표되었기 때문이다.
대표적인 표적 약제인 CDK 4/6 inhibitor는 암세포 분열과 성장을 조절하는 세포 주기인 G1 주기에서 CDK 4/6를 선택적으로 억제함으로써 암세포의 증식을 막는 역할을 한다. 사용하는 약제로는 palbociclib, ribociclib, abemaciclib이 있으며, 호르몬수용체 양성, HER2 음성의 유방암에서 호르몬 치료와 병행하여 치료 효과를 유의하게 향상시키는 것으로 나타났다.
이전에 호르몬 치료를 받은 적이 없거나 보조 호르몬 치료 종료 후 1년 이상 경과된 재발 및 전이성 유방암 환자에서는 1차 완화 호르몬 치료를 시행하고, 보조 호르몬 치료동안 혹은 종료 후 1년 이내에 재발한 경우나 전이성 유방암에 대한 호르몬 치료 동안 진행한 경우의 유방암 환자에서는 2차 완화 호르몬 치료를 시행한다. 완화 호르몬 요법에서 최적의 순서와 약제는 완전히 정해지지는 않았으나 이전의 치료 이력과 환자의 동반 질환에 따라 결정할 수 있다.
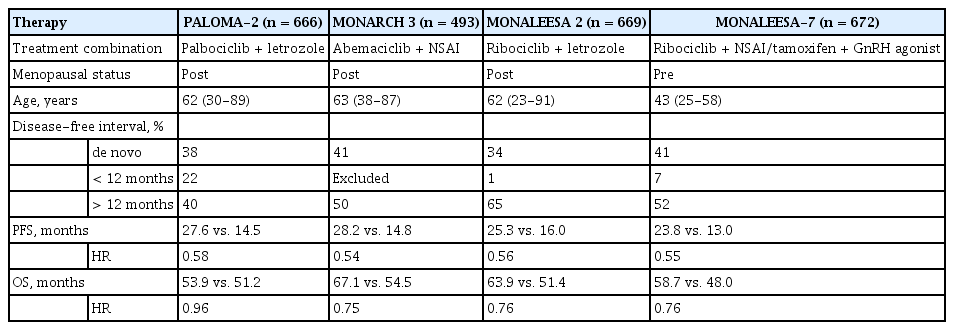
1차 완화 호르몬 치료는 AI와 CDK 4/6 inhibitor의 병용 요법이 가장 추천된다. 발표된 3상 임상 연구들에 따르면, 폐경 전 유방암 환자의 경우는 난소 절제 혹은 GnRH agonist를 사용하여 폐경 후 환자와 같이 AI를 기본적인 호르몬 요법의 약제로 사용하였고, AI와 palbociclib, ribociclib, abemaciclib 중 하나의 CDK 4/6 inhibitor와 병합하였을 때 AI 단독에 비해 무진행 생존 기간이 향상되는 것을 보였다. 대표적으로 CDK 4/6 inhibitor와 AI를 병용한 3상 임상 연구들의 결과는 표 1에 있다[19-22]. 폐경 후 유방암 환자를 대상으로 시행한 임상 연구에서 무진행 생존 기간에 대해서는 3가지의 CDK 4/6 inhibitor에서 비슷한 결과를 보고하였고, 전체 생존 기간에 대해서는 ribociclib의 병합 요법에서 유의하게 연장되는 것을 보고하였으며, abemaciclib의 병합 요법은 최종 결과를 기다리고 있다. 폐경 전과 폐경 이행기 유방암 환자를 대상으로 시행한 MONALEESA-7 연구는 AI, GnRH agonist, ribociclib의 병용 요법이 무진행 생존 기간과 전체 생존 기간을 유의하게 연장시키는 것으로 보고하였다[22]. CDK 4/6 inhibitor들의 부작용은 약제마다 차이가 있는데, palbociclib과 ribociclib에서는 혈구감소증의 빈도가 높고, abemaciclib에서는 설사와 혈전증의 빈도가 높으며, ribociclib에서는 QT 연장이 나타날 수 있어 부작용을 고려한 약제 선택이 필요하다. 또한 주기적인 혈구감소증에 대한 확인과 그에 따른 용량 조절이 필요하고, 설사에 대한 예방적 약제의 사용 및 피부 발진, 신장 및 폐기능 저하 등의 부작용에 대한 주의가 필요하다.
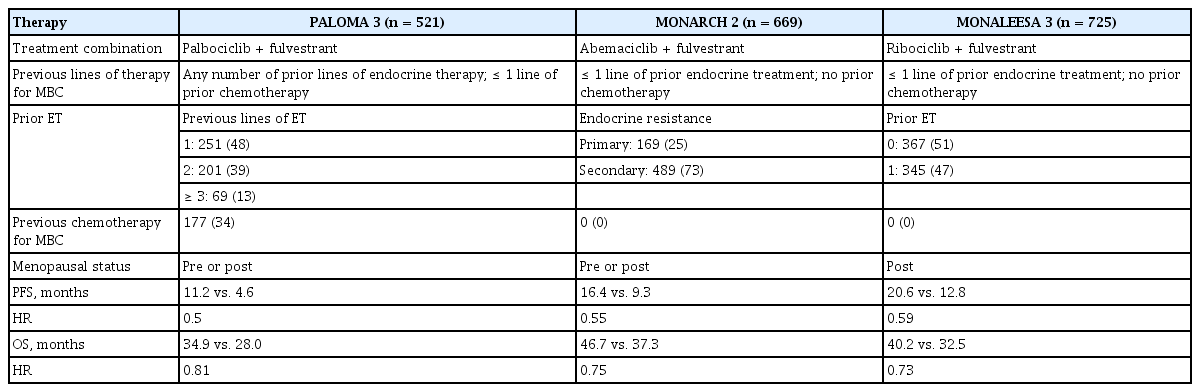
2차 완화 호르몬 치료는 fulvestrant를 기본적인 호르몬 요법의 약제로 사용하였고, palbociclib, ribociclib, abemaciclib 중 하나의 CDK 4/6 inhibitor를 병합하는 요법을 보고하였다. 이는 이전에 CDK 4/6 inhibitor를 사용하지 않은 유방암 환자에서의 연구로, fulvestrant 단독 요법과 비교하여 3가지의 CDK 4/6 inhibitor 병합 요법에서 비슷한 무진행 생존 기간의 연장을 보고하였다. 전체 생존 기간에 대해서는 ribociclib과 abemaciclib 연구에서 통계학적으로 유의하게 연장시키는 것으로 보고하였으나 다양한 환자군을 포함한 palbociclib 연구에서는 통계학적인 유의성을 보이지는 않았다. 대표적인 3상 임상 연구들의 결과는 표 2에 있다[23-25].
CDK 4/6 inhibitor를 사용할 수 없는 환자에서는 호르몬 치료 단독 요법을 시행할 수 있고, 폐경 전 환자에게는 tamoxifen과 GnRH agonist 병용 요법을 시행하며, 폐경 후 환자에게는 AI 단독 요법과 fulvestrant 단독 요법으로 치료를 시행한다. 그리고 조직학적 유전자 변이를 바탕으로 치료 결정을 할 수 있기에 조직 검사 혹은 혈액 검사를 통해 유전자 변이를 확인하는 것을 권한다. 호르몬 양성 유방암의 치료 중 30-40%의 환자에서 estrogen receptor 1 (ESR1) 유전자 변이가 발생하고, 이는 특히 AI 치료에 대한 내성을 보이고 나쁜 예후를 나타내는 인자이다[26]. CDK 4/6 inhibitor를 사용한 이후 진행한 환자에서는 새로운 SERD 경구 제제들을 사용한 연구에서 유의한 효과들이 보고되고 있고, elacestrant의 경우 ESR1 유전자 변이를 가진 진행성 전이성 유방암에서 유의하게 무진행 생존 기간을 연장시켰음을 보고하였다[27].
호르몬수용체 양성 유방암에서 흔한 유전자 변이는 phosphatidylinositol 3-kinase (PI3K)/AKT/mammalian target of rapamycin (mTOR) 신호전달체계에서의 변이로, 신호전달체계의 경로를 차단하는 약제들이 개발되어 호르몬 치료와 병합하는 임상 연구들이 진행되었다. 먼저 mTOR 억제제인 everolimus에 대한 3상 임상 연구인 BOLERO-2 연구는 1차 호르몬 치료에 실패한 호르몬수용체 양성, 폐경 후 유방암 환자에서 exemestane과 everolimus를 병행하여 효과를 입증하였다[28]. 연구 결과 exemestane 호르몬 단독 요법과 비교하여 everolimus 병합으로 무진행 생존 기간을 유의하게 연장하였다. 그리고 PIK3CA 유전자 변이가 확인된 호르몬수용체 양성 유방암 환자에서 PI3K의 α-subunit에 대한 선택적 억제제인 alpelisib을 병용한 3상 임상 연구가 보고되었다[29]. SOLAR-1 연구에서 1차 호르몬 치료에 실패한 호르몬수용체 양성, HER2 음성, 폐경 후 유방암 환자에서 fulvestrant와 alpelisib을 병용한 요법이 PIK3CA 유전자 변이가 있는 경우 fulvestrant 호르몬 단독 요법과 비교하여 무진행 생존 기간을 통계학적으로 유의하게 연장하였다. 치료 시에는 이러한 약제들의 부작용을 예방하고 조절하는 것이 중요하다. Everolimus의 부작용인 구내염은 덱사메사손 가글로 예방하는 것이 필요하고, alpelisib의 부작용인 고혈당과 발진, 설사에 대한 예방 및 초기 치료가 필요하다.
결 론
유방암의 호르몬 치료는 호르몬수용체 양성 유방암에 있어서 효과적이고 부작용이 적은 중요한 치료 방법이다. 이는 항암 화학 요법에 비해 상대적으로 약물로 인한 이환율이 낮고 재발률 및 유방암으로 인한 사망률을 감소시키며 환자의 삶의 질 측면에서 매우 유용한 치료이다. 최근에는 호르몬수용체 양성, HER2 음성 유방암에서 CDK 4/6 inhibitor의 효과가 입증되어 전이성 유방암에서 CDK 4/6 inhibitor와 호르몬의 병합 치료가 권장되고 있으나, CDK 4/6 inhibitor의 부작용을 고려하여 약제를 선택해야 한다. 또한 조기 유방암의 고위험군 환자에서 CDK 4/6 inhibitor와의 병합 치료와 호르몬 치료에 내성을 가진 전이성 유방암에서 새로운 호르몬 치료의 효과와 다양한 표적 치료와의 병합 치료 결과들이 보고되고 있다. 앞으로도 유방암의 호르몬 치료에 대한 연구들이 발표되어 사용하는 호르몬 치료 방법들이 다양해질 것으로 기대된다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
This study was supported by a Dong-A university research fund.
AUTHOR CONTRIBUTIONS
Suee Lee initiated and wrote the manuscript.
Acknowledgements
None.