복막 투석을 하는 환자에서 실어증으로 나타난 비케톤성 고혈당증 1예
A Case of Aphasic Seizure as a Manifestation of Nonketotic Hyperglycemia in a Patient Undergoing Peritoneal Dialysis
Article information
Trans Abstract
Peritoneal glucose absorption in peritoneal dialysis causes hyperglycemia. Nonketotic hyperglycemia (NKH) includes hyperosmolar hyperglycemic state, which refers to a condition that includes hyperglycemia, hyperosmotic pressure, and dehydration without severe acidosis. NKH is associated with various types of epileptic seizures, but aphasic seizure as a neurological complication of NKH is very rare. Here we report a case of aphasic seizure in a patient with NKH who underwent peritoneal dialysis. A 57-year-old man who had been undergoing peritoneal dialysis visited our hospital with the chief complaint of aphasia. His magnetic resonance imaging scan was normal, but his electroencephalography showed frequent generalized delta slow activity as well as epileptiform discharges originating from the left frontotemporal lobe. His dialysis modality was switched to hemodialysis and he was started on insulin for glucose control. The latter resulted in the disappearance of his seizures and of his aphasia.
서 론
신기능이 정상인 당뇨병 환자에 비해 당뇨병 신 질환이 있는 환자는 더 심한 인슐린 저항성을 보인다고 알려져 있다[1]. 또한 복막 투석을 통해 체내로 흡수된 포도당은 경구로 섭취한 포도당에 비해 고혈당증이 더 오래 지속된다고 알려져 있다. 따라서 말기 신 질환으로 진행한 당뇨병 신 질환 환자에서 복막 투석 중 지속되는 고혈당은 합병증을 유발할 확률이 높다.
비케톤성 고혈당증(nonketotic hyperglycemia, NKH)이란 심한 산증이나 케톤혈증이 없으면서 고혈당, 고삼투압, 탈수 등을 일으키는 상태로[2], NKH는 당뇨병 케토산증(diabetic ketoacidosis, DKA)에 비해 신경학적 증상을 잘 유발한다. 그 양상은 국소적 경련 발작으로, 운동 발작에 대한 보고가 가장 많다[3]. 저자들은 복막 투석을 받는 당뇨병 신 질환 환자에서 NKH로 인해 실어증을 보였던 증례를 경험하고 치료하였기에 이에 대해 문헌 고찰과 함께 보고하는 바이다.
증 례
환 자: 57세 남자
주 소: 실어증
현병력: 2일 전부터 반복되는 언어 장애 때문에 병원을 방문하였다. 상대방의 이야기를 이해할 수는 있으나 순간적으로 말이 나오지 않는 증상이 30초가량 하루 3-4회 정도 지속되는 양상이 반복되었으며, 시간이 지날수록 증상이 빈번해지며 지속 시간이 늘어났다고 하였다. 증상 발현 당시 의식 변화나 사지 경련은 없었다고 하였다. 내원 1일 전 외부 응급실을 방문하였고 증상이 소실되어 귀가하였다. 내원 당일에도 증상이 다시 발생하였으며 국소적 경련 발작까지 동반되어 본원 응급실로 내원하였다.
과거력: 25년 전 당뇨병을 진단받았으며 경구혈당강하제로 혈당 조절 중이었다. 복용 중인 약물은 pioglitazone 30 mg/day, gliclazide 30 mg/day, gemigliptin 50 mg/day였다. 12년 전에 발생한 우측의 시상섬유막부위(thalamocapsular lesion) 뇌경색으로 인해 내원 당일까지 aspirin 100 mg/day 복용 중이었다. 4년 전부터는 당뇨병으로 인한 말기 신 질환으로 복막 투석을 시행해 왔다. 복막 투석은 지속적 자동 복막 투석(continuous cyclic peritoneal dialysis)으로 유지 중이었다. 낮 동안에는 extraneal 7.5% 1,500 mL를 15시간 동안 저류하였고, 밤에는 physioneal 2.5% 2,000 mL를 9시간 동안 4주기 교환하였다.
가족력: 아버지는 파킨슨병으로, 어머니는 당뇨병 신 질환으로 치료 중이었다.
신체 진찰 소견: 내원 당시 혈압은 123/71 mmHg, 맥박수는 73회, 체온은 36.3℃였다. 신경계진찰에서 의식은 명료하고 시간, 사람, 장소에 대한 지남력은 정상이었으나 언어기능 평가에서 유창성이 떨어져 있었고, 따라 말하기 검사, 물건 이름대기 검사에서 이상을 보이고 있었다. 이해력은 보존되어 있었고 다른 뇌신경진찰 결과, 운동과 감각 검사, 병적 반사신경은 정상이었다.
검사실 소견: 말초혈액 검사상 백혈구 7,500/mm3 (호중구 72.9%, 림프구 18.8%, 단핵구 5.5%), 혈색소 11.3 g/dL, 혈소판 277,000/mm3로 특이 소견은 없었다. C-반응성 단백질은 0.10 mg/dL (참고치, < 0.5 mg/dL)로 정상이었고, 적혈구 침강 속도는 57 mm/h (참고치, 0-20 mm/h)로 다소 증가되어 있었다. 혈청 화학 검사에서 혈중 요소질소 40 mg/dL, 크레아티닌 9.64 mg/dL로 증가되어 있었다. 아스파테이트아미노전이효소 28 IU/L, 알라닌아미노전이효소 19 IU/L, 알칼리인산분해효소 99 IU/L로 정상 범위였다. 혈액 검사에서 혈당은 416 mg/dL로 상승해 있었고 당화혈색소는 11.2%였다. 혈청 오스몰 농도는 305 mOsm/kg, 혈청 케톤체는 음성이었다. 혈청 칼슘과 다른 전해질, 암모니아, 근육 효소는 정상이었다.
영상 소견: 응급실에서 시행한 확산조영영상(diffusion-weighted image)을 포함한 자기공명영상(magnetic resonance imaging, MRI)에서는 급성 뇌경색 병변이나 다른 뇌실질 이상, 조영되는 병소는 없었다(Fig. 1).

Initial MRI of the brain. Neither an acute ischemic lesion nor another abnormality was seen on (A) DWI or (B) FLAIR. MRI, magnetic resonance imaging; DWI, diffusion weighted image; FLAIR, fluid attenuated inversion recovery.
뇌파 검사 소견: 뇌파 검사에서 배경파는 정상 소견이었으나 전반적으로 빈번한 델타 서파 활동(frequent generalized delta slow activity)이 관찰되었다. 또한 좌측 전측두엽에서 시작되는 간질파(epileptiform discharge)가 관찰되었다(Fig. 2A). 간질파 확인 후 바로 lorazepam 2 mg을 투여하였다.
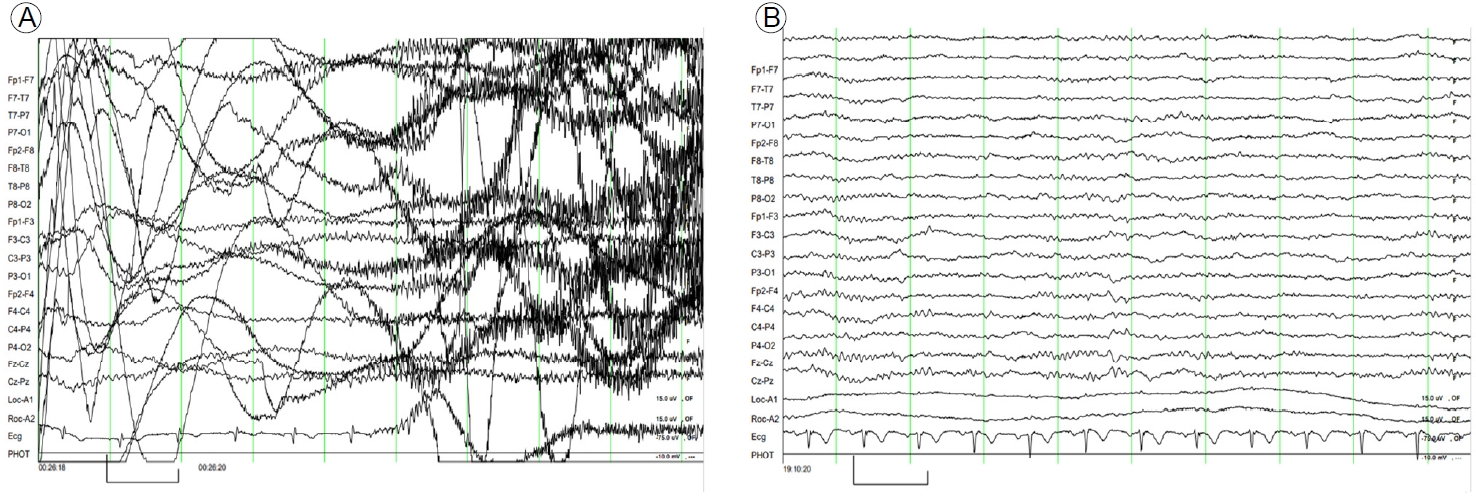
Initial electroencephalography (EEG) showing (A) frequent generalized delta slow activity. Epileptiform discharge in the left frontotemporal area is seen. (B) At hospital day 3, the EEG shows occasional generalized theta slow activity. Epileptiform discharge is no longer detectable.
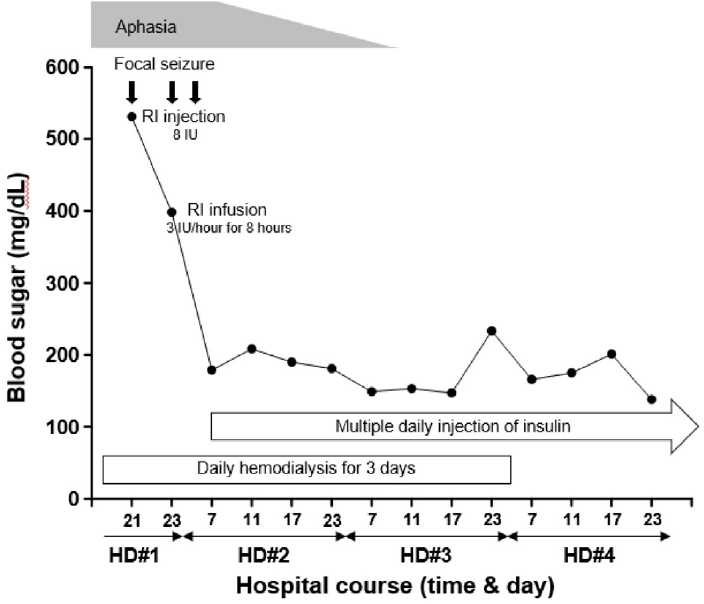
임상 경과 및 치료: 혈당 조절을 위하여 내원 시부터 인슐린을 피하 주사하여 혈당을 200 mg/dL 미만으로 조절하였다. 또한, 복막 투석이 환자의 고혈당에 영향을 미쳤을 것으로 판단하여 터널형 투석용 중심정맥 카테터를 삽입하고 혈액 투석으로 전환하였다. 환자는 뇌 MRI에서 정상 소견을 보였고 뇌파에서 간질파가 확인되어 실어증 및 발작과의 연관성을 의심하여 valproate acid 20 mg/kg intravenous (IV) loading 하였고, 12시간마다 10 mg을 IV로 투여하였다. 하지만 국소적 경련 발작은 조절되지 않아 levetiracetam 1 g을 투여하였다. 환자는 입원 2일째 언어기능 검사에서 유창성은 약간 저하되었으나 물건 이름대기, 따라 말하기는 정상으로 회복되었고, 입원 3일째에는 정상적인 언어 능력을 회복하였다. 이후 증상 재발은 없었고, 추적 관찰한 뇌파(Fig. 2B)에서도 간헐적인 세타 서파의 활동(occasional generalized theta slow activity) 외에 간질파 등은 확인되지 않아 levetiracetam 500 mg/day로 감량하여 퇴원하였다. 환자의 임상 경과를 요약하면 그림 3과 같다.
고 찰
포도당은 지난 40년간 복막 투석의 주요한 삼투제로 사용되어 왔다. 복막 투석에서의 이상적인 삼투제는 복강 내에서 전신순환계로 들어가더라도 쉽게 대사되어 인체에 축적되지 않고 독성이 없으면서 삼투압을 유지할 수 있어야 한다[4]. 하지만 복막 투석의 삼투제인 포도당은 혈당을 높이는 것으로 알려져 있는데, 복막 투석을 시작한 405명의 비당뇨병 말기 신 질환 환자 중 8.3%가 복막 투석 1개월 후 200 mg/dL 이상의 공복 혈당을 보였으며 126-200 mg/dL인 환자는 19.6%나 되었다[5].
복막 투석에서 포도당의 사용은 고혈당 외에도 이상지질 혈증, 비만 등을 야기할 수 있으며 장기적으로는 복막에 직접적인 손상을 주거나 포도당 분해 산물(glucose degradation products, GDP)을 통해 손상을 줄 수 있다. GDP란 포도당을 가열 살균하면서 나오는 분해 산물로 이는 복막과 전신에 독성을 가진다. 이를 피하기 위해 포도당 중합체의 일종인 아이코덱스트린(icodextrin)이나 아미노산을 사용한 복막 투석액이 사용될 수 있으며, 이 경우 포도당을 사용하는 복막 투석액에 비해 고혈당이 적게 유발된다고 보고되었다[6].
고혈당으로 인해 DKA와 고혈당고삼투질상태(hyperosmolar hyperglycemic state, HHS)를 보이기도 한다. 이들은 1형당뇨병 및 2형당뇨병 모두에서 발생할 수 있으며, 고혈당으로 인한 극심한 대사 장애로 인해 발생하는 것으로 알려져 있다. 이로 인하여 쇼크, 의식불명 상태, 심해지면 죽음까지 이를 수 있다[7].
NKH의 경우, 임상적으로 경미한 고혈당부터 HHS까지 다양한 경과를 보일 수 있다[2]. NKH 환자의 약 25% 정도에서 경련 발작이 동반될 수 있는데, 최대 50%에서 첫 징후로 나타날 수 있다는 보고도 있다[8]. Schwechter 등[9]은 기질적 뇌 병변이 없는 경우에도 고혈당 그 자체로 경련을 일으킬 수 있다고 보고하였고, 가역적 국소 허혈 및 발작 역치를 감소시키는 뇌혈류의 국소적 감소도 보고하였다. 또한 고혈당증이 억제성 신경전달물질인 감마아미노뷰티르산(gamma-aminobutyric acid, GABA)의 대사를 증가시켜 GABA 농도가 감소하므로 경련이 유발된다는 보고도 있다. 반면에 케톤산증이 있는 경우에는 NKH에 비해 경련의 발작 빈도가 낮은데, 그 이유로 글루탐산카복실기제거효소(glutamic acid decarboxylase)의 활성화가 GABA 농도를 증가시키기 때문이라고 추측하고 있다[10].
본 증례에서는 뇌경색의 과거 병력은 있었으나 응급실 뇌 MRI에서 급성 병변은 보이지 않았던 환자가 실어증과 경련으로 내원하였다. 환자는 혈당 조절이 잘 되지 않는 상태였다. 케톤산증은 보이지 않았고, 혈청 오스몰 농도는 정상에 가까운 상태로 NKH에서 신경학적 발작 빈도가 높다는 보고와 부합하였다. NKH에 의한 실어증 발작은 매우 드물기에 뇌경색, 일과성 허혈 발작, 대사 뇌 병증과 감별이 필요하여 각종 검사를 시행하였다. 적절한 치료가 지연될 경우 심각한 후유증을 남길 수도 있기 때문에 복막 투석 대신 혈당 조절에 유리한 혈액 투석을 단기간 실시하였다. 신경학적 증상이 소실된 후, 환자 및 보호자 모두 복막 투석을 선호하여 인슐린 투여를 실시하며 복막 투석으로 다시 전환하였고 혈당 조절이 적절히 이루어지면서 외래에서 추적 관찰 중이다.
본 증례에서는 환자에게 급성으로 심각한 신경학적 합병증이 발생하여 일시적으로 혈액 투석을 시행하였지만 실어증 발작을 일으켰는데, 혈당 조절이 잘 되지 않았다는 점이 가장 주요한 원인으로 보인다. 실어증이 복막 투석 자체의 문제에 기인하였다면 복막 투석을 시행했던 지난 4년 내에 실어증이 발생했을 가능성이 높기 때문이다. 하지만 그렇지 않았으므로 매우 불충분한 혈당 조절이 원인일 가능성이 높다. 따라서 혈당 조절만 잘해준다면 혈액 투석으로의 전환 없이 복막 투석을 유지하면서 증상이 호전되었을 가능성도 있다. 그럼에도 불구하고 단기간 혈액 투석으로 전환했던 이유는 본원에 내원 전, 외부 병원에서 인슐린으로 혈당이 조절되었으나 귀가 후 복막 투석을 실시하면서 증상이 재발하였다는 점과, 이로 인해 혈당 조절만 실시하는 치료법에 대해 보호자의 불신이 증가되어 있었기 때문이다. 이러한 이유로 혈당 조절이 확실한 신대체 요법으로 단기간 혈액 투석을 실시하였다. 흔히 사용되는 복막 투석액의 포도당 농도는 1.5%, 2.5%, 4.25% 세 종류이며, 100 mg/dL를 정상 혈당으로 간주한다면 이는 정상인의 혈중 포도당 농도보다 15배, 25배, 42.5배나 높은 농도가 된다. 반면에 혈액 투석액의 포도당 농도는 100 mg/dL이므로, 뇌실질 병변에 의한 실어증이 아니라 고혈당에 의한 실어증이었음을 임상적으로 빠른 시간 내에 증명하는 데 복막 투석보다 유리하기 때문에 단기간의 혈액 투석을 시도하였다. 하지만 시간이 좀 걸리더라도 혈당 조절만 잘해준다면 혈액 투석으로의 전환 없이 복막 투석을 유지하면서 증상이 호전되었을 가능성은 분명하다. 상기 증례를 통해, 복막 투석을 하는 환자에서 혈당 조절을 좀 더 철저하게 하는 것이 이러한 신경학적 합병증 예방에 도움이 될 것으로 생각된다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Jae Sung Ahn wrote the manuscript and analyzed the data. Dongyeon Lee, Joohee Jeon, Jae-Chan Ryu collected the data and edited the manuscript. Jai Won Chang revised the manuscript.
Acknowledgements
None.