2개월간 지속된 전신 무력감과 식욕 감소로 내원한 78세 남자
A 78-Year-Old Man with Weakness and Loss of Appetite for 2 Months
Article information
Trans Abstract
The incidence rate of tuberculosis (TB) in Korea has been consistently decreasing, but the proportion of extrapulmonary tuberculosis (EPTB) remains relatively stable at around 20%. Diagnosing EPTB remains a challenge because clinical samples obtained from relatively inaccessible sites may be paucibacillary, thus reducing the sensitivity of diagnostic tests. Delayed diagnosis and treatment some form of EPTB, such as tuberculous meningitis, can lead to fatal outcomes. Therefore, it is crucial to have a high index of suspicion and perform appropriate testing early on. Obtaining a specimen from the lesion and conducting microbiological tests (acid-fast bacilli smear, mycobacterial culture, and nucleic acid amplification test) along with histopathological examination is essential. When the specimen is limited for all testing, mycobacterial culture test should be prioritized as it has the highest diagnostic yield and allows for drug susceptibility testing. All patients with presumed EPTB should be assessed for pulmonary TB to assess infectiousness and potentially assist with diagnosis.
78세 남자가 약 2개월간 계속된 전신 무력감과 식욕 감소로 병원에 입원하였다. 마른 기침이 약간 있었고 흉통은 없었다. 3개월 전에 coronavirus disease 2019 (COVID-19)를 진단받고 치료받았으며, 당뇨병약을 복용하고 있었다. 입원 시 활력징후는 혈압 100/60 mmHg, 맥박 110회/분, 호흡 16회/분이었다. 체온은 38.0℃였으나 열감은 호소하지 않았다. 혈액 검사에서는 백혈구 8,050/mm3, 헤모글로빈 12.2 g/dL, 혈소판 244,000/mm3, C-reactive protein (CRP) 46.1 mg/L였다. 흉부 X선에서 심비대가 확인되어 심초음파 검사와 흉부 computed tomography (CT)를 시행하였고, 다량의 심낭 삼출액이 확인되어 심장막 천자를 시행하였다. 심장막액 검사 결과는 백혈구 1,315/mm3 (호중구 32%, 림프구 57%), 단백 5,700 mg/dL, 포도당 151mg/dL, lactate dehydrogenase (LDH) 451 U/L, adenosine deaminase (ADA) 99.2 IU/L였다. 심장막액으로 시행한 결핵도말 검사 결과는 음성이었으나 결핵 유전자에 대한 중합효소 사슬 반응(polymerase chain reaction, PCR) 검사가 양성으로 확인되어 결핵성 심낭염으로 진단하였고 항결핵제와 스테로이드 치료를 시작하였다.
서 론
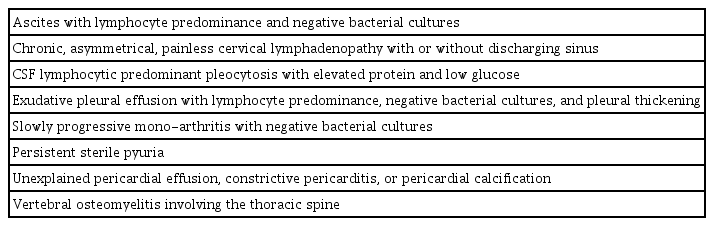
결핵은 발생 부위에 따라 폐결핵과 폐외 결핵으로 구분한다. 폐결핵을 동반한 폐외 결핵은 폐결핵으로 분류하며, 좁쌀 결핵도 폐에 병변이 있기 때문에 폐결핵으로 분류한다. 폐 이외의 장기인 림프절, 복부, 골관절, 신경계 등에 발생한 결핵뿐만 아니라 영상 검사에서 폐실질을 침범하지 않은 종격동 림프절염, 결핵성 심낭염, 결핵성 흉막염도 폐외 결핵으로 분류한다[1]. 질병관리청 자료에 따르면 2021년 국내 결핵 신규 환자 수는 18,335명(10만 명당 35.7명)으로 2011년 최고치(39,557명)를 기록한 후 꾸준히 감소하고 있다. 이 중 폐외 결핵은 약 20-23%를 차지하는 것으로 보고하고 있으나 폐결핵에 비해 상대적으로 진단이 쉽지 않아서 보고율이 실제보다 저조할 가능성이 있다[2]. 2012년 질병관리청 자료에서 국내 폐외 결핵의 호발 장기는 흉막, 림프절, 복부, 골관절, 중추신경계, 비뇨생식기, 기도, 심낭 순이었다[3]. 폐외 결핵의 증상은 감염 부위의 통증처럼 국소 증상을 호소하는 경우가 많지만 발열, 전신 무력감, 체중 감소 등 모호한 증상을 호소할 때도 있어서 의심하지 않으면 진단이 지연될 수 있다[4]. 특히 중추신경계 결핵이나 결핵성 심낭염 등 일부 폐외 결핵은 진단과 치료가 지연되면 심각한 후유증이나 사망에 이를 수 있기 때문에 조기에 의심하고(Table 1) 진단을 위한 검사들의 장단점과 민감도, 특이도를 이해하여 적절하게 시행하는 것이 중요하다.
본 론
결핵균 도말 및 배양 검사
결핵의 확진은 검체를 배양해서 결핵균(Mycobacterium tuberculosis)을 확인하는 것이지만, 일부 병소는 검체를 얻기 어렵고 검체를 얻더라도 병변 부위의 결핵균 수가 적어서 폐결핵에 비해 미생물학적 진단이 어렵다[5]. 부위에 따라 다르지만 항산균(acid fast bacilli, AFB) 도말 검사의 민감도는 0-50%로 낮아 음성이라도 결핵을 배제할 수 없고, 배양 검사의 민감도는 20-80% 정도이나 결과를 얻는데 2-8주가 걸리므로 치료가 지연될 수 있다[6]. 소변이나 뇌척수액과 같은 체액을 반복해서 배양 검사를 하면 검사의 민감도를 높일 수 있다[7]. 1회 소변 배양 검사로는 30-40%에서만 양성이지만 3-6회 반복하면 80-90% 정도까지 비뇨생식기 결핵을 확진할 수 있다[8]. 뇌척수액도 4번까지 반복해서 AFB 도말 및 배양 검사를 시행했을 때 80% 정도 결핵을 확진할 수 있다[9]. 폐외 결핵 환자의 약 10-50%가 폐결핵을 동반하고 있으므로 흉부 X선 검사가 정상이더라도 객담 AFB 도말 및 배양 검사를 하는 것도 진단에 도움이 된다[10]. 일반적으로 체액보다 조직 생검 시 결핵균 배양 양성률이 더 높다. 조직 검사 후 검체를 포르말린에 넣으면 결핵균이 죽어 배양 검사를 할 수 없으므로 폐외 결핵이 의심될 때는 검체의 일부를 멸균 식염수에 담아 결핵균 배양 검사를 함께 의뢰해야 한다[11].
배양 검사에서 결핵균이 배양되면 반드시 약제 감수성 검사를 해야 한다. 폐외 결핵 치료 시 약 20-30% 정도에서 역설적 반응(paradoxical response)이 일어날 수 있고, 치료 반응을 평가하기 위해 결핵균 추적 검사를 하기 어렵기 때문에 약제 감수성 검사 결과가 매우 중요하다. 역설적 반응이란 감수성이 있는 항결핵제를 씀에도 불구하고 치료 도중 기존의 결핵 병변이 커지거나 새로운 결핵 반응이 생기는 현상인데, 약제 감수성 검사 결과가 없으면 내성 결핵이나 불규칙한 약물 복용에 의한 치료 실패도 감별해야 하므로 치료 과정에서 더 어려움을 겪게된다[12,13]. 폐외 결핵의 약제 내성률에 대한 연구는 제한적이지만 폐결핵 환자와 비슷하거나 다소 낮은 것으로 알려져 있다. 국내의 한 대학병원에서 시행한 폐외 결핵 환자의 항결핵제 내성률에 관한 연구에서는 한 가지 약제 이상에 내성인 경우가 8.9%이고 다수의 약제에 내성인 경우가 1.8%로 폐결핵보다 다소 낮은 내성률을 보고하였으나[14], 국내 7개 병원이 참여한 다른 연구에서는 폐외 결핵 환자에서 한 가지 이상의 약제에 내성인 경우가 12.4%이고 다수의 약제에 내성인 경우가 3.3%로 폐결핵과 차이가 없음을 보고하였다[15].
조직 검사
폐외 결핵은 폐결핵보다 배양 양성률이 낮고 결과를 얻는데 시간이 걸리기 때문에 병소를 조직 검사하는 것은 폐외결핵을 조기 진단하는 데 매우 효과적인 방법이 된다. 조직 검사에 괴사성 육아종(granuloma)과 같은 결핵의 전형적 병변은 70-80% 정도에서 확인된다[13]. 진단을 위해 어떤 침습적인 방법을 사용할 것인지는 각 부위에 따른 검사의 민감도나 시술의 부작용 등에 따라 결정된다. 림프절 결핵에서는 세침 흡인(fine-needle aspiration, FNA) 검사가 1차적으로 추천되며 척추 결핵에서는 CT 유도하 생검, 결핵성 복막염에서는 복강경을 이용한 조직 검사가 우선적으로 추천된다[7]. 림프절 결핵의 진단에서 절개 생검(excisional biopsy)의 민감도는 약 80%로 FNA 검사보다 높다. 그러나 FNA 검사가 덜 침습적이고, 배양 검사와 함께 세포 검사(cytology)와 핵산 증폭 검사(nucleic acid amplication test, NAAT)를 시행하면 진단율을 상당히 높일 수 있어 림프절 결핵에서는 FNA 검사를 먼저 시행하고 결과가 불분명할 때 절개 생검을 하는 것을 추천한다[16].
결핵은 조직 병리학적으로 건락성 괴사(caseation necrosis)를 동반한 육아종 염증, 거대세포 혹은 상피모양세포, 항산균 등이 관찰된다. 그러나 이러한 조직학적 소견은 결핵뿐만 아니라 다른 질환(비결핵성 항산균 감염, 진균감염, 브루셀라증, 매독 등)에서도 나올 수 있기 때문에 해석에 주의가 필요하다[13].
세포외 체액 검사
조직 검사가 폐외 결핵을 진단하는 데 매우 효과적인 방법이지만 침습적인 검사이다. 따라서 흉수, 복수, 뇌척수액과 같은 세포외 체액(extracellular fluid, ECF)을 얻어서 AFB 도말 및 배양, 분자유전학 검사와 생화학적 검사를 시행하여 폐외 결핵을 진단하는 경우도 많다[7]. 주의할 점은 체액 검사가 전형적인 결핵을 시사하는 소견이 아니더라도 결핵을 배제하면 안 된다는 것이다.
결핵성 수막염의 진단에서 가장 중요한 검사는 뇌척수액 검사로 백혈구가 증가되어 있으며(100-1,000 cells/mL) 림프구 증가를 보이는 경우가 많다. 또한 포도당 감소(40-50 mg/dL 미만 또는 뇌척수액과 혈당의 비가 0.4-0.5 미만)와 단백 증가(150-500 mg/dL)의 소견을 보인다[11]. 결핵성 흉수는 삼출성(exudate) 흉수이고 림프구 증가를 보이는 경우가 많지만 발병 초기 2주까지는 호중구 증가를 보일 수 있다[11].
ECF에서 ADA를 측정하는 것은 폐외 결핵의 진단에서 가장 많이 사용하는 지표 중 하나이다. ADA는 림프구가 분열하고 분화하는 것을 나타내는 지표로서 결핵균에 특이적인 지표가 아니기 때문에 위양성의 가능성을 항상 고려해야 한다[13]. 결핵을 진단하기 위한 ADA의 기준치(cut-off value)는 부위와 기저 질환에 따라 다르다. 결핵성 수막염에서 ADA의 기준치 를 5-15 IU/L로 했을 때 민감도는 86-89%, 특이도는 78-91%로 보고하고 있으며[17,18] 결핵성 흉막염의 경우 ADA 기준치를 40 IU/L로 했을 때 민감도는 92%, 특이도는 89%로 보고하고 있다[19]. 결핵성 심낭염에서는 ADA 기준치를 40 IU/L로 했을 때 민감도는 87-93%, 특이도는 89-97%로 보고하고 있으며[20] 결핵성 복막염에서는 ADA 기준치를 36-40 IU/L로 했을 때 민감도는 100%, 특이도는 97%로 보고하고 있다[21]. 간경화 환자에서는 ADA 기준치를 27%로 낮췄을 때 결핵성 복막염에 대한 민감도와 특이도가 각각 100%와 93.3%로 보고한 바 있다[22]. 간경화 환자나 AIDS 환자에서는 위음성이 많고 류마티스 관절염, 사코이드증, 일부 세균 감염에서도 ADA 수치가 증가할 수 있어서 해석에 주의가 필요하다[7,13].
핵산 증폭 검사(NAAT)
NAAT는 결핵균 특이 유전자를 증폭하여 그 산물을 검출하는 분자진단학적 검사 방법으로 PCR을 흔히 사용하고 있다. 적은 수의 결핵균으로도 검출이 가능하여 AFB 도말 검사보다 민감도가 높지만 여전히 낮은 민감도로 인해 음성이라도 결핵을 배제할 수 없다. 반면에 특이도는 높고 결과를 빨리 얻을 수 있기 때문에 폐외 결핵을 빠른 시간 내 진단하는 데 도움이 될 수 있다[23].
Xpert MTB/RIF 검사는 real-time PCR 검사법을 이용해서 빠른 시간 내에 결핵의 진단과 리팜핀 감수성 검사가 동시에 가능하며 검사 과정이 자동화되어 편리하다는 장점이 있다. 한 메타분석에서 Xpert MTB/RIF 검사를 폐외 결핵에 적용했을 때 전체적으로 민감도 83.1%, 특이도 98.7%로 보고하였다[24]. 검사의 민감도는 폐외 결핵의 부위마다 달라서 림프절 흡인 및 생검 시에 83.1%, 뇌척수액은 80.5%였으나 결핵성 흉수에서는 46.4%로 낮았다[24].
면역학적 검사
투베르쿨린 피부 반응 검사(Tuberculin skin test, TST)와 interferon-gamma releasing assay (IGRA)가 폐외 결핵의 진단에 보조적으로 사용할 수 있으나 진단적 가치는 제한적이다. 특히 TST는 이전에 BCG 백신 접종을 받았거나 잠복 결핵의 유병률이 높은 국가에서는 활동성 결핵 진단의 유용성이 더 떨어진다[7]. TST와 마찬가지로 IGRA 검사도 활동성 결핵과 잠복 결핵을 구분할 수 없고 IGRA 검사가 음성이라도 결핵을 배제할 수 없다[11]. 그럼에도 불구하고 폐외 결핵 진단의 어려움 때문에 혈액 IGRA 검사의 폐외 결핵 진단의 유용성에 대한 많은 연구가 이루어졌다. 최근에 시행한 한 메타분석에 따르면 혈액 QuantiFERON-TB 검사(QIAGEN, Hilden, Germany)와 T-SPOT.TB 검사(Oxford Immunotec, Abingdon, UK)의 민감도는 각각 72%, 90%이고 특이도가 각각 82%, 68%로 보고하였다[25]. 그러나 림프절 결핵이나 골관절 결핵과 같이 만성 경과를 보이는 결핵의 경우는 민감도가 높고 결핵성 수막염이나 결핵성 흉막염에서는 민감도가 더 낮을 수 있다는 보고도 있어서 해석에 주의가 필요하다[13].
최근에는 폐외 결핵에서 병소의 ECF 검체를 이용하여 IGRA 검사를 시행해서 민감도와 특이도를 높이려는 시도가 있다. 결핵성 장막염(serositis) 환자들의 IGRA 검사의 유용성을 조사한 한 연구에서 ECF를 이용한 T-SPOT.TB의 민감도, 특이도는 각각 91.9%, 87.1%로 혈액 검사의 민감도, 특이도(각각 73.0%, 73.1%)보다 높았다[26]. 결핵성 흉막염에서 흉수를 이용한 IGRA 검사의 유용성을 알아본 메타분석에서 IGRA 검사의 민감도와 특이도는 각각 75%, 82%로 낮게 보고하였다[27]. 한편 결핵성 뇌수막염에서 뇌척수액을 이용한 IGRA 검사의 유용성을 조사한 연구에서 IGRA 검사의 민감도와 특이도는 각각 50-70%, 70-90%로 진단을 고려(rule-in)하는 데 도움이 될 수 있는 것으로 보고하였으나 뇌척수액이 적을 경우 미결정 검사가 많다는 문제점을 보고하였다[28]. 현재까지 연구 결과로는 폐외 결핵에서 IGRA 검사의 진단적 유용성은 제한적이라 하겠다.
결 론
국내 결핵 환자 발생률은 꾸준히 감소하고 있지만 폐외 결핵이 차지하는 비율은 20% 내외로 비슷하게 유지되고 있다. 폐외결핵은 폐결핵과 달리 진단이 어렵고 결핵성 뇌수막염과 같이 일부 결핵은 치료가 늦어지면 치명적인 결과가 생길 수 있으므로 조기에 의심하고 적절한 검사를 시행하는 것이 중요하다. 병소의 검체를 얻어서 조직 검사와 함께 반드시 미생물학적 검사(AFB 도말, 배양 검사, NAAT 등)를 시행해야 한다. 검체가 부족할 때는 배양 검사의 진단 양성률이 가장 높고 양성일 때 약제 내성 검사가 가능하므로 결핵 배양 검사를 우선적으로 시행해야 한다. 또한 폐외 결핵이 의심되는 모든 환자는 폐결핵이 동반되지 않았는지 확인하여 진단에 도움을 받는 동시에 전파를 차단하기 위한 노력을 기울여야 한다[6].
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Writing-orignial draft, review & editing: Oh-Hyun Cho.
Acknowledgements
None.