폴립 절제 후 추적 대장내시경 검사 진료 지침 개정안 2022
Korean Guidelines for Postpolypectomy Colonoscopic Surveillance: 2022 Revision
Article information
Trans Abstract
The risk of developing metachronous advanced neoplasia is associated with the presence of polyps in index colonoscopy. Therefore, it is essential to establish the optimal colonoscopy surveillance period following polypectomy. In the 2020s, international guidelines published by the US Multi-Society Task Force, European Society of Gastrointestinal Endoscopy, and British Society of Gastroenterology were revised. In 2022, the Korean postpolypectomy colonoscopic surveillance guidelines were revised to recommend surveillance for adenoma size ≥ 10 mm, ≥ 3 adenomas, tubulovillous or villous adenoma, adenoma with high-grade dysplasia, traditional serrated adenoma, sessile serrated lesion (SSL) with dysplasia, serrated polyp with size ≥ 10 mm, and ≥ 3 SSLs.
서 론
대장내시경을 통한 대장암의 전구 병변인 대장 샘종 또는 톱니 용종을 제거하는 것이 대장암을 예방하는 데 중요한 방법인 것은 이미 잘 알려진 사실이다[1]. 그러나 이러한 폴립들은 대장내시경을 통해 제거한 이후에도 여러 가지 이유로 재발할 수 있으며, 폴립의 양상에 따라 이시성 대장암의 발생 위험도를 증가시킬 수 있기 때문에 적절한 추적 대장내시경 검사들이 요구되고 있다[2,3]. 국내에서는 2012년에 폴립 절제 후 추적 대장내시경 검사 가이드라인을 개발하였고, 이를 일선 의료진에 보급하였다[4]. 최근 2020년을 기점으로 미국(US Multi-Society Task Force, USMSTF), 유럽(European Society of Gastrointestinal Endoscopy, ESGE) 및 영연방(British Society of Gastroenterology, BSG)에서 폴립 절제 후 추적 대장내시경 검사와 관련하여 개정된 진료 지침들이 발표되었다[5-7]. 따라서 국내에서도 위와 관련하여 진료 지침을 개정하였다. 개정된 진료 지침은 최근 새롭게 개정되어 발표된 3개의 외국 지침안을 참고로 하여 수용 개작 방법을 통해 제작되었으며, 대한소화기학회지, Clinical Endoscopy, Intestinal Research를 통해 2022년에 게재가 완료되었다[8-10]. 본 논문에서는 2022년에 개정된 국내의 폴립 절제 후 추적 대장내시경 검사 진료 지침 내용들 중 과거 진료 지침에 비해 변화가 큰 부분을 중심으로 고찰하고자 한다.
본 론
2022년에 개정된 진료 지침은 2012년에 발표된 진료 지침과 비교하여 몇 가지 중요한 차이점들이 존재한다. 첫째, 대장정결 및 대장내시경 검사의 질에 대한 구체적인 언급이다. 양호한 대장정결 및 양질의 대장내시경 검사는 추적 대장내시경 검사 시기를 결정하는 데 중요한 인자로 잘 알려져 있다. 양호하지 못한 대장정결의 경우 기준 대장내시경 검사에서 폴립 간과율을 증가시키며, 부적절한 수준의 대장내시경 검사는 폴립 절제 후 대장암 발생 위험도를 증가시킨다[11,12]. 따라서 2022년에 개정된 진료 지침에서는 양호한 대장정결 및 양질의 대장내시경 검사의 정의에 대해 구체적으로 기재하였다. 둘째, 폴립 절제 후 대장암 관련 고위험 소견이 없는 경우 적절한 추적 대장내시경 검사 시기에 대해서 이전보다 추적 간격을 연장시켰다. 이전 진료 지침에서는 5년의 추적 간격을 권고하였지만, 이번 진료 지침에서는 5-10년의 추적 간격을 권고하였다. 셋째, 샘종 개수에 따른 추적 검사 간격을 이전 진료 지침보다 더 구체적으로 기재하였다. 이전 진료 지침에서는 3개 이상의 샘종이 발생한 경우를 고위험군으로 판단하고 모두 3년 뒤 추적 대장내시경 검사를 시행할 것을 권고하였으나, 개정된 진료 지침에서는 샘종 개수에 따라서 각각 1년, 3년, 3-5년으로 보다 구체화하여 추적 기간을 명시하였다. 넷째, 톱니모양 폴립에 대한 정의를 명시하였고, 이전 진료 지침에는 없었던, 각 톱니모양 폴립의 특성에 맞춘 적절한 추적 검사 간격을 제시하였다.
대장 샘종의 개수는 전통적으로 추적 대장내시경 검사 간격을 결정하는 데 중요한 위험 인자로 잘 알려져 있다. 2012년 국내 진료 지침에서는 3개 이상의 비진행 샘종(non-advanced adenoma)인 경우 3년 뒤 추적 대장내시경을 진행할 것을 권고하였다[4]. 그러나 최근 개정된 국외의 진료 지침들에 따르면 구체적인 추적 간격에 대해 그 내용이 조금씩 다르게 나타난다[5-7]. 비진행 샘종인 경우 BSG 및 ESGE 진료 지침에서는 5개 이상의 샘종을 향후 대장암과 관련된 고위험 요소로 정의하였지만, USMSTF의 경우 3개 이상의 샘종도 고위험 요소로 간주하고 있다. 최근 국내에서 발표된 대규모 메타분석 연구에 따르면, 기준 대장내시경 검사에서 2개 이하의 샘종을 제거한 경우보다 3개 이상 또는 5개 이상의 샘종을 제거한 경우에서 향후 대장암이 발생할 상대 위험도의 통계적인 차이는 없었으나, 진행 신생물이 발생할 상대 위험도는 증가하였다[13]. 추가적으로, 3-4개 샘종 제거군에 비해 5개 이상의 샘종 제거군에서 진행 신생물이 발생할 상대 위험도는 증가하는 경향을 보여주었다. 이번에 개정된 국내 진료 지침에서는 최근 개정된 국외의 진료 지침 및 메타분석 연구를 기반으로 하여 기준 대장내시경 검사에서 샘종의 개수가 3-5개 이상인 경우 추후 진행 신생물 발생 위험이 증가하고, 대장암 발생 위험 증가의 가능성이 있다고 결론을 내렸다. 이러한 결론을 바탕으로 기준 대장내시경 검사에서 3-4개의 샘종이 발견된 경우 3-5년 뒤, 5-10개의 샘종이 발견된 경우 3년 뒤, 그리고 10개를 초과하는 샘종이 발견된 경우 1년 뒤 추적 대장내시경 검사를 할 것을 권고하였다. 이번 진료 지침에서 위와 같은 추적 간격을 권고하였지만, 위 내용은 향후 추가 개정될 가능성이 있는 영역으로 사료된다. 우선 현재까지 근거 자료들에 있어 불일치성이 존재한다. 비교적 최근에 발표된 연구들에서도 연구 대상 및 연구 기간 등에 따라 일부 연구에서는 샘종의 개수가 5개 미만인 경우 향후 진행 신생물 발생 위험도가 크게 증가하지 않는다는 결과를 보고한 반면, 또 다른 연구들에서는 발생 위험도가 증가한다고 보고하고 있다[11,13,14]. 즉 3-4개 샘종 제거군에서 향후 진행 신생물 발생 위험에 대한 연구가 아직까지는 불충분하다. 또한, 내시경 기기의 발전 역시 진료 지침에 영향을 미칠 수 있다. 이전 연구들은 연구 대상에 일반적인 화질의 내시경으로 진행한 대장내시경 검사들을 많이 포함하고 있기 때문에 크기가 작은 비진행 샘종에 대해서는 발견율이 낮았을 가능성이 높다. 그러나 현재는 고화질내시경을 이용하는 의료기관들이 증가하고 있는 추세이다. 이러한 고화질내시경을 이용한 양질의 대장내시경을 통해 크기가 작은 비진행 샘종이 더 많이 발견되고, 이러한 데이터를 바탕으로 구축된 연구들이 발표된다면, 특히 3-4개 샘종 제거군에 대한 향후 진행 신생물 및 대장암 발생 위험에 대한 재평가가 필요할 것으로 여겨진다.
톱니모양 폴립은 과거부터 정의가 여러 차례 변경되었고, 최근 병리학적으로 증식 폴립, 전통 톱니샘종, 목 없는 톱니 병변을 포함하는 포괄적인 개념으로 자리를 잡았다[15]. 톱니모양 폴립은 serrated pathway를 통해 대장암을 일으키는 중요한 전구 병변으로 여겨지고 있으나, 추적 대장내시경 검사 근거로 활용할 만한 톱니모양 폴립 관련 연구는 샘종에 비해서 드물게 보고되고 있다[16-18]. 따라서 2012년의 진료 지침에서는 톱니모양 폴립에 있어 대장암 위험도 증가와 연관된 추적 대장내시경 검사 간격에 대한 권고안은 제한적으로 제시되었으며 오직 크기에 대해서만 언급되었다. 그러나 이번 진료 지침에서는 크기뿐만 아니라 다양한 경우에 맞추어 추적 대장내시경 검사를 할 것을 권고하였다.
톱니모양 폴립의 크기가 10 mm 이상인 경우 이시성 대장암의 발생 위험도가 증가하는 것은 최근 많은 대규모 연구들을 통해 잘 입증되고 있다. 노르웨이에서 10만 명 이상을 대상으로 진행한 인구 기반 연구에 따르면 기준 대장내시경 검사에서 10 mm 이상의 톱니모양 폴립이 발견된 경우 그렇지 않은 경우에 비해 대장암 발생 위험이 증가하는 경향을 보여주었다(hazard ratio [HR], 4.2; 95% confidence interval [CI], 1.3-13.3) [19]. 미국에서 시행된 또 다른 연구에서도 10 mm 이상의 톱니모양 폴립이 발견된 경우 폴립이 없었던 경우에 비해 대장암 발생 위험이 증가하였다(HR, 3.35; 95% CI, 1.37-8.15) [20]. 따라서 이러한 연구들을 근거로 이번 진료 지침에서는 10 mm 이상의 톱니모양 폴립이 발견된 경우 3년 뒤 추적 대장내시경을 할 것을 권고하였으며, 이는 유럽과 영연방 가이드라인과 동일한 내용이다[6,7].
전통 톱니샘종은 국외의 가이드라인에서 3년 후 추적 대장내시경 검사를 할 것을 권고하였으나 권고 등급과 근거는 상대적으로 낮은 수준이다[5-7]. 왜냐하면 전통 톱니샘종은 향후 진행 신생물 또는 대장암 발생 위험이 있다고 평가되고 있으나 관련 연구가 상대적으로 적게 보고되었기 때문이다. 가장 큰 이유로는 전통 톱니샘종의 낮은 발생률과 연관이 있다. 12,955명의 환자를 대상으로 한 대규모 전향적 코호트 연구에서 10 mm 이상의 톱니모양 폴립을 가진 환자는 81명이었고, 이 중 전통 톱니샘종을 가진 환자는 1명만 보고되었다[19]. 또한 현재까지 전통 톱니샘종이 있는 환자만을 대상으로 정상군과 비교한 연구는 없다. 따라서 이번 진료 지침에서도 최근 개정된 국외의 진료 지침을 바탕으로 3년 뒤 추적 대장내시경검사를 할 것을 권고하였으나, 권고 강도는 conditional recommendation이고 level of evidence 역시 low로 설정하였다.
목 없는 톱니 병변 역시 톱니모양 폴립의 한 종류로서 대장암의 전구성 병변으로 여겨지고 있는 폴립 중 하나이다. 따라서 기준 대장내시경 검사에서 목 없는 톱니 병변이 발견된 경우 이시성 대장암의 발생 위험도를 증가시키는 것으로 여겨지고 있으나 아직까지 목 없는 톱니 병변에 대한 연구는 매우 제한적이다. 덴마크에서 진행한 연구에서는 조직학적 이형성을 동반한 목 없는 톱니 병변이 발견된 경우 대장암 10년 예측 위험도는 4.43%로, 폴립이 없는 군의 위험도인 0.93%에 비해 상대적으로 높게 나타났다[21]. 그러나 또 다른 연구에서는 기준 대장내시경에서 조직학적 이형성을 동반한 목 없는 톱니 병변이 있는 경우 이시성 샘종 발생이 정상군에 비해 증가하는 소견을 보였으나, 진행 샘종 발생에 있어서는 유의한 차이를 보여주지 못하였다[22]. 마찬가지로 다른 코호트 연구에서도 조직학적 이형성을 동반한 목 없는 톱니 병변이 이시성 진행 신생물 발생과 연관이 없다는 결과를 보고하였다[23]. 그러나 위와 같은 연구 결과들은 공통적으로 이형성을 동반한 목 없는 톱니 병변의 수가 매우 적어 다각도의 해석이 필요하다. 현재까지 목 없는 톱니 병변의 조직학적 이형성에 대한 연구는 드물기 때문에 추적 대장내시경 검사에서 검사 간격의 단축 여부에 대한 판단 근거는 제한적이다. 하지만 이형성이 동반되는 경우, 보다 악성화에 가까운 조직학적 특성을 가지고 있으며, 이를 바탕으로 국외의 가이드라인에서는 조직학적 이형성을 동반한 목 없는 톱니 병변이 있는 경우 3년 뒤 추적 대장내시경 검사를 시행할 것을 권고하고 있다. 이번 개정된 진료 지침 역시 국외의 진료 지침들 및 현재까지 제한된 근거들을 바탕으로 3년 뒤 추적 대장내시경 검사를 시행할 것을 권고하고 있으나, 향후 이와 관련된 추가적인 연구가 필요한 상황이다.
이번 진료 지침에서는 20 mm 이상 크기의 대장 폴립이 분할 절제된 경우 단축된 추적 대장내시경 검사를 시행할 것을 권고하고 있으며, 이는 이전 진료 지침에서는 없었던 내용이다. 지난 10년간 대장 폴립 분할 절제 시 이시성 대장신생물 발생에 대한 연구 결과들이 축적되었고[24-26], 이를 바탕으로 국외 진료 지침에서는 20 mm 이상의 대장 폴립의 분할 절제 시 3-6개월 뒤 추적 대장내시경 검사를 할 것을 권고하였다[5-7]. 이번에 개정된 국내 진료 지침에서도 위와 같은 경우에는 6개월 후 추적 대장내시경을 시행할 것을 권고하였다. 대장암의 가족력이 대장암의 위험 인자임은 이미 잘 알려진 사실이지만, 대장암 가족력이 추적 대장내시경 검사에서 검사 간격의 단축을 고려해야 할 위험 인자인지에 대해서는 아직 명확히 밝혀진 바가 없다. 2018년에 발표된 연구에서 샘종을 제거한 환자의 추적 대장내시경 검사 결과를 분석하였고, 대장암의 가족력이 있는 환자에서 진행 신생물 발생 위험이 증가하지는 않았다(odds ratios, 1.15; 95% CI, 0.96-1.37) [27].
결 론
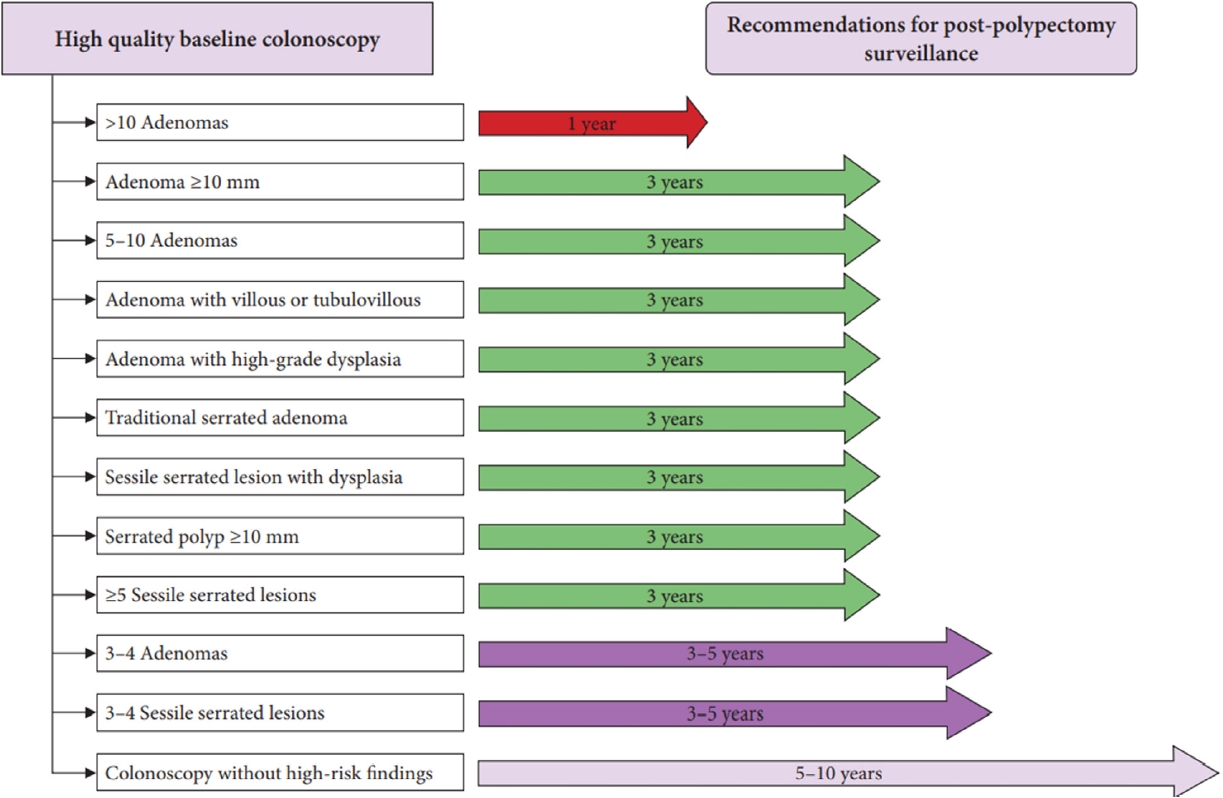
이번에 개정된 진료 지침의 권고안을 요약하면 다음과 같다. 첫째, 기준 대장내시경 검사에서 10개를 초과하는 샘종이 발견된 경우 1년 뒤 추적 대장내시경 검사를 진행한다. 둘째, 10 mm 이상의 샘종, 5-10개의 샘종, 대롱융모 또는 융모샘종, 고도 이형성증을 동반한 샘종, 전통 톱니샘종, 이형성을 동반한 목 없는 톱니 병변, 10 mm 이상의 톱니모양 폴립, 5개 이상의 목 없는 톱니 병변이 발견된 경우에는 3년 뒤 추적 대장내시경 검사를 진행한다. 셋째, 3-4개의 샘종 또는 3-4개의 목 없는 톱니 병변이 발견된 경우에는 3-5년 뒤 추적 대장내시경 검사를 진행한다. 넷째, 기준 대장내시경 검사에서 위와 같은 위험 인자가 발견되지 않은 경우에는 5-10년 뒤 추적 대장내시경 검사를 진행한다(Fig. 1) [8]. 이번 진료 지침에서는 그동안 축적된 연구 및 국외의 진료 지침들을 토대로 폴립 절제 후 추적 대장내시경 검사 간격의 단축이 필요한 고위험군을 세분화해서 정리하였고, 추적 간격에 대해서도 비교적 명료하게 제시하였다. 그럼에도 불구하고 몇몇 주제에 있어서는 연구 결과마다 상충되는 내용이 존재하며 근거 수준이 낮기 때문에, 이와 관련하여 추가적인 연구 및 개선이 필요할 것으로 여겨진다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Su Young Kim wrote the manuscript.
Acknowledgements
None.