이차고혈압의 진단과 치료
Diagnosis and Treatment of Secondary Hypertension
Article information
Trans Abstract
Secondary hypertension, which refers to arterial hypertension caused by an identifiable medical condition, accounts for 5-10% of all hypertensive diagnoses; however, this is thought to be an underestimate. If diagnosed promptly, secondary hypertension can be treated, and proper blood pressure restored. This review focuses on the screening, diagnosis, and management of the most common forms of secondary hypertension, including primary aldosteronism, renovascular hypertension, pheochromocytoma, Cushing’s syndrome, and renal parenchymal disease.
서 론
이차고혈압이란 특정한 원인으로 인하여 고혈압이 발생하는 것을 일컬으며 이러한 원인이 해결되면 고혈압 또한 해결되는 것으로 정의한다. 고혈압 환자의 5-10%가 이러한 이차고혈압 환자로 추정되며, 나머지 90%는 원인이 분명하지 않은 본태성 또는 일차고혈압이라고 부른다[1]. 이차고혈압은 드문 질환이고 원인 감별을 위한 검사들이 복잡하고 비용이 비싸므로 모든 고혈압 환자에서 이차고혈압을 감별하는 것은 효율적이지 않다.
2018년 유럽심장학회 및 유럽고혈압학회(European Societies of Cardiology and Hypertension)에서는 이차고혈압의 감별 대상으로 40세 미만의 젊은 환자, 최근 급격히 조절되지 않는 혈압, 저항성 고혈압, 광범위한 고혈압으로 인한 장기의 손상 등이 있을 때로 권고하고 있다[2]. 이차고혈압의 흔한 원인으로는 일차알도스테론증, 신혈관 질환, 폐쇄성 수면 무호흡증, 갈색세포종, 갑상선 질환 등이 있다(Table 1) [2,3]. 앞서 언급했듯이 이차고혈압은 원인이 해결되면 고혈압 또한 호전되므로 전신의 혈관과 장기에 비가역적인 손상이 발생하기 전에 이차고혈압의 조기 발견 및 치료가 중요하다[4]. 이에 저자들은 이차고혈압이 의심되는 환자의 진단적 접근 및 감별 진단에 대하여 논하고자 한다.
본 론
증례
50세 남자가 내원 하루 전부터 두통이 지속되어 타 병원에 내원하였고 혈압이 매우 높고 혈액 검사 상 저칼륨혈증이 발견되어 전남대학교병원 응급센터로 전원되었다. 기저 질환으로 9년 전에 그레이브스병으로 진단되었고 8년 전에 고혈압으로 진단되어 약물 치료 유지 중이었다. 고혈압에 대해서는 losartan 100 mg, amlodipine 5 mg, chlorthalidone 12.5 mg, bisoprolol 5 mg 복용 중이었다. 전남대학교병원 응급센터 내원 시 혈압은 160/90 mmHg, 심박수는 60 bpm이었으며 그 외 활력징후는 이상 소견이 없었다. 혈액 검사 상 혈청 칼륨 2.0 mEq/L (3.5-5.0 mEq/L)로 중증 저칼륨혈증 소견을 보였으며 혈액요소질소(blood urea nitrogen) 15.3 mg/dL (8-23 mg/dL), 혈청 크레아티닌 0.9 mg/dL (0.5-1.3 mg/dL)로 신장기능수치는 정상 소견이었다. 갑상선자극호르몬(thyroid stimulating hormone) 0.23 uIU/mL, 유리 T4 (free T4) 1.46 ng/dL (0.89-1.76 ng/dL), T3 1.38 ng/mL (0.6-1.81 ng/mL)로 갑상선 기능 또한 정상 소견이었다.
조절되지 않는 고혈압 및 중증 저칼륨혈증에 대한 평가를 위하여 입원하였고 혈청 레닌 0.23 ng/mL/hour, 알도스테론 73.9 ng/dL로 측정되었다. 알도스테론-레닌 비 321.43 ng/dL per ng/mL/hour (정상값: 20 미만)로 고알도스테론증이 강하게 의심되었다. 일차알도스테론증에 대한 확진을 위하여 생리식염수 부하 검사를 시행하였고 생리식염수 부하 후 측정한 혈장 알도스테론 농도 24.8 ng/dL로, 10 ng/dL 미만으로 억제되지 않아 일차알도스테론증으로 확진하였다. 이에 부신종양 또는 부신 비대에 의한 일차알도스테론증의 원인 감별을 위해 복부 컴퓨터단층촬영을 시행하였고 좌측 부신에 1.8 cm 크기의 결절이 발견되었다(Fig. 1). 부신 결절로 나타날 수 있는 다른 질환을 배제하고자 혈청 코티졸, 24시간 소변을 통한 17-ketosteroid, 17-hydroxycorticosteroids, 메타네프린, 바닐릴만델산(vanillylmandelic acid) 검사 등을 시행하였고 정상 소견으로 확인되었다. 일차알도스테론증에 대해 수술적 치료를 하기로 결정하였고 편측성인지 확인하기 위하여 부신 정맥 채혈(adrenal vein sampling, AVS)을 시행하였다. 좌측 부신정맥에서 채취한 알도스테론 42,830 ng/dL, 코티졸 670 μg/dL, 우측 부신정맥에서 채취한 알도스테론 68.2 ng/dL, 코티졸 640 μg/dL, 하대정맥에서 채취한 알도스테론 75.0 ng/dL, 코티졸 16.7 μg/dL로 측정되었다. 우측에 비해 좌측 알도스테론 농도가 10배 이상 높았고 코티졸로 보정한 알도스테론 농도 또한 4 이상 높아 좌측에 편측된 일차알도스테론증으로 최종 진단하였다.
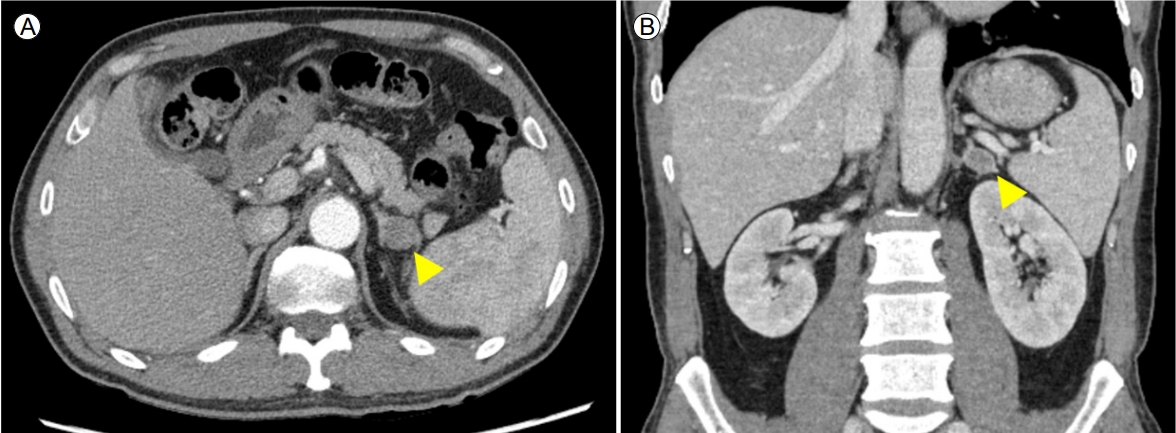
(A, B) An abdominal computed tomography scan showed a 1.8 cm nodule in the left adrenal gland (arrowhead). (A) Axial view. (B) Coronal view.
충분한 혈압조절과 저칼륨혈증 교정 후 복강경하 좌측 부신절제술 시행하였고 조직병리검사 상 부신피질선종으로 확인되었다. 수술 후에는 저칼륨혈증은 재발하지 않았으며 혈압 또한 호전되어 현재는 fimasartan 30 mg만 유지중이다.
일차알도스테론증
일차알도스테론증(primary hyperaldosteronism)이란 알도스테론의 분비가 레닌-안지오텐신 축에 상관없이 부적절하게 증가되어 있으며 소듐 부하에도 억제되지 않는 상태를 말한다. 최근 연구 결과들에 따르면 일차알도스테론증은 고혈압 원인의 5% 이상을 차지하는 것으로 보이며, 연구자에 따라서는 10% 이상의 유병률을 보고하는 경우도 있다[5]. 일차알도스테론증이 발생하는 원인으로는 aldosterone-producing adenoma, idiopathic hyperaldosteronism, idiopathic adrenal hyperplasia 등이 있다[6].
약 40%의 환자에서 저칼륨혈증이 동반된다고 알려져 있으며, 저칼륨혈증으로 인하여 근육의 쇠약, 경련, 피로 등이 나타날 수 있다[7]. 또한 소듐의 저류로 인하여 저항성 고혈압, 두통 등이 동반될 수 있다[8]. 일차알도스테론증이 의심되는 경우 선별 검사를 시행해야 하는데 선별 검사에 대한 적응증은 표 2에 명시하였다[5]. 선별 검사로는 혈장 알도스테론-레닌비(plasma aldosterone-renin ratio, ARR)를 측정한다. 아침 기립 시의 혈장 알도스테론(plasma aldosterone concentration, PAC)과 혈장 레닌 활성도(plasma renin acticity, PRA)를 동시에 측정하여 ARR을 계산한다. 보통 ARR이 20-40 (PAC: ng/dL, PRA: ng/mL/hour) 이상이면서 PAC > 15 ng/dL인 경우에 일차알도스테론증을 의심한다[9-11]. ARR은 여러 인자의 영향을 많이 받으므로 ARR 측정 시에는 저칼륨혈증이 교정되어 있어야 하며, 가능하다면 고혈압약제는 ARR에 영향을 거의 주지 않는 verapamil, hydralazine, doxazosin 등으로 교체하고 ARR에 영향을 미치는 mineralocorticoid receptor (MR) antagonist, 안제오텐신 전환효소(angiotensin converting enzyme, ACE) 억제제, 안지오텐신 수용체 차단제(angiotensin receptor blocker, ARB), dihydropyridine calcium channel blocker (DHP-CCB), 베타 차단제 등은 2-4주 전부터 중단한다[8,10].
확진 검사로는 주로 생리식염수 부하 검사(saline infusion test)를 시행한다. 생리식염수 부하 검사는 환자가 누워있는 상태에서 4시간 동안 생리식염수 2 L를 정맥주입한 후 혈장 알도스테론 농도를 측정한다. 생리식염수 부하검사 후 혈장 알도스테론 농도가 < 5 ng/dL로 감소하는 것이 정상이나 만약 > 10 ng/dL로 여전히 억제되지 않는다면 일차알도스테론증으로 확진할 수 있다[12]. 그 외의 확진 검사로는 캡토프릴 부하 검사(captopril challenge test), 경구 소듐 부하 검사(oral sodium loading test), 플루드로코티손 억제 검사(fludrocortisone suppression test) 등이 있다[8,13].
일차알도스테론증으로 확진된 환자는 아형 검사를 위해 부신 컴퓨터단층촬영(computed tomography, CT)을 시행해야 하며, CT 상에서 부신의 경미한 일측 증식, 1 cm 이하의 미세선종, 양측 선종을 보이는 경우에는 AVS가 필요하다[14]. AVS는 저칼륨혈증과 혈압이 교정된 상태에서 adrenocorticotropic hormone (ACTH) 50 mg/hour를 정주하여 코티솔의 분비를 자극한 후 양측 부신 정맥과 하대 정맥에서 알도스테론, 코티솔 값을 측정한다. 검체 채취가 적절하게 이루어졌는지 평가하기 위해서는 부신 정맥의 코티솔 농도와 하대 정맥의 코티솔 농도의 비를 계산하며 2-5배 이상 높다면 적절한 검체 채취가 이루어진 것으로 판단한다[15]. 알도스테론을 코티솔로 나누어 보정한 알도스테론값이 양측 부신 정맥의 차이가 4 이상이면 편측화 되었다고 확인할 수 있다[6].
편측성 일차알도스테론증으로 진단된 환자는 수술이 가장 우수한 치료법이다[13]. 최근에는 대부분 복강경적 부신절제술을 시행하며 수술 후 대부분의 환자에서 저칼륨혈증이 개선되며 약 절반의 환자에서 고혈압 또한 개선된다[16,17]. 양측 일차알도스테론증이거나 편측성이어도 수술을 받기 어려운 환자의 경우에는 평생동안 spironolactone, eplerenone 등의 MR antagonist를 복용 유지하는 것이 치료법이다[10]. 여러 후향적 연구에서 수술적 치료와 약물적 치료의 장기적 예후를 비교해 보았을 때 수술적 치료가 생존율의 개선, 고혈압의 개선, 만성 신부전의 위험 감소, 좌심실 비대 호전 등 예후가 더 좋았으므로 환자에게 알맞은 치료 방법을 선택하는 것이 중요하겠다[18].
신혈관고혈압
신혈관고혈압(renovascular hypertension)은 신동맥의 협착이나 폐쇄로 인하여 신장으로 가는 혈류가 감소하고 레닌-안지오텐신-알도스테론 축을 자극하여 고혈압이 발생하게 되는 상황을 일컫는다[19]. 유병률은 전체 고혈압 환자의 1-2% 에서 발생하며 젊은 이차고혈압 환자에서는 약 6% 정도 발생한다[20]. 신혈관고혈압을 유발하는 주된 원인은 섬유근육 형성이상(fibromuscular dysplasia, FMD)과 신장동맥의 죽상동맥경화증(atherosclerosis)이며 FMD는 젊은 여성에게 호발 하고 죽상동맥경화증은 고령에서 호발한다[21].
신혈관고혈압을 유추할 수 있는 특징으로는 복부 청진 상복부 잡음(abdominal bruit)이 들릴 수 있으며 ACE 억제제 혹은 ARB 사용 후에 신장기능이 저하될 수 있다. 또한 소듐의 저류로 인하여 폐부종이 발생할 수도 있다. 신혈관고혈압의 진단을 위해서는 도플러 초음파 혹은 CT, 자기공명영상(magnetic resonance imaging, MRI) 등을 통해 신장 혈관을 확인할 수 있으며 카테타를 통한 신장혈관 조영술을 통해서도 진단이 가능하다[22]. 혈관 병변을 가장 정확히 확인할 수 있는 검사는 신장혈관 조영술이나 침습적이고 비용이 다른 검사에 비해 비싸므로 보통 혈관 시술을 계획할 때 조영술을 같이 시행한다.
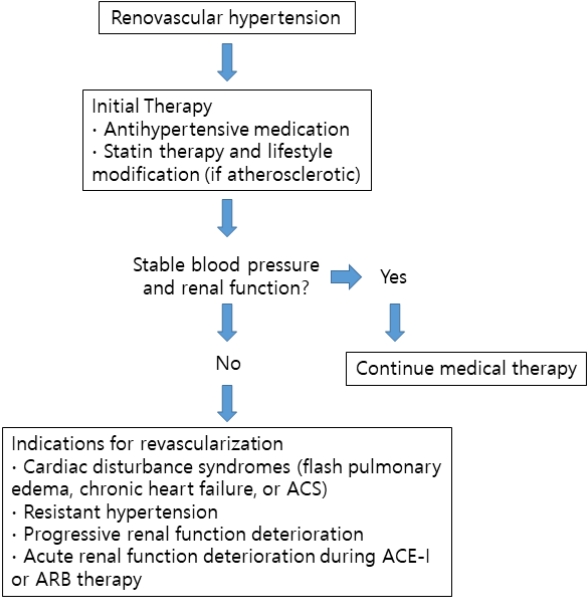
신혈관고혈압의 치료는 고혈압을 조절함과 동시에 신장 기능을 보호하는 데에도 목적이 있다. 신혈관고혈압 환자에서 ACE 억제제 혹은 ARB 치료는 혈압을 낮추는 효과뿐만 아니라 장기적으로는 환자의 심혈관계 합병증, 뇌혈관계 합병증, 말기 신부전 진행 등에 대한 예후 및 사망률을 개선시킬 수 있다[23,24]. 일부 환자에서는 ACE 억제제 혹은 ARB 사용 후에 수출 사구체 세동맥(efferent arteriole)이 확장되면서 사구체여과율이 감소할 수 있다. 이러한 경우에는 일시적으로 ACE 억제제 혹은 ARB를 중단하고 사구체여과율이 회복되는지 관찰할 필요가 있다. 또한 신장동맥에 죽상동맥경 화증이 있는 환자들은 대부분 전신의 혈관이 죽상동맥경화증이 있으므로 스타틴 치료, 생활습관 교정 등 죽상동맥경화증에 대한 치료가 병행되어야 한다. 미국심장학회 및 미국심장협회(American College of Cardiology and Amerian Heart Association) 지침에 따르면 죽상동맥경화증으로 인한 신혈관고혈압 환자 중 중재적 요법을 통한 혈관 재개통 시술이 필요한 적응증으로 1) 심부전, 폐부종 등 심장 장애 증후군이 동반된 경우, 2) 충분한 약물 치료에도 불구하고 고혈압이 조절되지 않는 경우(저항성 고혈압), 3) 양측 신혈관 질환으로 인하여 신장기능손상이 진행하는 경우 등이 있다[25]. 이외에도 ACE 억제제 혹은 ARB 치료로 인한 신장기능 악화가 반복되거나 호전되지 않는 경우에도 시술을 고려해 볼 수 있다[3]. 신혈관고혈압에 대한 치료 알고리즘에 대해서는 그림 2에 정리하였다.
갈색세포종
갈색세포종(pheochromocytoma)이란 카테콜라민을 과다분비하는 종양의 일종으로 부신종양은 갈색세포종으로, 부신외종양은 부신 외 부신경절종(paraganglioma)로 정의한다[26]. 둘다 교감 및 부교감 신경절의 크롬친화세포(chromaffin cell)에서 기원하며 유병률은 고혈압 환자의 0.2-0.6% 정도로 드물게 발생한다[19]. 혈청 카테콜라민(catecholamines)의 발작적인 증가로 인하여 발작적인 고혈압, 두근거림, 두통, 발한 등의 특징적인 증상들이 나타난다[27].
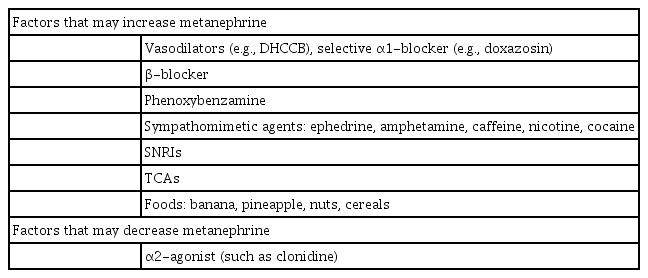
갈색세포종에 대한 진단은 위의 특징적인 증상들뿐만 아니라 갈색세포종 가족력혹은 갈색세포종과 관련된 유전적인 증후군들(1형 신경섬유종증(neurofibromatosis type 1), 2형 다발성 내분비종양(multiple endocrine neoplasia type 2), 폰 히펠-린다우 증후군(von Hippel-Lindau syndrome), SDHB 돌연변이가 있는 신세포암종 등)이 의심되는 경우에 고려해 볼 수 있다. 선별 검사로는 24시간 소변 혹은 혈청 메타네프린을 검사하여 정상보다 높은 경우 갈색세포종을 의심해 볼 수 있다[28]. 24시간 소변 검사를 시행할 때에는 소변 크레아티닌을 같이 검사해야 소변 검체가 알맞게 얻어졌는지 감별할 수 있다. 일부 고혈압 약제 및 음식, 카페인 등은 메타네프린 수치에 영향을 미칠 수 있으므로 주의가 필요하다(Table 3) [29,30]. 선별 검사 상 갈색세포종이 의심될 경우 복부 CT 혹은 부신 MRI 촬영을 하여 부신종양 여부를 확인한다. 만약 부신종양이 저명하지 않거나 전이성 병변이 의심되는 경우에는 123I-metaiodobenzylguanidine (MIBG) 신티그라피 검사 혹은 전신 MRI 촬영, 양전자방출단층촬영(positron emission tomography) 등을 시행한다. 갈색세포종과 관련된 유전적인 증후군들이 의심되는 경우에는 유전자 검사 또한 시행한다[31].
영상 검사 상 단일 병변 혹은 한곳에 밀집된 다발성 병변으로 진단된 경우에는 수술적 절제를 통해 치료할 수 있다. 수술에 대한 전처치 없이 수술을 진행하게 될 경우 수술 시 다량의 카테콜라민이 분비되면서 고혈압성 위기(hypertensive crisis), 부정맥, 심근경색, 폐부종 등 심각한 심혈관계 합병증이 발생 할 수 있으므로 수술 전에는 반드시 전처치가 필요하다[32]. 수술 전 카테콜라민의 과분비에 대한 대비 및 혈압 조절을 위해서는 α-blocker 복용을 전처치로 하며 주로 phenoxybenzamine 혹은 doxazosin을 처방한다. 이러한 약제들은 수술 7-14일 전부터 복용을 시작하여 점차 용량을 증량하며 적정 혈압에 도달하여 수술을 준비한다. 그 외 칼슘 채널 길항제, 베타 차단제 등도 고려해 볼 수 있다. 전이성 병변이고 MIBG 신티그라피상 양성 소견이 관찰되는 환자에서는 131I-MIBG 방사선 치료 혹은 항암 치료를 시행한다[31].
쿠싱증후군
쿠싱증후군(Cushing’s syndrome)은 내인성 코티솔의 분비 혹은 외부적으로 코티솔 성분 복용 등으로 인하여 만성적으로 코티솔이 과다한 상태를 정의한다[33]. 이차고혈압 환자 중에는 유병률이 1% 미만으로 드문 병이나, 성인 쿠싱증후군 환자의 80% 이상에서 고혈압이 관찰된다[34]. 내인성 쿠싱증후군은 ACTH 의존성(약 80%)과 ACTH 비의존성(약 20%)으로 나뉜다. ACTH 의존성 쿠싱증후군 중에는 뇌하수체 피질영양선종(pituitary corticotroph adenoma)인 쿠싱병(Cushing’s disease)이 가장 흔하다. ACTH 비의존성 쿠싱증후군 중에서는 부신 선종에서 코티솔이 과다분비되어 발생하는 쿠싱증후군이 가장 흔하다.
쿠싱증후군의 특징적인 증상으로는 비만, 달덩이 같은 얼굴, 목 뒤와 어깨의 피하지방 축적, 다모증, 자색 선조 등이 발생한다[35]. 쿠싱증후군이 의심되는 환자에 대해 선별 검사를 시행하기 전 병력 청취를 통해 외인성 글루코코르티코이드의 과도한 사용력이 있는지 감별이 필요하다. 선별 검사로는 24시간 소변 코티솔 농도를 측정하여 55 μg/24 hour 이상인지 확인하거나 취침 전 1 mg 덱사메타손을 복용한 후 다음날 아침에 혈청 코티솔 농도를 측정하여 5 μg/dL 이상인지 확인하는 1 mg 야간 덱사메타손 억제 검사가 있다[36]. 검사 결과 상 확실한 검사가 추가적으로 필요한 경우에는 48시간 동안 2 mg 덱사메타손 억제 검사를 시행해 볼 수 있다. 이는 덱사메타손 0.5 mg을 6시간마다 복용하여 마지막 복용 후 2-6시간 후에 혈청 코티솔 농도를 측정하는 검사이며 코티솔 농도가 5 μg/dL 이상이면 쿠싱증후군으로 진단할 수 있다. 이후에는 ACTH 의존성인지 비의존성인지 감별하기 위 하여 혈청 ACTH 농도를 최소 두 번 이상 측정한다. ACTH 농도가 10 pg/mL 미만으로 감소되어 있는 경우에는 ACTH 비의존성 쿠싱증후군을 의심해볼 수 있으며 그렇지 않은 경우에는 corticotropin-releasing hormone 검사 혹은 데스모프레신 검사에서도 ACTH가 억제되지 않는지를 확인하여 ACTH 의존성 쿠싱증후군을 진단할 수 있다[37]. ACTH 의존성 쿠싱증후군으로 진단되면 뇌하수체 병변 감별이 필요하므로 뇌하수체 MRI를 촬영한다. MRI 상 뇌하수체 선종이 6 mm 미만이거나 불분명한 경우에는 양측 하방 부비동 샘플링(bilateral inferior petrosal sinus sampling)을 시행하여 ACTH의 분비가 뇌하수체 문제인지 이소성 근원인지 감별할 수 있다. ACTH 비의존성 쿠싱증후군으로 진단되면 부신 병변 감별이 필요하므로 복부 CT 혹은 부신 MRI 촬영을 시행한다. 쿠싱증후군에 대한 진단 알고리즘에 대해서는 그림 3에 정리하였다.
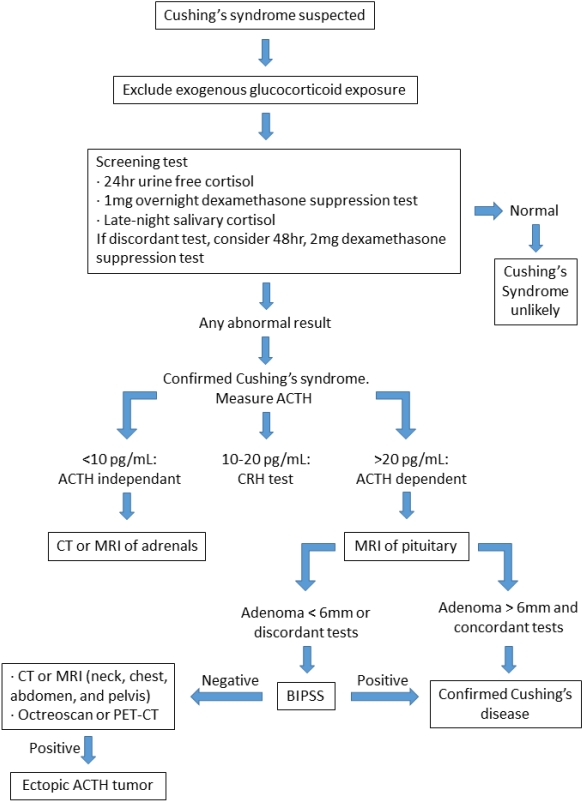
Flow chart for diagnosing Cushing’s syndrome. ACTH, adrenocorticotropic hormone; CRH, corticotropin-releasing hormone; CT, computed tomography; MRI, magnetic resonance imaging; BIPSS, bilateral inferior petrosal sinus sampling; PET, positron emission tomography.
뇌하수체 종양으로 인한 쿠싱병의 치료는 접형동을 통한 종양 제거 수술(transsphenoidal selective tumor resection)이 우선적인 치료이다[38]. 수술적 제거 후에는 코티솔과 ACTH 농도가 떨어지게 되며 글루코코르티코이드 보충이 필요하다. 고코티솔증으로 인한 급성 합병증이 있거나 수술이 연기되거나 불충분한 수술로 인하여 여전히 고코티솔증이 남아있는 경우에는 약물 치료를 도입한다. 약물치료로는 스테로이드 생성 억제제, 글루코코르티코이드 수용체 길항제 등이 있다[39]. 뇌하수체 방사선 치료 또한 수술이 어려운 환자들에게 치료 효과가 좋다. 부신 종양으로 인한 쿠싱증후군의 치료는 병변이 있는 부신에 대해 일측 부신 절제술을 시행하는 것이 우선적인 치료이다[40]. 역시나 수술적 제거 후에는 시상하부-뇌하수체-부신 축이 회복될 때까지 글루코코르티코이드 보충이 필요하다.
신장실질질환
신장실질질환(renal parenchymal disease)은 소아에서 이차고혈압의 가장 흔한 원인이며 성인에서도 폐쇄성 수면 무호흡에 이어 두 번째로 흔한 원인이다[3]. 따라서 이차고혈압이 의심되는 경우 먼저 요분석 검사와 혈청 크레아티닌 농도를 측정하는 것이 중요하다. 검사 상 이상 소견이 있을 경우 사구체신염, 선천적 기형, 역류성 신병증 등 신장실질질환의 원인에 대한 감별이 필요하다.
폐쇄성 수면 무호흡증
폐쇄성 수면 무호흡증(obstructive sleep apnea)은 원발고혈압의 5-15%, 이차 고혈압의 30% 이상을 차지한다고 알려진 흔한 원인 질환 중 하나이며 고혈압과 심혈관질환의 독립적인 위험인자이다[41]. 대부분의 폐쇄성 수면 무호흡증 환자들은 주간시간의 졸림, 코골이, 기상 시 두통, 집중력 저하 등을 호소한다. 외형적으로 비만, 넓은 목, 큰 혀 등이 특정이다. 반복적인 야간 저산소증으로 인하여 교감신경이 항진되고 레닌-안지오텐신-알도스테론 축의 변화가 생기면서 고혈압이 발생한다. 중증의 폐쇄성 수면 무호흡증 환자는 기도양압요법 등의 치료가 필요하다.
결 론
이차고혈압의 유병률은 고혈압 환자의 5-10%이지만 진단되지 못한 이차고혈압 환자 또한 많을 것으로 추정된다. 이차고혈압은 원인을 치료하면 고혈압이 호전되는 병이며, 기저 원인으로 인한 심혈관계 합병증, 대사증후군, 신장 기능 손상 등 다양한 합병증이 발생할 수 있으므로 적극적인 원인 평가 및 치료가 중요하다. 이차고혈압의 원인을 감별하기 위해서는 환자의 자세한 병력 청취가 중요하고 적절한 혈액 검사, 소변 검사, 영상 검사 등을 시행하여 감별 진단에 도움을 줄 수 있다. 이차고혈압으로 진단된 경우에는 기저 원인에 따라 적절한 치료가 이루어져야 하겠으며 치료 후에도 고혈압이 호전되는지 추적 관찰이 필요하겠다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
This research was supported by a grant (BCRI22040) of Chonnam National University Hospital Biomedical Research Institute.
AUTHOR CONTRIBUTIONS
Conception and design: Song SH, Bae EH
Acquisition of data: Song SH
Analysis and interpretation of data: Song SH, Choi HS
Drafting of the manuscript: Song SH
Critical revision for intellectual contents: Song SH, Choi HS, Bae EH
Final approval of the manuscript: Song SH, Choi HS, Bae EH