진행성 악성 간문부 담관 폐쇄의 고식적 치료를 위한 담관내 고주파 소작술
Intraductal Radiofrequency Ablation as a Palliative Treatment for Advanced Malignant Hilar Biliary Obstruction
Article information
Trans Abstract
Malignant hilar biliary obstruction (MHBO) frequently accompanies cholestasis and cholangitis, and requires biliary stent placement. To prevent stent occlusion and prolong survival, local ablation therapy can be considered adjunctive to stent placement. Intraductal radiofrequency ablation (ID-RFA) is a recently developed local therapy for malignant biliary obstruction that can be easily performed employing endoscopic retrograde cholangiography. The use of ID-RFA to treat MHBO (as distinct from distal biliary obstruction) was suggested to be associated with severe adverse events. However, recent comparative studies have shown that ID-RFA is feasible and safe, and acceptably efficacious, in patients with advanced MHBO; newer temperature-controlled ID-RFA devices may enhance safety further. Regularly repeated ID-RFA with stent exchange affords better survival than stenting alone. However, the optimal ID-RFA strategy for MHBO remains inconclusive given the lack of data. Further large-scale clinical trials are needed.
서 론
악성 간문부 담관 폐쇄는 악성 종양으로 인해 간문부 담관의 비정상적 협착이 유발되어 담즙 배출에 장애가 발생한 경우로, 담즙 정체와 담관염을 유발한다. 원인 원발 암은 대부분 담관암이지만, 담낭암의 국소침범이나 타 장기 암의 간문부 림프절 전이가 원인이 되기도 한다[1]. 악성 간문부 담관 폐쇄를 유발하는 원발 암의 약 70% 이상은 근치적 절제가 불가능한 진행성 병기를 보이며, 5년 생존율이 10% 미만으로 예후가 매우 불량한 것으로 알려져 있다[2,3]. 이러한 환자에서 적절한 담즙 배액은 후속 치료 진행과 환자의 예후 및 삶의 질 향상을 위해 필수적으로, 이를 위해 내시경적 담관 배액술(endoscopic biliary drainage)을 통한 담관 스텐트 삽입이 주로 시행되고 있다[3]. 하지만 스텐트를 삽입한 환자의 절반 이상에서 6개월 이내에 스텐트 폐쇄로 담즙 정체가 재발할 수 있으며[4], 이에 스텐트 개통 기간과 예후를 향상시키기 위한 다양한 시도들이 있었다. 그중 최근 각광받는 치료로 담관내 고주파 소작술(intraductal radiofrequency ablation, ID-RFA)이 있으며, 간외 담관 폐쇄에서는 전향적 무작위 대조 연구 수준에서 스텐트 삽입과 병행 시 스텐트 단독 치료에 비해 우수한 스텐트 개통 기간과 생존 기간이 나타난 바 있다[5,6]. 반면 간문부 담관은 중증 합병증 발생에 취약하다는 우려가 있으며[7,8], 임상적 근거도 부족하여 원위부담관 폐쇄에 비해 실제 임상에서 ID-RFA의 활용도는 낮은 실정이다. 그러나 최근 간문부 폐쇄를 대상으로도 긍정적인 연구 결과들이 발표되고 있어, 이에 본고에서는 최근 연구를 바탕으로 진행성 악성 간문부 담관 폐쇄에서 ID-RFA의 임상적 유용성과 적절한 치료 전략에 대해 기술하고자 한다.
본 론
담관내 고주파 소작술(ID-RFA)
RFA는 표적 병변에 전극을 삽입하여 고주파 전류를 전달하면, 전달된 교류전류가 조직 내 이온 동요(ionic agitation)를 유발하여 마찰열이 발생, 열 소작을 통한 전극 주변 조직의 응고 괴사와 단백질 변성을 유도하는 국소 치료법이다[9]. 이미 신세포암이나 간세포암 등 고형암에서 근치적 치료법으로 널리 사용되고 있으며 담관이라는 한정된 관강(lumen) 내에서 주로 분절형 국소 협착이 발생한다는 점에서 악성 담관 폐쇄의 국소 치료에도 적합하다. ID-RFA를 위한 장비는 양극형 (bipolar) 전극이 부착되어 에너지를 병변에 전달하는 RFA 카테터와 에너지를 발생, 조절하는 RFA 제너레이터로 구성된다. 담관 내부에 삽입된 유도선을 따라 카테터를 삽입하는 방식이므로 내시경적 역행성 담췌관 조영술(endoscopic retrograde cholangiopancreatography, ERCP)에 익숙한 시술자라면 쉽게 시행할 수 있으며, 경피 경간 담관 조영술(percutaneous transhepatic cholangiography)로도 시행할 수 있다. 유도선을 따라 소작하고자 하는 협착부에 전극을 위치시킨 후 미리 설정한 출력과 시간 값에 따라 RFA를 시행한다. 소작이 끝나면 풍선 카테터로 괴사된 조직을 제거하고, 담관 조영술을 시행하여 담관 천공 등 즉각적 합병증 여부를 확인하는데 이때 소작이 잘 되었다면 호전된 담관 폐쇄를 조영술로 확인할 수 있다(Fig. 1). 단, in vivo 동물 연구에서 ID-RFA 4주 후 담관 협착과 담관염이 발생하는 것이 확인되었고[10], 근치적 치료가 아니기 때문에 일반적으로 잔여 종양 증식으로 인한 재폐쇄가 발생할 것이 예상된다. 따라서 ID-RFA 시행 직후 담관 폐쇄 위치에 따라 단일 또는 양측 담관 스텐트 삽입이 필요하다. ID-RFA를 위해서는 카테터 선단에 짝수로 위치한 양극성 전극들이 담관의 협착부와 적절히 접촉해야 하므로, 카테터가 지나갈 수 없는 완전 담관 폐쇄가 있거나 반대로 카테터에 충분히 닿지 않는 경미한 협착의 경우 시술이 불가능하다는 제한점이 있다.

A fluoroscopic view of intraductal radiofrequency ablation (ID-RFA). (A) Initial cholangiography reveals a hilar biliary stricture with bilateral intrahepatic duct (IHD) dilatation. (B) ID-RFA of the right main IHD. (C) ID-RFA of the left main IHD. (D) After ID-RFA of both IHDs, cholangiography reveals a significant increase in bile duct diameter.
간문부 담관 폐쇄에서도 ID-RFA가 적용 가능한가?
ID-RFA는 비교적 안전한 시술로 심박동기 삽입 상태, 응고 이상 및 임신 등을 몇몇 금기증을 제외하고는 큰 제약 없이 시행이 가능하다. 주로 발생하는 합병증은 담관염, 담낭염, 췌장염으로 발생률은 약 4.2-35% 정도로 알려져 있고 대부분 경증이지만 일부에서 중증 합병증이 보고된 바 있어 주의가 필요하다[11]. 특히 과거 간문부 담관 폐쇄 환자를 대상으로 한 연구들에서 중증 출혈이나 간경색, 담관 천공, 패혈증 등 치명적 합병증들이 보고되었다[7,8,12]. 담관의 벽이 얇고 간동맥이 인접해 있어 전극의 의도치 않은 과열로 주변 구조 손상이 발생할 수 있기 때문에 간문부 담관에 대한 ID-RFA의 안전성 우려는 여전히 남아있다[13]. 현재 상용화된 ID-RFA 시스템으로는 Habib™ EndoHPB (Boston Scientific, Marlborough, MA, USA)와 ELRA™ (STARmed, Goyang, Korea) 두 종류가 있으며, 국내에는 아직 ELRA™ (STARmed)만 도입되어 있고 신의료기술로 사용이 가능하다. Habib™ (Boston Scientific)과 달리 ELRA™ (STARmed)는 전극 주위 온도 조절 시스템이 있어 미리 설정한 대로 온도를 일정하게 유지하고 과열을 방지하여 이로 인한 중증 합병증을 피할 수 있다는 이론적 장점이 있다. 현재까지의 ELRA™ (STARmed)를 사용한 연구들에서 치명적 합병증은 극히 드물었지만, Habib™ (Boston Scientific)에 비해 아직은 데이터가 부족하다[13-16]. Habib™ (Boston Scientific)을 사용한 과거 소규모 연구들에서 치명적 합병증이 보고되기도 했지만, 최근 간문부 폐쇄가 포함된 대규모 연구들에서는 안전한 RFA 설정값에 대한 데이터와 경험이 쌓이면서 중증 합병증 발생이 드물게 나타나고 있다[5,6,17]. 현재로서는 둘 중 어떤 시스템이 더 안전한지 결론 짓기는 어렵다. 그러나 안전성에 대한 우려가 낮고, 11 mm, 18 mm, 22 mm, 33 mm 등 다양한 길이의 전극이 있어 24 mm 단일 전극만 있는 Habib™ (Boston Scientific)에 비해 복잡한 간문부 폐쇄에 적절히 대응할 수 있다는 점은 악성 간문부담관 폐쇄의 치료에서 ELRA™ (STARmed)의 장점이 될 수 있다. Minipig의 간문부 담관에 ID-RFA를 시행한 전임상 동물 연구들에서 11 mm ELRA™ (STARmed) 카테터로 7W, 80℃의 설정값을 적용하였을 때 합병증이 없었고[14,16], 이 설정값(11 mm, 7W, 80℃, 60-120초)을 사용하여 진행된 임상 연구들에서도 심한 출혈이나 천공 등 중증 합병증이 보고되지 않았으므로 이는 실제 임상에서 악성 간문부 폐쇄에 안전하게 적용할 수 있는 적절한 RFA 설정값일 것으로 생각된다[14,16,18].
악성 간문부 담관 폐쇄에서 ID-RFA의 효과
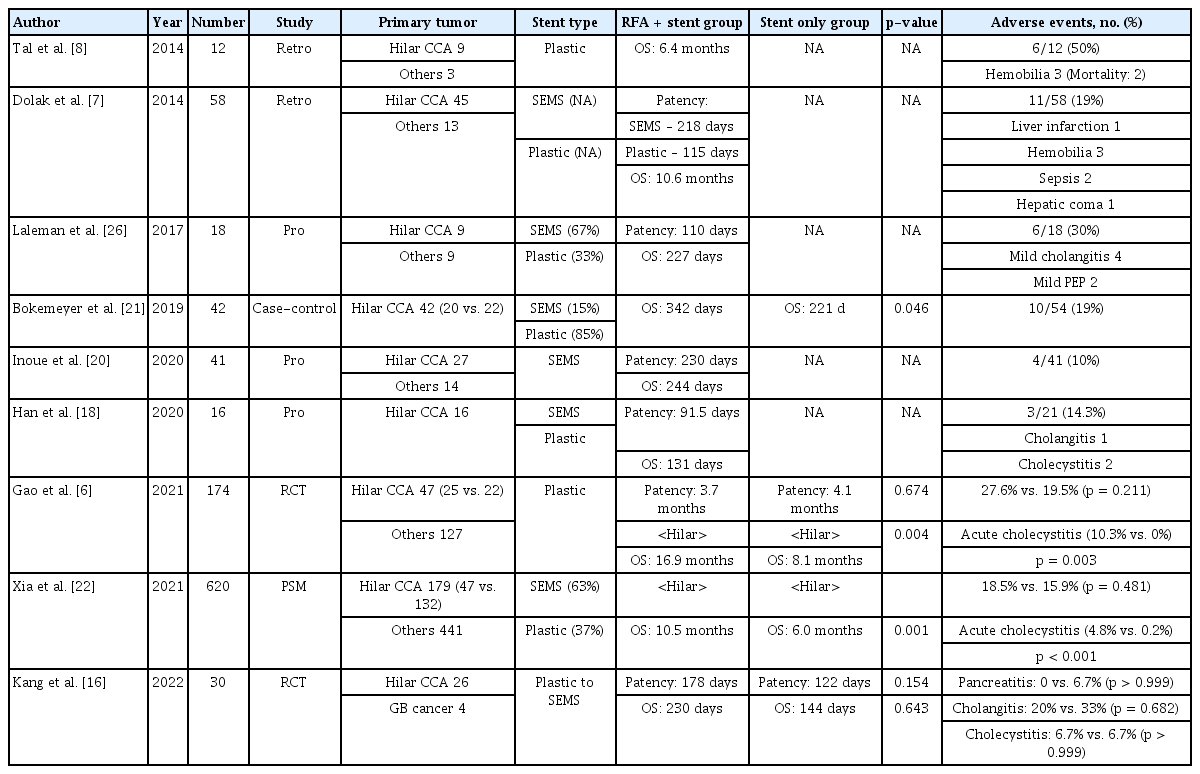
과거 연구들을 종합하면, 간외 담관 폐쇄에서 ID-RFA 후 기대되는 효과는 약 6개월 이상의 스텐트 개통 기간과 10개월 이상의 생존 기간이다[5,6,13,15,17,19,20]. 특히 최근 3년간 대규모 연구 및 무작위 비교 연구의 결과들이 발표되었고 스텐트 단독 치료에 비해 ID-RFA와 스텐트 병합 치료의 긍정적인 효과와 안전성에 관한 근거자료가 되고 있다. 하지만 대부분의 기존 연구들이 간외담관 폐쇄 중 원위부 담관 폐쇄를 주 환자군으로 하고 있으며, 간문부 담관 폐쇄만을 대상으로 한 연구는 현재까지 매우 부족하다(Table 1). 그럼에도 불구하고 최근 발표된 몇몇 비교 연구들에서 긍정적인 ID-RFA의 효과가 제시되었는데, 먼저 Bokemeyer 등[21]의 후향적 환자-대조군 연구에서는 진행성 간문부 담관 폐쇄에서 ID-RFA 후 스텐트를 삽입한 군(n = 20)에서 스텐트 단독군(n = 22)에 비해 긴 생존 기간(342일 vs. 221일, p= 0.046)을 보여주었다. 또한 Xia 등[22]은 후향적 1:4 성향점수 매칭(propensity score matching)으로 620명을 분석한 대규모 연구를 발표하였고 그중 179명의 간문부 담관암 환자를 하위그룹 분석하였을 때 ID-RFA 후 스텐트군(n = 47)에서 스텐트 단독군(n = 132)보다 더 긴 생존 기간(10.5개월 vs. 6개월, p= 0.001)이 보고되었다. 긍정적인 결과에도 불구하고 두 연구는 후향적 분석을 하였다는 점과 일관되지 않은 시술 방법이 혼재되어 간문부 폐쇄에서 ID-RFA의 효용성을 정확히 판단하기 어려운 제한점이 있다. 이에 Kang 등[16]은 30명의 진행성 악성 간문부 폐쇄 환자만을 대상으로 전향적 1:1 무작위 비교 선행 연구를 수행하였다. 첫 ERCP에서는 배정된 군에 따라 ID-RFA의 시행 유무가 결정되고 양측으로 플라스틱 스텐트를 삽입하였으며, 3개월 후 2차 ERCP를 시행하여 금속 스텐트로 교체하였고, 이때 ID-RFA군에서는 금속 스텐트 교체 전 추가적인 ID-RFA를 필요에 따라 시행하였다. 스텐트 개통 기간(178일 vs. 122일, p= 0.154) 및 생존 기간(230일 vs. 144일; p= 0.643) 모두에서 ID-RFA 후 스텐트 삽입군이 스텐트 단독군에 비해 긴 경향은 보였으나 통계적인 차이는 없었다. 흥미롭게도 ID-RFA군에서는 2차 ERCP를 예정대로 3개월째에 시행한 경우가 더 많았지만, 스텐트 단독군은 조기 스텐트 폐쇄가 발생하여 예정보다 빨리 ERCP를 시행한 경우가 많았다(69.2% vs. 23.1%, p= 0.018). 전향적 디자인에도 불구하고 소규모 선행 연구로 결과 해석에 제한점이 있겠으나, 간문부 담관 폐쇄에서도 ID-RFA의 효용성과 안전성을 확인하였다는 점에서 의의가 있고 이를 근거로 대규모 전향 연구 수행을 기대할 수 있겠다.
안전하고 효과적인 간문부 ID-RFA를 위한 전략
앞서 말하였듯 간문부 ID-RFA의 효용성에 대한 연구 결과들이 축적되고 있지만, 아직까지는 이상적인 시행 전략이나 적합한 환자군에 대한 논의를 하기에는 그 근거가 매우 제한적이다. 현재까지 발표된 연구들에서 시행된 방식은 크게 두 가지로 나눌 수 있는데, 첫 번째는 2-3개월마다 정기적으로 ID-RFA와 플라스틱 스텐트 교체를 반복하는 반복 시행법이고, 두 번째는 ID-RFA 후 비 피막형 금속 스텐트를 바로 삽입하고, 이후의 추가 시술은 예정하지 않는 단일시행법이다. ID-RFA는 국소적으로 종양을 소작하여 종양 부담(tumor burden)을 줄일 수 있지만, 한 번의 치료로 장기적인 유지 효과를 기대할 수는 없다는 단점이 있는데, 반복 시행법은 ID-RFA의 국소 종양 통제(local tumor control) 효과를 극대화, 장기화하기 위한 접근법이다. 스텐트를 지속적으로 교체해야 하므로 주로 플라스틱 스텐트를 사용하며 이는 비 피막형 금속 스텐트를 삽입하였을 때보다 재시술이 용이하다는 장점이 있다[23]. 또한 ID-RFA를 통해 예정된 스텐트 교체 시기 전에 발생할 수 있는 조기 스텐트 폐쇄 예방에도 도움이 될 수 있을 것으로 기대된다[16]. 현재까지 간문부를 포함한 악성 간외 담관 폐쇄에서 ID-RFA와 스텐트 병행 치료의 생존 기간 연장 등 유의한 임상적 유용성을 보고한 전향적 대조 연구들의 대부분은 반복 시행법을 채택하였다는 점도 흥미로운 점이다[5,6,16]. 하지만 환자가 반복적으로 시술 관련 합병증 위험에 노출되며 비용이 증가하고, 질병 진행에 따라 어느 시점부터는 시술이 불가능할 수도 있다는 점을 유의해야 한다. 단일시행법은 반복적인 시술을 피할 수 있고 비 피막형 금속 스텐트 자체가 진행성 담관 폐쇄의 치료에 있어 플라스틱 스텐트보다 선호된다는 장점이 있다[3]. 그러나 일회성 ID-RFA의 장기 효과가 제한적일 것으로 예상되고 처음에 단일시술을 계획하였다 하더라도 결국 스텐트 폐쇄로 인한 재시술이 언제든 필요할 수 있으며, 비피막형 금속 스텐트의 폐쇄로 인한 재시술은 일반적으로 플라스틱 스텐트보다 어려울 수 있다는 점을 유의해야 한다[24]. 특히 간문부 담관 폐쇄에서 ID-RFA 후 스텐트 단일시행법의 효용에 대해서는 전향 연구를 통한 근거가 충분치 않아 추후 연구가 더 필요할 것으로 보인다[13,20]. 아직은 방법 간의 우열을 논하기 어려우며, 환자의 기대여명, 수행 상태, 치료 의지와 순응도 등을 고려하여 개인화된 결정이 필요할 것이다. 만약 기대여명이 3개월 이상이며 적극적인 치료 의사가 있고 최선의 결과를 얻기 원하는 환자의 경우 현재로서는 정기적 플라스틱 스텐트 교체와 병행하는 ID-RFA 반복 시행법을 우선적으로 고려해볼 수 있을 것으로 생각된다. 이 외에 개별 연구들에서 ID-RFA의 효과가 더 좋았던 환자의 특성들로는 간외 담관암[22], 원격전이가 없는 경우[22,25], 관내 성장 패턴 (intraductal growth pattern)을 보이는 종양[18], 협착 길이 15 mm 이상[20], Bismuth type II와 III [16] 등을 제시하였지만, 실제 이러한 환자군들이 ID-RFA에 더 적합한 적응증일지에 대해서는 향후 대규모 전향 연구를 통한 확인이 필요하다. 마지막으로 적절한 항암 화학요법과 ID-RFA를 병용하였을 때 그렇지 않은 경우보다 상승효과들이 보인 바 있어 가능하다면 항암 화학요법을 함께 시행하는 것이 추천된다[17,25].
결 론
ID-RFA는 최근 악성 간외 담관 폐쇄의 효과적인 국소 치료로 저변을 넓히고 있는 치료법이다. 과거에 비해 안전한 설정값과 임상 경험이 증가하며 진행성 악성 간문부 폐쇄에서도 유용하고 안전하다는 근거들도 점차 축적되고 있다. ID-RFA로 효과적인 국소 종양 소작을 시행하고, 이후 적절한 스텐트 삽입과 전신 항암 화학요법이 뒤따른다면 가장 좋은 임상적 성과를 얻을 수 있을 것으로 생각된다. 향후 대규모 전향적 비교 연구를 통해, 이상적인 시술 전략과 적응증에 대한 정립이 필요하다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
HK drafted the manuscript. EJK and YSK revised the draft critically for important intellectual content. All authors read and approved the final manuscript.