저선량 흉부 단층촬영을 이용한 폐암검진
Lung Cancer Screening with Low-Dose Chest Computed Tomography
Article information
Trans Abstract
Early detection and treatment is important to reduce mortality from lung cancer. Based on the positive results of lung cancer-related mortality reduction from large randomized trials of low-dose chest computed tomography (LDCT)-based screening in high-risk populations, LDCT-based screening programs have been implemented in several countries including Republic of Korea. This review focus on the current evidence and state of the art of LDCT-based lung cancer screening, and further discuss the ongoing efforts to develop more efficient screening programs worldwide. This article includes recent updates on the identification of high-risk population eligible for screening and management for screen-detected nodules. Additionally, aspects on future research direction would be addressed.
서론
폐암은 현재까지 세계적으로 암으로 인한 사망의 가장 큰 원인이 되는 암종이다[1]. 특히 병기에 따른 생존율의 차이가 크나, 조기 병기에는 증상이 없는 경우가 많고, 대부분 진행성 병기가 되어서야 연관 증상이 나타나기 때문에 국한단계의 폐암으로 진단되는 환자들의 비율이 낮으며, 이는 낮은 생존율로 이어지게 된다[2,3]. 하지만 폐암도 조기에 발견하여 치료하면 완치가 가능하고, 생존율도 증가한다. 특히 1A 병기 조기 폐암의 경우 5년 생존율이 75%가 넘기 때문에, 조기 발견 및 적절한 치료가 폐암으로 인한 사망률을 줄일 수 있는 가장 효과적인 방법이다. 따라서 세계적으로 무증상기의 조기 폐암을 빨리 발견하여 진단하기 위한 효과적인 검진 방법을 개발하고 증명하기 위한 시도들이 오랜 시간 이어져 왔다[4]. 그중 1990년대부터 꾸준히 연구되어 온 저선량 흉부단층촬영(low-dose chest computed tomography, LDCT)을이용한 폐암검진은 2011년에 발표된 대규모 무작위 비교 임상 연구(randomized controlled trial, RCT)인 National Lung Cancer Screening Trial (NLST)이 대표적이다. 이 연구는 55-74세의 30갑년 이상의 흡연자에서 LDCT를 이용한 폐암 검진이 유의하게 폐암으로 인한 사망률을 줄일 수 있음을 밝히면서 크게 주목받았다[5]. 2020년에는 유럽에서 시행한 또하나의 대규모 전향적 RCT인 Dutch-Belgian Lung Cancer Screening Trial (NELSON) 결과가 발표되었고, 역시 NLST와마찬가지로 고위험 남성 흡연자에서 LDCT를 이용한 폐암검 진이 유의하게 사망률을 감소시켰음을 보여주었다[6]. 이외에도 유럽에서 시행된 몇 개의 전향적 연구에서 오랜 추적 관찰을 한 결과 LDCT 검진을 시행한 군이 대조군에 비해 폐암 사망률이 감소하였음을 밝히면서, LDCT는 이제는 유일하게 폐암을 조기에 발견하여 치료할 수 있는 유용한 폐암 검진도구로 인정받고 있으며, 우리나라에서도 2019년 8월부터 고위험 흡연자를 대상으로 LDCT를 이용한 국가폐암검진을 시작하였다[7]. 본고에서는 LDCT를 이용한 폐암검진의 도입 기반이 되는 임상적인 근거와, 검진 대상, 검진 결과에 대한 관리를 중점으로 폐암검진의 효과를 극대화하고 단점을 최소화하기 위해 진행중인 노력들 그리고 제도 보완을 위해 앞으로 연구되어야 하는 방향에 대하여 기술하였다.
본론
근거에 기반한 폐암검진의 효과와 동향
세계적으로 폐암을 조기에 발견하기 위한 시도들은 1970년대부터 있었고, 초기에는 흉부 X선이나 객담세포 검사를 이용한 검진이 시도되었으나 연구를 통해 효과가 없음이 밝혀졌다[8]. 1990년대 들어서는 통상적인 흉부 단층촬영보다 방사선 피폭을 감소시킨 LDCT를 이용하여 폐암을 조기에 발견하려는 노력들이 있었다. 무작위 배정을 통한 대조군을 둔연구는 아니지만 1993년에 미국에서 처음 시작된 Early Lung Action Project (ELCAP)는 전향적으로 대규모의 LDCT 검진을 시행한 연구로, LDCT를 이용한 폐암검진을 한 수검자들에서 진단된 폐암의 85%가 1기 폐암으로 진단되었음을 보고하였다[9,10]. 이에 대규모 RCT를 통하여 LDCT를 이용한 폐암검진이 폐암으로 인한 사망률을 감소시킬 수 있는지 평가하고자 하는 노력들이 2000년대 들어서 시작되었다.
현재까지의 연구 중 가장 대규모로, 2002년부터 5만 명 이상의 흡연자를 무작위 배정하여 LDCT 검진의 유용성을 검증한 미국의 NLST는 흉부 X선으로 폐암검진을 시행한 대조 군에 비해서 LDCT를 이용한 폐암검진을 받은 수검자들에서 폐암으로 인한 사망률이 20% 감소함을 2011년에 발표하였다[5]. 2003년부터 네덜란드와 벨기에에서 시작하여 1만 5천명 이상의 흡연자에서 LDCT를 이용한 폐암검진의 유용성을 검증한 RCT인 NELSON 연구에서도 LDCT 검진을 받은 남성들이 대조군에 비해 24%의 폐암 연관 사망률 감소를 보이는 결과를 2020년도에 발표하였다[6]. 그 외에도 대상자수가 5천 명 이하로 상대적으로 적었으나 이탈리아에서 진행된 Multicentric Italian Lung Detection (MILD) 연구에서도 10년이상의 장기적인 추적을 하였을 때 LDCT 검진군에서 폐암 사망률이 39%, 전체 사망률은 20% 감소함을 보고하였다. 특히 검진 시작 첫 5년을 제외한 5년 이후의 장기적인 효과를 보았을 때 폐암 사망률이 58% 감소하였다[11]. 이들 연구를 포함한 주요 RCT들의 결과를 표 1에 정리하였다. 표 1을 보면 모든 연구들에서 폐암의 고위험군에 들어가는 수검자를 대상자로 포함하기 위해 적게는 15갑년에서 30갑년까지 흡연력이 있는 흡연자들을 검진 대상으로 설정하였음을 알 수 있다.
NLST의 결과를 바탕으로 2013년도에 미국의 U.S. Preventive Services Task Force (USPSTF)에서 NLST의 연구 참여 기준과 유사하게 55-80세의 30갑년 이상 흡연자들에게 폐암검진을 권고하였으며[12], 이후로 많은 단체와 국가에서 폐암검진 권고안을 제시하기 시작하였다. 2015년도에는 미국의 공보험인 Centers for Medicare and Medicated Service에서 폐암 고위험군을 대상으로 하는 폐암검진에 보험을 적용하기 시작하였고, NELSON 연구와 다양한 후속적 역학 연구들을 통해더 낮은 흡연갑년을 가지는 수검자에서도 LDCT를 이용한 폐암검진이 효과적일 수 있다는 결과들이 나오면서[13], 2020년에는 USPSTF에서 폐암검진 권고 대상자를 50-80세의 20갑년 이상 흡연자로 그 기준을 넓혔다[14]. 우리나라에서는 2017년도부터 아시아 최초로 대규모 폐암검진 시범사업인 Korean Lung Cancer Screening Project (K-LUKAS)가 14개의 기관에서 55-74세의 30갑년 이상 흡연자를 대상으로 시행되었고[7], 그 결과들을 기반으로 2019년 후반기부터 국가 폐암검진 사업을 시작하였다. 유럽의 여러 국가들에서도 LDCT를 이용한 폐암검진 권고안과 정책들이 발표되고 있으며, 특히 영국에서는 주요 도시에서 ‘Lung Health Check’라는 명칭으로 LDCT 검진이 이루어지고 있다[15,16].
검진 대상의 선정
현재까지 우리나라를 비롯한 다수의 국가와 단체들에서 사용하는 폐암검진 권고안은 나이와 흡연력에 따라 수검 대상자를 결정하고 있다. 이러한 기준은 NLST와 같은 대규모 임상 연구의 기준에서 비롯된 것으로, 보다 현실적이고 적용이 쉬운 장점도 있으나, 이분법적으로 대상자를 결정하게 되고, 흡연과 나이 외의 다른 폐암의 위험인자들이 고려되지 않는 단점이 있다. 따라서 최근에는 이러한 단순한 선택기준만으로 인구집단 수준에서 검진 대상자를 검진의 효과를 극대화하기가 어렵다는 의견들이 설득력을 얻고 있다. 현재의 USPSTF 권고에서도 검진으로 인한 조기폐암의 진단율을 높이는 이득은 최대화하고, 검진으로 인한 위해는 최소화하기 위해서 검진 대상으로 삼을 폐암 고위험군을 정확하게 분류해 내는 것이 중요함을 강조한다[12]. LDCT를 이용한 폐암 검진의 유용성이 검증되기 시작하면서, 검진 대상으로 삼을 선택기준을 보완하기 위해 폐암 발생률을 예측하는 다양한 위험예측모델들이 개발되어 왔고, 최근에는 LDCT 검진의 효과가 검증이 되면서, 단순 나이와 흡연력만으로 검진 대상을 선별하는 것이 아닌 위험예측모델에 기반하여 폐암검진 대상자를 선별하려는 노력들이 연구에 반영되고 있다.
현재까지 개발되고 검증된 여러 개의 위험예측모델 중 대표적인 것으로 Liverpool Lung Project (LLP) 모델과 PLCOM2012 모델이 있다[17,18]. LLP 모델과 PLCOM2012 모델은 실제로 유일하게 전향적인 LDCT 폐암검진 연구에 적용이 시도된 두 모델이기도 하다. LLP 모델은 2008년도에 영국 리버풀 지역에 기반한 연구로 개발되었으며, 흡연 기간, 폐렴 진단력, 석면 노출력, 개인의 암 진단력, 폐암 가족력을 인자로 하여 5년 폐암 발생 위험률을 계산한다[17]. LLP 모델은 이후 영국에서 진행된 LDCT를 이용한 폐암검진의 효과를 보는 RCT인 United Kingdom Lung Screening Trial (UKLS)에 적용 되었다. UKLS는 LLP 모델에 기반하여 5년 폐암 발생 위험률이 5% 이상인 50-75세의 수검자를 2011년부터 모집한 RCT로, 통계적인 유의성을 얻을 수 있는 예측인원보다 적은 4,000여 명을 모집하는 파일럿 연구로 진행되었기 때문에, 최근 2021년에 발표한 7년여의 추적 관찰 결과에서 LDCT 검진을 시행한 군에서 유의한 폐암 연관 사망률의 감소를 보여주지는 못하였다[19].
PLCOM2012 모델은 미국에서 진행된 대규모 암검진 RCT인 Prostate, Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial을 기반으로 개발된 모델로, PLCO 연구는 폐암검진을 LDCT가 아닌 흉부 X선을 이용하여 진행하였지만, 15만 명이상의 수검자가 포함된 대규모 연구로 그 결과들은 여러 암종에 대한 중요한 역학정보를 제공한다[20]. PLCOM2012 모델은 PLCO 연구에 포함되었던 80,375명의 흡연자를 바탕으로 6년 폐암 발생 위험률을 계산한 모델로, 예측인자로는 연령, 인종, 사회경제적 지위, 신체질량지수, 암 병력, 폐암 가족력, 만성 폐쇄성 폐질환 병력, 흡연 상태, 흡연강도, 흡연 기간 및 금연 기간이 포함되었다[18]. 이 모델을 NLST 연구 코호트와 PLCO 연구 코호트에서 검증하였을 때 나이와 흡연력에만 기반한 NLST 기준과 비교하여 PLCOM2012 모델에 기반한 대상자 선정을 하였을 때 폐암 진단에 있어서 더 우수한 민감도(83.0% vs. 71.1%, p < 0.001)와 양성예측도(4.0% vs. 3.4%, p = 0.01)를 보이면서도 특이도는 비슷하였다. 이는 NLST 연구의 대상자 선정기준보다 PLCOM2012와 같은 위험 예측모델을 이용하여 검진 대상을 선정하는 것이 폐암진단에 더 효율적임을 제시한 것이다[18]. PLCOM2012 모델의 전구 모델격인 PanCan 모델은 위험예측모델로는 최초로 대규모 전향적 LDCT 폐암검진 연구인 PanCan (Pan-Canadian Early Detection of Lung Cancer) 연구에 사용되었다. PanCan 연구는 추적 관찰 기간 동안 6.5%의 폐암 누적발생률을 보여 NLST 의 4.0%보다 높은 빈도로 폐암이 진단되었음을 보고하였고, 진단된 폐암 중 제한병기(1기 또는 2기)로 진단된 암의 비율도 77%로 NLST의 57%보다 높았다[21]. 2017년도부터 진행된 다른 다국적 전향적 LDCT 폐암검진 연구인 International Lung Screening Trial (ILST)은 PLCO M2012 모델을 기반으로 계산된 6년 폐암 발생 위험률이 1.51% 이상이거나 또는 2013년 USPSTF 기준을 만족하는 고위험군을 대상으로 폐암검진을 진행하여 어느 기준이 더 많은 폐암의 진단과 폐암 관련 사망을 줄이는 데에 효과적인지 확인하고자 한 연구이다[22]. 2022년에 발표된 중간 결과에 따르면 코호트를 2년여간 추적하였을 때, 2013년 USPSTF 기준보다 PLCOM2012 모델을 이용하여 폐암검진 대상자를 선정하는 것이 15.8% 더 많은 폐암을 진단해냈으며, 폐암 진단자의 총 기대여명을 계산해 보았을 때 PLCOM2012 모델에 의하여 선별된 대상자들이 USPSTF 기준에 의해 선별된 대상자들에 비해 유의하게 기대여명의 총합이 높았다[23].
이처럼 검증된 폐암위험예측 모델을 이용한 폐암검진 대상자 선정은 폐암검진의 효과를 극대화하고 단점을 최소화하는 방법으로 기대 받으며 많은 후속 연구들이 이뤄지고 있다. 그러나 현재까지의 증명된 주요 모델들은 서양에서 개발된 것으로, 여성과 비흡연자에서 발생하는 폐암, 간유리음영 결절이나 부분고형결절의 형태로 발생하는 폐선암의 발생 빈도가 높은 우리나라를 비롯한 아시아 국가에서도 이러한 폐암예측모델이 우수한 효과를 보일 수 있을지는 미지수이다. 또한 현재까지는 여러 시뮬레이션 연구들을 통해 분석해 보았을 때 비흡연자에 대한 폐암검진은 권고되고 있지 않지만[24], 비흡연자에서 발생하는 폐암 비율이 상대적으로 높은 아시아 지역에서는 비흡연자 중에서도 고위험군을 선별 하여 LDCT 검진을 시행하는 것이 효과적일 것이라는 일부 시각이 존재한다[25,26]. 앞으로 인종, 지역, 국가별 상황에 맞는 다양한 폐암 위험예측모델의 개발과 이에 기반한 고위험군 선별과 폐암검진이 필요한 이유이다.
폐결절의 진단과 추적 관리
효과적인 폐암검진을 위한 가장 중요한 전제조건은 LDCT의 정확한 판독이다. 폐결절은 검진 CT에서 발견되는 가장 중요한 영상 소견으로, 조기 폐암이 흔히 폐결절로 나타나기 때문에 폐암의 위험이 있는 폐결절을 잘 감별해 내야 폐암을 조기에 진단하여 치료하고, 불필요한 추가 검사나 시술은 줄일 수 있다. LDCT를 이용한 폐암검진 프로그램에서 폐결절의 발견 빈도는 연구에서 설정한 결절의 기준에 따라 다소 차이가 있지만, 첫 LDCT 검진에서 22-51%의 수검자에게서 폐결절이 발견되는 것으로 보고되고 있고, 1년 간격으로 LDCT 검진을 진행하였을 때 첫 검진 이후로 매해 3-13% 에서 새로운 결절이 발견된다[27-29]. 중요한 것은 LDCT 검진에서 발견되는 대부분의 폐결절은 그 크기가 작다는 것이다. 여러 전향적 연구들에 따르면 검진에서 발견되는 폐결절의 50% 이상이 직경 5 mm 이하이거나 부피로 측정하였을때 50 mm3 이하였다[29-31]. 따라서 검진에서 발견되는 폐결절이 실제 폐암일 가능성은 높지 않다. NLST에서는 4 mm 이상의 폐결절을 검진 양성으로 설정하였는데, LDCT 폐암 검진을 진행하는 기간동안 총 수검자의 39.1%에서 폐결절이 발견되었지만, 실제로 발견된 폐결절 중 3.6%만이 최종적으로 폐암으로 진단되었다[5].
폐암검진 중 발견된 폐결절을 어떻게 추적하고 필요 시침습적 진단을 시도할 것인지에 대해서는 여러 연구와 학회 단체에서 권고안을 제시해 왔으며, 이 권고안들은 새로운 연구 결과들이 나오면서 지속적으로 업데이트되고 있다. 현재까지 대부분의 권고지침에서는 검진에서 발견된 폐결절의 가장 긴 직경으로 측정된 크기, 결절의 성상(간유리음영결절, 부분고형결절 또는 고형결절) 그리고 발견 시기(첫 검진 또는 이후 검진)에 따라 추적 관찰 시기 또는 침습적 조직 검사 여부를 결정할 것을 권고한다[32-34]. NELSON 연구를 대표격으로, 유럽에서 시행된 몇 개의 연구들에서는 CT 영상에서 3차원적으로 결절의 부피를 측정하는 방법으로 폐결절의 크기를 정의하는 것의 유용성을 제시하였고, 이는 유럽을 중심으로 주요 권고지침에 반영되기 시작하였다[6,15]. 이러한 3차원적 부피 측정에 기반한 폐결절의 크기평가 지침은 최근 2019년도에 개정된 Lung-RADS version 1.1에도 반영 되었다[35]. Lung-RADS는 미국영상의학회에서 제작한 표준화된 판독 및 분류 시스템으로서, 폐암검진 CT의 결과와 관리가 필요한 폐결절의 추적을 위해 최적화된 권고안이다. 검진에서 발견된 폐결절은 결절의 크기, 성상, 발견 시기에 따라 범주화하고, 소견을 크게 0, 1, 2, 3, 4A, 4B, 4X의 범주로 분류하여, 각 범주에 맞는 진료 계획을 권고한다[35]. 2019년부터 시작된 우리나라 국가폐암검진의 LDCT 판독 및 결절 관리지침도 우리나라의 진료환경에 맞추어, Lung-RADS version 1.0을 일부 조정하여 반영되도록 채택하여 시작하였고 (Table 2), 지속적인 업데이트가 이루어지고 있다[7,36].
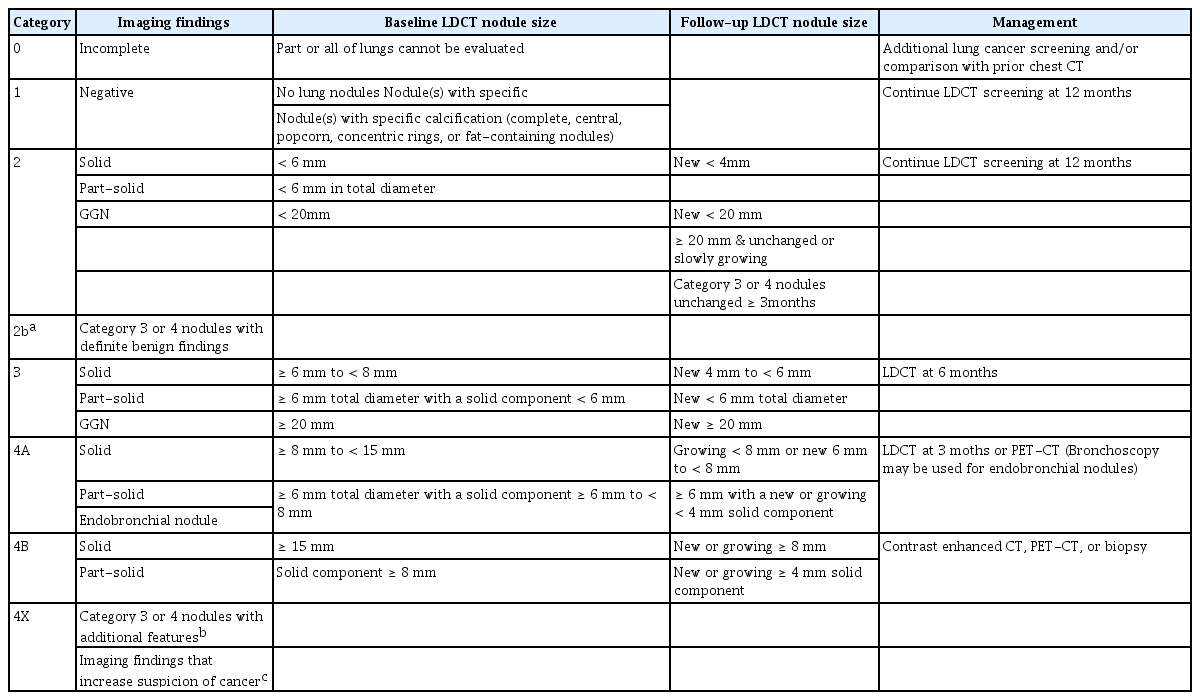
Lung computed tomography screening reporting and data system version 1.0 classification by American College of Radiology with modification by KSTR
현재까지의 주된 권고안에서 제안하는 결절 크기와 성상, 발견 시기에 기반한 폐결절의 추적 관리 방법 외에도, 폐암 검진의 대상을 선정하기 위한 예측모델이 다양하게 개발되어 온 것처럼 CT에서 발견된 폐결절의 악성 위험도를 예측 하는 모델의 개발과 검증도 활발하게 진행되어 왔다. 대표적으로 PanCan 연구 코호트를 이용하여 개발된 Brock 모델(Vancouver Risk 모델로도 지칭됨)에서는 폐결절의 악성 위험을 예측하는 주요 인자로 고령, 여성, 폐암의 가족력, 결절 크기, 폐기종, 결절 위치(폐엽), 결절 성상, 결절의 모양(침상형 결절), 결절 수를 제시하였다[37]. Brock 모델을 NLST 연구 코호트에 적용하여 위험점수 문턱값을 10%로 정의하였을 때, 결절의 악성 예측에 있어서 민감도 85.3%, 특이도 93.9%로 높은 성능을 보였으며[38], 역시 NLST 코호트를 대상으로 Brock 모델과 Lung-RADS의 악성 예측 성능을 비교해 보았을 때, 결절을 기반으로 한 예측 정확도에서 Brock 모델이 더 우수한 민감도(93% vs. 87%, p = 0.077), 특이도 (90% vs. 83%, p < 0.001), 정확도(90% vs. 83%, p < 0.001)를 보여주었다[39]. Brock 모델 외에도, 반드시 폐암검진 목적의 LDCT가 아닌 다양한 임상적 상황에서 CT 촬영 결과 발견되는 폐결절의 악성 위험도를 예측하는 다양한 모델들이 개발되었거나 개발 중이다[40]. 더불어 최근에는 인공지능을 이용하여 검진 LDCT의 소견들 판독과 폐결절의 특성 분류, 나아가 악성 위험도를 평가에도 도움을 받을 수 있는 시스템을 개발하는 것이 학계의 많은 관심을 받고 있다[41]. 새로운 기술과 접목된 우수한 모델들이 다양한 폐암검진 프로그램에 반영된다면 검진의 효과를 높이는 데에 큰 도움이될 것이다.
결론
50여 년에 걸친 긴 시간동안 검진을 통한 폐암의 조기진단과 연관 사망률 감소를 목표로 한 주요한 연구자료들이 축적되면서, 이제는 LDCT를 이용한 폐암검진이 폐암 관련 사망률을 줄일 수 있다는 사실은 어느 정도 확립되었고, 이러한 폐암검진을 도입하는 것이 국가별 다양한 상황과 경제적인 요소를 고려하더라도 효율적일 수 있음이 다양한 연구를 통해 밝혀졌다. 특히 2019년도부터 우리나라에서 시행된 국가폐암검진은 폐암과 연관된 국민들의 건강을 향상시키는 데에 큰 역할을 할 것으로 기대되며, 앞으로 축적되는 결과 들은 아시아에서 대규모로 시행되는 대표적인 폐암검진 프로그램으로서 세계적으로 주목받는 귀중한 자료가 될 것이다. 앞으로는 기존에 밝혀진 사실들에서 더 나아가 어떻게 폐암검진을 효율적으로 실시하고, 검진의 질을 관리하며, 검진으로 발견되는 다양한 소견들에 효과적인 진료를 제공할수 있는지에 대한 광범위한 논의들과 연구가 필요하며, 이러한 과정에 여러 분야의 전문가들의 적극적인 관심과 참여가 필수적이다.
