저혈당의 감별 진단
Differential Diagnosis of Hypoglycemia
Article information
Trans Abstract
Hypoglycemia is common but can lead to life-threatening consequences. Accurate diagnosis is important to establish the appropriate treatment strategy. Most cases of hypoglycemia are caused by hypoglycemic agents, although it can occur in individuals without diabetes. A systemic and comprehensive diagnostic approach is required to diagnose hypoglycemia in patients without diabetes. It is important to perform appropriate blood testing during an episode of hypoglycemia. This review will focus on the definition, differential diagnosis, causes, and treatment of hypoglycemia, particularly in people without diabetes.
서 론
저혈당은 적절하게 치료되지 않을 경우 의식저하 및 사망까지 이를 수 있는 치명적인 합병증이다. 우리나라 건강보험공단을 분석한 자료에 따르면 2형 당뇨병 환자의 1년 저혈당 빈도는 1.38%였고, 그중 응급실로 내원할 정도의 중증 저혈당은 0.96%로 보고한 바 있다[1]. 저혈당의 대부분은 당뇨병 약제를 사용하는 환자에서 발생하지만, 드물게 당뇨병 과거력이 없는 환자에서도 발생할 수 있다. 최근 10년간 종합병원 응급실로 내원한 저혈당 환자의 원인을 분석한 결과 당뇨병 약제에 의한 저혈당(93.3%)이 제일 흔하였지만, 음주(4.5%), 말기암(0.6%), 장기간 금식(0.6%), 부신기능저하증(0.3%), 덤핑증후군(0.3%)과 같은 당뇨병 과거력이 없는 경우도 상당 수 있었다(unpublished data). 저혈당 원인을 찾기 위해서는 환자 병력, 신체 검진 그리고 혈액 검사를 통하여 체계적인 진단 접근과정이 필요하다. 이에 저자들은 저혈당으로 내원한 환자의 진단적 접근, 특히 저혈당의 감별 진단에 대하여 논하고자 한다.
본 론
증례
26세 남자가 2개월 전부터 간헐적으로 반복되는 어지럼증을 주소로 외래 방문하였다. 증상은 주로 아침 공복에 주로 발생하고 음식 섭취 후 호전된다고 하였다. 병력상 기저 질환은 없었고 건강식품을 비롯한 복용 중인 약물은 없었다. 저혈당에 대한 평가를 위하여 입원 상태에서 혈당추이를 관찰하였다. 오전 7시 공복상태에서 발한을 동반한 어지럼증 및 오심 증상을 호소하였고, 당시 시행한 자가혈당 53 mg/dL 확인되어 포도당 주사하여 저혈당 교정 후 증상이 호전되는 Whipple’s triad를 만족하였다. 저혈당 발생 당시 시행한 혈액 검사 상 혈청 포도당 48 mg/dL, C-펩타이드 3.61 ng/mL (1.06-3.53 ng/mL), 인슐린 19.53 ulU/mL (1.90-15.97 ulU/mL) 확인되어 고인슐린혈증에 의한 저혈당을 진단하였고, 이 외 다른 저혈당을 유발할 수 있는 질환 감별을 위해 시행한 급속 부신피질 자극 검사 및 인슐린 항체 검사에서는 특이 소견이 관찰되지 않았다. 인슐린종 감별을 위해 시행한 복부 컴퓨터단층촬영(computed tomography, CT) 및 자기공명영상(magnetic resonance imaging, MRI)에서 췌장 꼬리의 1.4 cm의 동맥기에 과조영되는 균질한 종괴가 확인되었다. 이에 종괴의 인슐린 과분비 여부를 확인하기 위하여 선택적 동맥칼슘 자극 검사를 시행하였다. 위십이지장동맥, 상장간막동맥, 비장동맥에서 각각 칼슘 자극 전과 30초, 60초, 120초 후에 채혈하여 인슐린 수치를 비교하였고 위십이지장동맥 및 비장 동맥을 자극하였을 때 자극 전과 비교하여 2배 이상의 인슐린 수치 증가를 확인하여 수술적 치료를 시행하였다. 복강경 하 육안으로 확인되는 췌장 꼬리의 종괴가 관찰되어 핵절제술을 시행하였고 조직병리 검사 상 도세포종에 해당하는 양성 인슐린종으로 진단하였다. 수술 이후 저혈당은 관찰되지 않아 퇴원하였고 현재까지 재발 없이 외래 추시 중이다.
진단 및 분류
2012년 미국당뇨병학회(American Diabetes Association) 및 미국내분비학회(American Endocrine Society)에서 저혈당과 관련하여 공동 가이드라인을 제정하였다[2]. 이 가이드라인에서는 저혈당을 '비정상적으로 낮은 혈장 포도당 농도로 개인을 잠재적인 위험에 노출시킬 수 있는 모든 상황’으로 정의하였고 whipple’s triad를 만족해야 한다고 제시하였다. Whipple’s triad는 다음의 3가지로 이 기준을 모두 충족시키는 경우 저혈당으로 정의하였다.
1) 저혈당에 합당한 증상 및 증후
2) 혈장 포도당이 70 mg/dL 이하
3) 혈장 포도당이 상승하면서 저혈당의 증상 및 증후가 사라질 때
이 가이드라인에서는 저혈당을 크게 5가지로 분류하여 치료 결정 및 환자 교육에 있어 사용할 수 있도록 하였다(Table 1) [2]. 저혈당의 치료 결정에 있어 타인의 도움을 필요로 하는지 여부가 중요하기 때문에 도움을 필요로 하는 경우는 중증 저혈당(severe hypoglycemia)으로 정의하였고, 스스로 대처할 수 있을 경우에는 확인된 증상 저혈당(documented symptomatic hypoglycemia)으로 정의하였다. 그리고 평소 혈당 조절이 불량한 환자는 실제 저혈당이 아닌 수치에도 신경당결핍 증상을 느낄 수가 있기 때문에 이를 거짓-저혈당(pseudo-hyponatremia)으로 정의하여 환자에게 교육하도록 하였다.
증상 및 징후
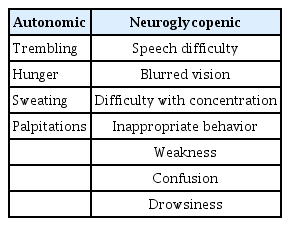
저혈당 진단의 시작은 저혈당의 증상 및 증후를 파악하는 것으로 개개인에 따라 다양하게 발현될 수 있다. 저혈당의 증상은 자율신경계 증상과 신경당결핍 증상 증상으로 나누어 볼 수 있다(Table 2) [3]. 자율신경계 증상은 떨림, 두근거림, 두통과 같은 증상으로 저혈당 초기에 나타나게 되고 중증 저혈당으로 진행하게 되면 혼동, 실신, 조화운동불능과 같은 신경당결핍 증상이 나타날 수 있다. 때로는 저혈당 발생 시 자율신경계 증상이 발생하지 않고 바로 신경당결핍 감소 증상이 발현되게 되는데, 저혈당의 전조증상 없이 갑자기 의식 소실을 일으킬 수 있으며 이를 저혈당 무감지증으로 정의하였다. 저혈당이 빈번한 경우, 노인 그리고 당뇨병의 유병 기간이 긴 경우에는 저혈당 무감지증의 위험도가 증가한다[4]. 저혈당 무감지증은 반복된 저혈당에 의하여 신체 내 포도당 길항호르몬 작용이 둔화되어 발생하게 되며 중증 저혈당의 위험성을 증가시키기 때문에 주의가 필요하다[4,5].
기전
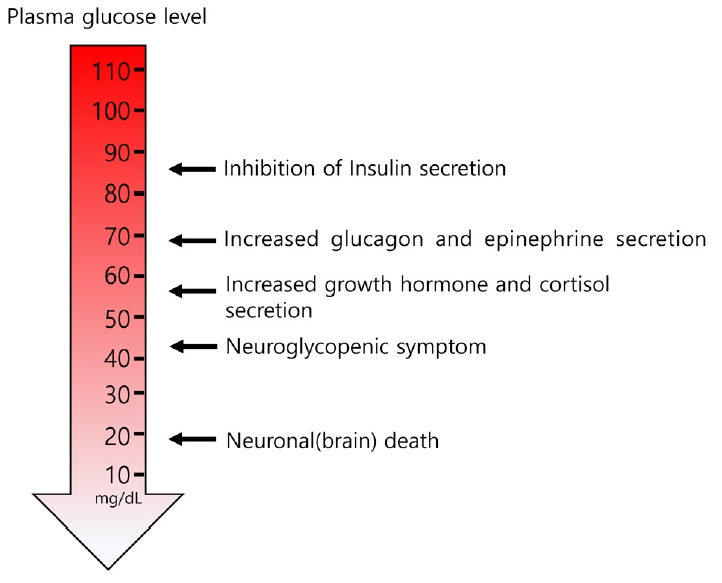
포도당은 몸에 필요한 에너지를 생성하는 데 필수적인 물질이다. 포도당 대사는 신장, 간, 췌장을 비롯한 신경-내분비 기관들에 의하여 조절된다. 포도당은 뇌를 비롯한 중요한 기관의 주요 에너지원으로 사용되므로 저혈당이 발생하는 경우 일련의 기전을 통하여 일정한 농도의 혈중 포도당을 유지한다(Fig. 1). 특히 인지기능 저하가 발생할 정도의 저혈당이 발생하였을 때 방어기전이 나타나는 것으로 알려져 있다[6]. 저혈당이 발생하면 첫 번째 반응으로 췌장 베타세포에서 인슐린 분비가 중단된다[7,8]. 인슐린 분비의 중단으로 인해 혈당을 일정 수준 이상으로 유지할 수 있게 한다. 그 다음으로 중요한 길항호르몬은 글루카곤이다[7]. 저혈당이 발생하면 췌장의 알파세포에서 글루카곤이 분비되어 간에서 글리코겐을 포도당으로 분해해 혈당을 증가시키는 작용을 한다. 글루카곤의 작용과 함께 에피네프린이 생산되어 혈당을 증가시키는데, 대개 혈당이 70 mg/dL 이하로 떨어지지 않도록 작용한다[7]. 이후에도 혈당이 지속적으로 감소하게 되면 또 다른 방어기제가 작용하게 된다. 대개 혈장 포도당이 60 mg/dL 이하로 감소하게 되면 성장호르몬이 분비되며, 코티솔의 분비 역시 증가하게 된다. 성장호르몬과 코티솔은 지방세포에서 지방분해를 촉진하고 간에서 케톤생성 및 포도당신생성을 촉진하여 다른 길항호르몬보다 긴 시간 작용하여 혈장 포도당을 회복시키는 작용을 한다[9].
위와 같이 다양한 호르몬 및 대사과정을 통하여 포도당 항상성이 유지되고 있음에도 불구하고 저혈당이 발생하는 경우는 기전 상으로 체내 인슐린의 양이 비정상적으로 높은 경우와 저혈당의 방어기전에 이상이 생기는 경우로 구분해 볼 수 있다. 고인슐린혈증에 의하여 저혈당이 발생하는 경우로 약제에 의해 발생하는 인위적 저혈당(factitious hypoglycemia)과 내인성 고인슐린혈증으로 분류할 수 있다. 인위적 저혈당은 약제에 의하여 발생하는 경우로 인슐린을 과량 투여하여 발생하는 경우와 설포닐유레아와 같은 인슐린 분비능을 촉진하는 약제에 의하여 발생할 수 있다. 내인성 고인슐린혈증은 체내 인슐린 분비가 비정상적으로 증가하면서 저혈당이 발생하고 대표적인 예로 insulinoma, noninsulinoma pancreatogenous hypoglycemia syndrome 그리고 post gastric bypass hypoglycemia (PGBH)가 있다. 저혈당의 방어기전에 이상이 생기는 경우는 부신기능저하증과 같이 저혈당 길항호르몬인 코티솔 생산 저하에 의한 저혈당이 대표적인 예이다.
저혈당의 평가
저혈당에 대한 원인 평가의 시작은 환자가 호소하는 증상이 저혈당으로 인한 것인지 확인하는 것이다. 저혈당 증상이 비특이적이기 때문에 환자가 호소하는 증상이 실제로 저혈당으로 인한 것인지, 진단 기준인 whipple’s triad를 만족하는지 확인해야 한다. 이후에는 환자의 기저 질환, 약물력, 신체 검진 그리고 저혈당을 평가하기 위한 혈액 검사 결과를 종합하여 평가해야 한다[10]. 약물력을 조사할 시에는 본인의 약물뿐만 아니라 보호자의 약물도 확인해야 하는데, 인지기능이 감소된 노인은 보호자의 당뇨병 약물을 복용하여 저혈당이 발생할 수 있기 때문이다. 그리고 스테로이드 경구 및 주사제제 투여 여부를 확인하여 장기간 스테로이드 투여로 인하여 내인성 스테로이드 분비능이 저하된 부신기능저하증 여부도 고려해야 한다. 이러한 환자병력 조사에도 진단이 불분명하다면 저 혈당 발생 당시 시행된 혈액 검사가 필요하다. 그러나 저혈당 환자 진료 시에는 이미 저혈당 상태에서 회복된 후 내원한 경우가 흔하기 때문에 72시간 금식 검사 및 75 g 당부하 검사를 시행하여 저혈당을 유발시키고, 저혈당 발생 시 시행된 혈장 검사를 통하여 진단에 도움을 얻을 수 있다.
72시간 금식 검사(72 hours fasting test)
72시간 금식 검사는 내인성 고인슐린혈증에서 공복저혈당 발생을 확인하기 위한 필수적인 검사이다. 72시간 금식 검사를 시행하는 이유는 크게 2가지이다. 첫 번째는 저혈당을 확인하고 그 당시의 증상 여부 및 호전 여부를 관찰하여 Whipple’s triad를 만족하는 것을 관찰하기 위함이고, 두 번째는 저혈당 당시 혈액 검사를 시행하여 부적절한 인슐린 반응이 있는지를 확인하기 위함이다. 일부 연구에서 48시간 금식 검사로 대체하자는 의견도 있는데, 이는 연구에서 분석한 인슐린종 환자에서 저혈당 발생 시간이 금식 시작 후 12시간 이내에서 48%, 24시간 이내에서 67%, 48시간 이내에서 95%가 발생하였기 때문이다[11]. 그러나 아직 충분한 금식 시간에 대한 명확한 결론은 없다.
검사 시작 전까지는 특별히 식이를 제한할 필요는 없으나 검사 시작 이후에는 물을 제외한 칼로리 포함한 음식은 금지해야 하며 필수적이지 않은 약물은 중단한다. 시작 시간은 정해져 있지 않으나 고인슐린혈증에 의한 저혈당이 강력히 의심되는 환자일 경우에는 오전 8-9시에 시작하는 것이 안전하다. 검사 시작 후에는 혈당측정기로 2시간마다 혈당 확인을 하고, 시작 시점 및 매 6시간마다 채혈하여 혈장 포도당, 인슐린, C-펩타이드, 전구인슐린(proinsulin)을 검사한다. 혈장 포도당이 60 mg/dL 이하로 감소되면 채혈 간격을 매시간 또는 2시간마다로 줄인다. 검사 종료 시점은 혈장 포도당이 45 mg/dL 이하로 감소되고 저혈당의 증상이 확인되는 경우 또는 72시간이 지났을 경우로 종료 시점에 혈장 포도당, 인슐린, C-펩타이드 전구인슐린, β-hydroxybutyrate 그리고 설포닐유레아 농도 검사를 시행 후 종료한다. 검사 종료 후에는 글루카곤 1 mg을 정주하고 10분, 20분, 30분 이후 혈장 포도당을 측정하고 경구로 포도당을 섭취하도록 한다.
저혈당 시점 당시 시행한 혈장 검사는 표 3을 참조하여 질환을 특정할 수 있다. 혈당이 55 mg/dL 이하로 감소될 때 시행된 혈장 검사 결과 C-펩타이드 > 0.6 ng/mL, 인슐린 > 3 μU/mL 그리고 전구인슐린 > 5 pmol/L인 경우 내인성 고인슐린혈증을 진단할 수 있다. β-hydroxybutyrate는 인슐린 부족한 경우에서 증가하기 때문에 고인슐린혈증에 의한 저혈당에서는 억제된다. Service와 O'Brien [12]은 72시간 금식 검사 시행 중 β-hydroxybutyrate가 2.7 mmol/L 이상이고 혈장 포도당이55 mg/dL 이하로 감소되지 않을 경우는 충분히 금식이 시행하 였다고 판단하고 검사를 중단하도록 제시하였다. 또한, Service [13]는 저혈당 발생 시 글루카곤 1 mg 투여 후 포도당이 25 mg/dL 이상 상승한 경우는 내인성 고인슐린혈증을 예측할 수 있는 지표로 제시하였다.
75 g 당부하검사(oral glucose tolerance test)와 혼합식 부하검사(mixed-meal tolerance test)
72시간 금식 검사가 공복저혈당을 평가하기 위한 검사라면 75 g 당부하검사 및 혼합식부하검사는 식후저혈당을 평가하기 위한 유발 검사이다. Gastric bypass 수술을 받거나 덤핑증후군 같은 식후저혈당이 발생하는 경우가 의심될 경우 유발 목적으로 시행할 수 있으며, 드물지만 인슐린종도 식후 저혈당이 발생하는 것으로 알려져 있다. 저혈당을 평가하기 위한 75 g 당부하검사는 당뇨병 진단 목적의 75 g 당부하검사와 시행 방법 및 목적이 다르다. 저혈당 진단 목적의 당부하검사는 지연성 저혈당 발생을 확인하기 위하여 시행되므로 75 g 포도당 섭취 후 2시간까지는 30분마다 채혈하고 이후 5시간 후까지는 1시간 간격으로 채혈한다. 채혈 시에는 포도당, 인슐린, C-펩타이드, 부신피질자극호르몬 그리고 코티솔을 측정한다. 혼합식부하검사는 환자가 저혈당이 발생한 당시 섭취한 식사영양성분을 기준으로 식사를 구성하여 섭취 후 채혈 검사를 시행하고, 채혈 간격은 75 g 당부하검사와 동일하다. 72시간 금식 검사와 마찬가지로 혈당이 55 mg/dL 이하로 감소될 때 시행된 혈장 검사 결과 C-펩타이드 > 0.6 ng/mL, 인슐린 > 3 μU/mL인 경우 내인성 고인슐린혈증을 진단할 수 있다.
당부하검사 시행 시 발생하는 식후저혈당은 180분에 발생하는 경우가 제일 흔하며 그 이후는 드물다. 중요한 점은 검사 중 저혈당 발생 시 증상이 발생하는지를 확인하는 것이 중요한데, 이는 일반인에서 당부하검사 시행 시에도 저혈당 범주에 속하는 혈당 수치가 나오는 경우가 있기 때문이다[14]. 이러한 이유로 당부하검사의 정상 참고치는 표준화되지 않았으며, 2011년 미국내분비학회의 저혈당질환 가이드라인에서는 저혈당 평가 위한 당부하검사는 권고하고 있지 않고 있으며, 대신하여 혼합식부하검사 시행을 권고하고 있다[15].
저혈당의 감별 진단
저혈당의 원인은 내인성 또는 외인성 요인에 따라 감별 질환이 달라지게 된다(Table 4). 주의할 점은 내인성 요인과 외인성 요인이 함께 작용하여 저혈당이 발생하는 경우도 흔하기 때문에 저혈당 진단을 위해서는 포괄적으로 접근해 나가야 한다. 외인성 요인의 경우 대부분 약제 복용력을 비롯한 환자 병력 청취를 통해 감별할 수 있다. 당뇨병 환자의 경우에는 복용하는 당뇨병 약물 성분을 확인하고 최근에 약물 변경하였는지 그리고 당화혈색소를 측정하여 평소 혈당 조절 정도가 어느 정도였는지 파악해야 한다. 당뇨병 환자는 주로 혈당강하제로 인하여 저혈당이 발생하는 경우가 대부분이다. 설포닐유레아 및 메글리티나이드와 같은 경구 당뇨병 약제는 췌장의 인슐린 분비를 증가시키기 때문에 다른 경구혈당강하제와 비교하여 저혈당의 위험도가 증가한다[16]. 인슐린은 당뇨병 약제 중 저혈당의 위험성이 제일 높은 약제로 인슐린을 사용하는 환자에서의 저혈당은 인슐린의 용량과 식사 및 운동의 불균형에 의하여 발생한다. 그 외에도 음주를 비롯하여 cibenzoline, quinolone, pentamidine, quinine, indomethacin과 같은 약제가 저혈당을 발생시킨다는 보고가 있어 이에 대한 약물 확인이 필요하다.
외인성 요인이 배제가 된다면 다음으로 내인성 요인에 대한 평가가 필요하다. 저혈당 발생 빈도를 확인하고 저혈당이 발생하는 시간이 식전 혹은 식후인지, 유발인자가 있는지, 복부 수술력 등을 포함한 자세한 병력 청취가 중요하다. 그리고 원인 평가를 위해서는 실제 저혈당이 발생하였을 당시 혈장 검사(ex. 포도당, C-펩타이드, 인슐린, 전구인슐린, β-hydroxybutyrate, 인슐린 자가항체)를 시행하여 내인성 고인슐린혈증 여부를 확인해야 한다[15]. 저혈당이 나타나지 않는다면 72시간 금식 검사 또는 75 g 당부하검사, 혼합식부하검사를 시행하여 저혈당을 유발시키는 방법이 추천된다. 저혈당 발생 시 시행된 혈장 검사 결과를 토대로 다음과 같이 감별 진단에 도움을 얻을 수 있다(Table 4).
외인인슐린(exogenous insulin)
외인인슐린(exogenous insulin) 투여에 의한 저혈당은 혈장 인슐린 수치는 높으나 C-펩타이드가 낮을 때 의심할 수 있다. 이는 외부에서 투여된 인슐린에 의해서 혈장 인슐린 수치는 증가하지만, 저혈당에 대한 반응으로 내인성 인슐린 생산은 저하되면서 C-펩타이드 수치는 감소된다.
경구혈당강하제(oral hypoglycemic agent)
설포닐유레아 및 메글리티나이드와 같은 경구 당뇨병 약제는 췌장에서 인슐린 분비를 증가시키기 때문에 다른 경구혈당강하제와 비교하여 저혈당의 위험도가 증가한다[16]. 혈장 검사는 내인성 인슐린 생산 증가에 의하여 C-펩타이드, 인슐린 수치가 증가하며, 복용 중인 자가약물을 확인하여 진단할 수 있다.
인슐린종(insulinoma), noninsulinoma pancreatogenous hypoglycemia syndrome (NIPHS), post gastric bypass hypoglycemia (PGBH)
내인성 고인슐린혈증에 의한 저혈당의 대표적인 원인 질환이다. 혈장 검사는 내인성 인슐린 생산 증가에 의하여 C-펩타이드, 인슐린 수치가 증가한다. 인슐린종은 내인성 고인슐린혈증의 대표적인 원인으로 공복저혈당이 특징적이지만 식후 저혈당으로 내원한 경우도 보고되었다[17,18]. 지름이 2 cm 미만인 경우가 대부분이며 인슐린종의 6%는 악성 종양으로 진단되고 8%에서 1형 다발 내분비샘 신생물과 관련 있는 것으로 보고된 바 있는데, 이와 같은 경우는 다발 종양으로 발생할 가능성이 높은 것으로 알려져 있다[19]. 복부 CT 및 MRI 그리고 위내시경 초음파를 시행하여 췌장의 종괴가 확인되고 선택적 동맥칼슘자극 검사를 통하여 인슐린 분비능이 증가되면 진단할 수 있다. NIPHS는 조직 소견 상 인슐린종이 감별되고 췌관 상피 세포로부터 분화된 췌도 세포의 증식을 특징적으로 하는 nesidioblastosis 소견이 관찰될 때로 정의한다[20]. 식후저 혈당이 특징적으로, 영상학적 검사에서 특이 소견이 없지만 선택적 동맥칼슘자극 검사를 시행하여 인슐린 분비능이 증가되어 있으며 특징적인 병리학적 소견으로 진단할 수 있다. 마지막으로 PGBH는 과거력 상 위 수술력이 있으면서 특징적으로 식후저혈당이 발생하면 진단할 수 있다. 기전적으로 명확하게 밝혀지지 않았으나 수술 이후 신체 인슐린저항성은 개선되나 상대적 췌장 베타세포의 증식에 의한 고인슐린혈증으로 저혈당이 발생하는 것으로 알려져 있다[21,22]. 75 g 경구 당부하검사 또는 혼합식부하검사를 시행하여 5시간 동안 혈당을 추적 관찰하여 식후저혈당을 확인하여 진단할 수 있다.
인슐린자기면역증후군(insulin autoimmune syndrome)
인슐린자기면역증후군은 외인성 인슐린의 투여가 없었던 환자에서 인슐린의 자가항체에 의한 내인성 고인슐린혈증에 의하여 저혈당이 발생한 경우로 정의한다. 60-70대 남녀에서 주로 발생하며 공복저혈당 및 식후저혈당 모두 발생할 수 있다. 발생 원인은 명확하게 밝혀져 있지 않으나 바이러스 감염과 같은 자극이 초항원(superantigen)으로 작용하거나 분자구조 상 sulfhydryl기를 가진 약제를 복용하고 4-6주 후에 주로 발생하는 것으로 보고된 바 있으며, 루푸스나 류마티스 관절염과 같은 자가면역증후군과도 연관이 있는 것으로 알려져 있다[23]. 혈장 C-펩타이드 및 인슐린 상승이 다른 감별 질환과 비교하여 높으며(insulin > 1,000 μU/mL), 인슐린 자가항체 양성으로 진단할 수 있으나, 이미 인슐린에 노출된 과거력이 있는 환자에서는 질환과 상관없이 인슐린 자가항체 양성 소견이 나올 수 있으므로 전반적인 임상 양상을 종합하여 진단해야 한다[24]. 임상 경과는 양호하여 환자의 80%에서 3개월 이내 자연적으로 호전을 보이는 것으로 알려져 있다.
인슐린유사성장인자(insulin-like growth factor, IGF) 과다 분비
비소도세포암(non-islet cell tumor)에 의한 저혈당은 드물게 발생하며, 종양에서 불완전한 인슐린유사성장인자가 과다 분비되어 인슐린 수용체에 결합하여 발생한다[25]. 주로 횡문근육종, 혈관주위세포종양, 섬유육종과 같은 중간엽종양에서 발생하는 것으로 알려져 있다. 혈중 인슐린유사성장 인자-2와 인슐린유사성장인자-1 수치의 비율의 증가되어 있으며, 저혈당의 의한 음성 되먹이기 기전에 의하여 혈중 인슐린, C-펩타이드가 감소되어 있는 소견으로 진단에 도움을 주는 것으로 알려져 있으며, 대부분의 종양이 크기가 커서 복부 및 CT로 쉽게 진단할 수 있다.
비인슐린 매개 저혈당(non-insulin mediated hypoglycemia)
인슐린과 관련없이 발생하는 저혈당으로 패혈증을 비롯한 중증 급성 질환이나, 만성 장기부전(간, 신장, 심장), 부신기능저하증을 예로 들 수 있다. 간 내 글리코겐 합성 장애에 의하여 간 내 포도당 생성은 감소되고 상대적인 말초 포도당 이용 증가에 의하여 저혈당이 발생하는 것으로 알려져 있다. 저혈당 시 측정한 혈중 인슐린, C-펩타이드는 감소되어 있을 때 의심할 수 있다. 부신기능저하증이 의심되는 경우 아침 8시 혈장 코티솔을 검사하거나 급속 부신피질자극호르몬 자극 검사를 시행한다[26]. 아침 8시경 시행한 혈장 코티솔이 3 μg/dL 이하로 확인되면 부신기능저하증을 강력히 시사하며 3-18 μg/dL로 확인되는 경우에는 급속 부신피질자극호르몬 자극 검사를 시행한다. 급속 부신피질자극호르몬 자극 검사는 합성 부신피질자극호르몬제인 tetracosactrin 250 μg을 정맥에 주사하고 0, 30, 60분에 혈장 코티솔 농도를 측정하여 최대치가 18 μg/dL (550 nmol/L) 이하인 경우 부신기능저하증을 진단할 수 있다.
저혈당의 임상적 영향
저혈당의 영향은 단기적 및 장기적 관점으로 나누어서 구분해 볼 수 있다. 단기적으로 저혈당이 발생할 경우 어지럼증과 두통과 같은 신경학적 증상이 발생하게 되고 심할 경우 경련 및 의식 소실을 초래할 수 있다. 이러한 증상이 위험한 작업 중이나 운전 중에 발생하면 2차 사고로 이어질 가능성이 있어 주의가 필요하다. 또한 중증 저혈당의 발생이 심장 돌연사와 관련된다는 사례보고가 된 바 있으며 그 기전으로 급성 심근경색이 발생하거나 급성 심장 부정맥에 의한 돌연사 가능성이 언급된 바 있으나 혈당과 심전도를 같이 추적 관찰하는 것은 현실적으로 어렵기 때문에 정확한 인과관계 확인에는 어려움이 있다[27].
장기적인 관점에서 저혈당은 인지기능을 저하시킬 수 있다[28]. 저혈당은 뇌의 중요한 연료이다. 포도당 공급에 문제가 생기게 되면 일시적인 뇌기능의 정지되고 저혈당이 회복되지 않고 지속될 경우 신경세포 손상을 통해 영구적인 후유증을 발생할 수 있다. 그리고 저혈당은 혈소판 응집 및 피브리노겐 형성에 관여하여 뇌 혈관 장애를 일으켜 인지기능 장애를 유발한다[29]. Whitmer 등[30]은 성인기에 저혈당의 횟수가 많아질수록 치매 위험도를 높인다고 제시하였다. 다른 치매의 위험인자를 보정한 이후에도 저혈당이 한 번 있었던 경우는 26%, 두 번 있었던 경우는 80%, 세 번 이상 있었던 경우는 94% 치매 발생 위험도가 증가하였다.
저혈당의 치료
저혈당의 치료 목적은 신속한 혈당 상승을 통하여 저혈당의 증상을 호전시켜 의식저하 및 이로 인한 낙상을 예방하고 장기적으로 저혈당의 합병증인 심혈관 질환 및 뇌기능 저하를 예방하는 데 있다. 자가혈당 측정, 식이 교육 그리고 저혈당 인지에 대한 환자 교육을 통하여 재발을 방지할 수 있다. 그리고 저혈당 원인이 불명확한 경우에 저혈당 치료 시 제일 중요한 점은 포도당 투여 전 원인평가를 위한 적절한 혈액 검사를 시행해야 한다는 것이다.
저혈당 발생 시에는 환자의 의식상태를 확인해야 한다. 환자의 의식상태가 경구로 탄수화물을 섭취가 가능하다면 적절한 포도당 섭취로 호전될 수 있으나 의식을 잃어 경구 투여가 불가능할 경우에는 즉시 응급실로 내원하여 포도당 정맥 주사가 필요하다. 당뇨병 환자에서는 저혈당 교정 시 투여되는 포도당에 의한 반동성 고혈당을 피하고 체중증가를 예방하기 위해서는 적절한 용량의 포도당의 투여가 필요하다. 일반적으로 15-20 g의 단순당을 추천하고 사탕 3-4개, 오렌지 주스, 콜라 반 컵, 설탕 또는 꿀 1스푼을 추천한다[10]. 포도당 투여 15분 이후 혈당을 다시 측정하여 반응이 없거나, 부족한 경우 반복적으로 15 g의 탄수화물을 복용한다. 초콜릿, 우유 그리고 지방을 함유하는 음식은 흡수가 늦어 저혈당의 초기 치료에는 적합하지 않다.
중증 저혈당으로 경구 섭취가 불가능할 경우 응급처치로 글루카곤 주사를 사용할 수 있고, 성인은 1 mg, 소아는 0.5 mg, 유아는 0.25 mg 피하주사 또는 근육주사 시행한다. 글루카곤 투여 1시간 반 이후에는 다시 혈당이 감소하므로, 의식이 회복되면 바로 단당류를 섭취해야 한다. 의식저하 상태에서 글루카곤 주사가 없다면 응급실로 내원하여 정맥 내로 50% 포도당 수액 50 mL를 투여해야 한다. 주사 이후에 의식이 회복된다면 바로 단당류를 섭취하여 다시 저혈당이 발생하지 않도록 해야 한다.
결 론
저혈당은 당뇨병 환자에서 주로 발생하지만 드물게 당뇨병이 없는 환자에서도 발생할 수 있다. 단기적으로는 의식 소실을 일으킬 수 있고 장기적으로 인지능력 저하 및 심혈관 질환의 위험도를 증가시켜 사망률을 높일 수 있기 때문에 저혈당에 대한 원인 평가 및 치료가 중요하다. 저혈당의 원인을 감별하기 위해서는 환자의 자세한 병력 청취가 중요하고 실제 저혈당이 일어나는지 Whipple’s triad 확인하고 저혈당 발생 당시 적절한 혈액 검사를 시행하여 감별 진단에 도움을 줄 수 있다. 그리고 저혈당 발생을 확인하기 위하여 공복저혈당인 경우는 72시간 금식 검사, 식후저혈당인 경우는 75 g 당부하검사 또는 혼합식부하검사를 통하여 진단에 도움을 얻을 수 있다.