마이크로바이옴과 암 면역 치료
Microbiome and Cancer Immunotherapy
Article information
Trans Abstract
Immune checkpoint inhibitors (ICIs) have achieved promising clinical results in cancer treatment over the past decade. However, the efficacy of ICIs is less than 30% in most tumor types, and studies are underway to identify the predictive factors responsive to ICIs. More than 1,000 species of microorganisms live in the human body, and the second human genome project, The Human Microbiome Project, has been conducted to understand human diseases through interactions with microbes. As the microbiome project has progressed, many studies have reported on the association between microorganisms and human diseases, including preclinical and clinical studies on the relationship between ICIs and the microbiome. Therefore, in this manuscript, the relationship between the microbiome and cancer, especially the effectiveness of ICIs, is reviewed.
서 론
면역관문억제제(immune check point inhibitor)는 최근 10년 동안 다양한 암종에서 획기적인 암 치료법으로 자리잡고 있다[1]. 하지만, 면역관문억제제에 효과적인 반응을 보이는 환자는 암종별로 다르며, 그 효과도 30% 미만으로 나타나기 때문에, 면역관문억제제 반응에 관계 있는 인자에 대한 연구들이 진행 중이다[2]. 우리 몸에 살고 있는 미생물은 1,000종 이상 존재하는데, 인체와 미생물 간의 상호 작용을 통해 인간의 질병을 이해하고자 이차 인간 게놈 프로젝트인 인간 마이크로바이옴 프로젝트(The Human Microbiome Project)도 진행되었다[3]. 마이크로바이옴 프로젝트가 발표되고, 미생물과 인간 질병과의 상관관계에 대한 연구들이 진행되었고, 그 중에서도 면역관문억제제와 마이크로바이옴과의 연관 관계에 대한 전임상 및 임상 연구 결과들이 발표되었다[4]. 본고에서는 마이크로바이옴과 암과의 관계, 특히 면역관문억제제의 효과와의 관계에 대해 살펴보고자 한다.
본 론
면역관문억제제
암면역 치료는 1893년 William Coley가 육종(sarcoma) 환자에게 사멸시킨 세균을 투여하고 종양이 감소된 결과를 보고한 것을 암면역 치료의 시작으로 보고 있다[5]. 면역학에 대한 분자생물학적 발전으로 암의 면역 회피기전이 알려지게 되었고, 그중 cytotoxic T-lymphocyte-associated antigen-4 (CTLA-4) 와 programed cell death protein 1 (PD-1)/PD-ligand 1 (PD-L1)에 대한 발견은 면역관문억제제 개발로 이어져 암치료의 새로운 장을 열게 되었다[6]. 하지만, 면역관문억제제의 전반적인 반응은 30% 정도에 불과하고[7], 면역 치료 관련 이상반응이 심각하게 발생할 수 있어, 부작용 및 비용을 고려해 볼 때, 면역관문억제제에 효과 있는 환자를 선별함이 필요하다[8]. 현재까지 PD-1/PD-L1 억제제의 효과와 관련된 인자로는 암조직세포의 PD-L1 발현 정도, microsatellite instability와 tumor mutation burden 등이 보고되었다[9-13].
마이크로바이옴과 암의 발생
우리 몸에 존재하는 미생물 집합체를 인간 마이크로바이옴(human microbiome)이라 명명하며, 우리 몸에는 1014개의 미생물이 존재하며, 95%는 대부분 장을 포함한 소화기관에 있고, 호흡기, 생식기, 구강 및 피부 등에도 분포한다[14]. 장내 미생물의 변화는 암을 포함하여, 자가면역 질환, 염증성장질환 등 다양한 질병과 관련성이 보고되고 있다[15]. 암을 유발하는 미생물로는 Salmonella typhi [16]가 담도암 발생에, Helicobacter pylori가 위암 발생[17]에 연관되는 것으로 보고 되었다. 미생물이 암을 유발하는 기전으로는 대부분 만성 염증반응에 의해 이차적으로 발생하는 것으로 여겨지나, 특징적으로 Helicobacter pylori는 위암뿐만 아니라 mucosa-associated lymphoid tissue (MALTOMA) 발생과도 연관되기 때문에 국제보건기구(World Health Organization, WHO)에서는 type 1 carcinogen으로 분류하고 있다[17].
항생제 사용에 의한 장내 미생물의 변화(gut dysbiosis)가 암의 발생에 영향을 미친다는 연구들이 발표되었고, 그중에서 대장암과의 관련성이 많이 보고되었다[18]. 선종(adenoma)이나 대장암 주변에서 관찰된 미생물은 그 주변의 정상 점막에서 미생물과 차이가 나는 것이 보고되었는데, 특징적으로 대장암이 발생한 조직에서는 Clostridium과 Bacteroides genera가 줄어들어 있고, 반대로 Fusobacterium spp., 그중에서도 F. nucleatum가 풍부하였다[19]. 간세포암의 발생에서도 미생물과의 연관성이 보고되었는데, Helicobacter 균주가 간세포암 조직 내에서 발견되었으며[20,21], 장내 미생물의 경우에도 간세포함 환자의 분변에서 간세포암이 없는 환자에 비해 E. coli가 더 많이 형성되어 있음이 관찰되었다[22]. 이러한 장내 미생물의 변화는 간에서 담즙 생성 과정을 변화시킴으로써 DNA의 손상을 일으키고 간독성과 종양을 일으키는 것으로 제시되었다[23]. 폐암에서는 기관지 폐포 세척액(bronchoalveolar lavage, BAL)을 통한 연구가 진행되었다. 폐 병변(lung lesion)이 있는 환자들에게 BAL을 시행하고 이후 양성 종양과 악성 종양을 나누어 분석한 결과, 악성 종양 환자에서 시행한 BAL 검사에서 양성 환자에 비해 유의미하게 Veillonella와 Megasphaera genera가 많이 관찰되었다[24]. 또한 폐암 조직에서는 정상 조직에 비해 Thermus genus가 더 많이 발견되었고, 진행된 병기에서 더 많이 발견되었다[25].
장내 미생물과 면역관문억제제 반응과의 상관 관계
장내 미생물과 암의 발생과의 관계뿐만 아니라, 최근의 연구에 따르면 장내 미생물이 면역관문억제제의 반응에 중요한 역할을 하는 것으로 보고되었다[26,27]. Sivan 등[26]은 2015년 Science지에 흥미로운 논문을 발표하였다. 마우스 흑색종 세포주인 B16.SIY를 이용하여 마우스 실험을 위해 Jackson laboratory (JAX)와 Taconic farms (TAC)에서 유전적으로 같은 C57BL/6 마우스를 구매하여 실험하였는데, JAX에서 구매한 마우스의 흑색종 종양은 TAC에서 구매한 마우스의 흑색종 종양보다 종양 성장 속도가 유의미하게 느리게 진행함을 확인하였으며, 이런 차이는 두 회사 마우스의 장내 미생물이 달라 발생한 것이라고 제안하였다. 놀랍게도, JAX 마우스의 분변을 TAC 마우스에 투여하였더니 JAX 마우스와 유사하게 종양 성장이 감소되었고, 종양 조직에서 CD 8+T세포가 증가됨이 관찰되었다. 더욱 더 놀라운 것은 TAC 마우스에 JAX 마우스의 분변을 투여한 뒤, B16 종양 모델을 만들고, PD-L1 억제제로 치료한 결과, JAX 마우스의 분변을 투여하지 않은 마우스에 비해 PD-L1에 의한 종양 억제 효과가 증가되었고, 이는 장내 미생물이 T세포 반응을 항진시키는 것으로 제시되었다. 장내 미생물 중에서 항 종양 면역 반응을 일으키는 미생물을 구분하기 위해 16S ribosomal RNA 시퀀싱을 통해 분석한 결과, Bifidobacterium spp.이 면역 반응과 연관성이 높은 균주로 확인되었다. 이를 바탕으로 PD-L1 억제제와 Bifidobacterium을 병용투여한 경우에는 PD-L1 억제제 단독 또는 Bifidobacterium 단독으로 치료한 군에 비해 유의미한 종양 억제 효과를 보여 Bifidobacterium이 PD-1 억제제의 효과를 향상시킴을 입증하였다.
본 연구가 발표된 이후 Gopalakrishnan 등[28]은 PD-1 억제제를 사용한 흑색종 환자들의 장내 미생물을 분석하여 그 결과를 발표하였다. PD-1 억제제에 반응을 보인 환자들은 반응을 보이지 않은 환자들에 비해 장내 미생물이 다양한 것으로 분석되었고, 특별히 Fecalibacterium이 풍부한 환자에서는 생존 기간이 연장되었으며, 반대로 Bacteriodales가 많은 환자의 경우 생존율이 감소되었다. 뿐만 아니라, PD-1 억제제에 반응을 보인 환자와 반응을 보이지 않은 환자의 분변을 Germ free 마우스에 분변을 이식한 뒤(fecal material transplantation, FMT) 흑색종 마우스 모델을 만든 후 PD-L1 억제제로 치료한 결과, 반응군 환자의 분변을 이식받은 마우스에서 항종양 효과가 유의미하게 증가하였고, 종양 내 CD8 T세포의 수도 증가됨이 확인되어, 장내 미생물이 PD-1 억제제가 효과에 영향을 미침을 사람의 분변을 통한 연구에서도 보고 하였다.
암 치료를 위한 분변 이식 치료
건강 자원자의 FMT는 2000년도부터 재발성 Clostridium difficile (C. difficile) 장염 환자를 대상으로 연구되었고, 2013년에 전향적, 무작위 배정, 임상 연구가 발표되었다. 본 연구는 1번 이상 C. difficile 감염이 재발된 환자들 대상으로 FMT군, Vancomycin 단독군, Vancomycin과 장세척(bowel lavage)군, 세 군으로 나누어 군당 38명 등록을 목표로 진행되었다[29]. 하지만, 본 연구는 43명이 3군에 배정된 뒤 중간 분석에서 FMT군에서 효과가 월등하게 나타나 조기 중단되었다. FMT를 투여 받은 16명 중 13명(81%)에서 1차 FMT에서 완치되었으며, 나머지 3명 중 2명은 다른 대상자의 2차 FMT 후 완치된 반면, vancomycin 단독군에서 13명 중 4명(31%)에서, vancomycin과 장세척군에서는 13명 중 3명(23%)에서만 완치되었다. 본 연구를 바탕으로, 현재는 재발성 C. difficile 감염의 치료로 FMT가 표준 치료로 사용되고 있다.
마이크로바이옴과 면역관문억제제 효과와 상관관계가 있는 전임상 연구 및 후향적 임상 결과들이 축적되면서, 흑색종 환자를 대상으로 전향적으로 FMT 병용 치료가 시도되었다. Baruch 등[30]은 이전 PD-1 억제제 치료 후 질병이 진행된 흑색종 환자 10명을 대상으로 FMT와 PD-1 억제제를 재투여하는 1상연구를 발표하였다(NCT03353402). FMT 공여자는 PD-1 억제제로 투여 받고 1년 이상 완치가 유지된 흑색종 환자 2명에서 공여를 받아 진행되었고, 공여자 1에서 FMT를 받은 5명 중에서 2명에서 부분 반응이 나타났고, 1명에서는 완전반응을 보여(공여자 2에서 FMT를 받은 5명 중 반응자는 없었음) 30%의 반응률을 보였다. 또한 흥미롭게도 완전반응을 보인 환자의 종양에서 CD8 + T세포가 증가됨이 관찰되었다.
유사한 연구로 Davar 등[31]은 이전 PD-1 억제제에 반응을 보이지 않은 환자(primary refractory) 16명의 흑색종 환자를 대상으로 FMT와 PD-1 억제제 투여한 전향적 임상 연구를 발표하였다(NCT03341143). FMT 공여자는, 3명은 PD-1 억제제에서 완전 반응을 보인 환자에서, 4명은 장기 부분 반응(partial response, median PFS = 56개월[range 45-71 months])을 보인 환자, 총 7명의 FMT가 16명에게 투여되었다. 16명 중 15명에서 반응평가가 이루어졌고, 3명에서 부분 반응(20%), 3명에서는 안정병변(stable disease)을 보였는데, 효과가 12개월 유지되었다. 반응과 관련 높은 장내미생물은 Firmicutes와 Actinobacteria였고, 반대로 Bacteriodetes는 반응억제와 관계가 있는 것으로 분석되었다. 또한, 순환 면역세포(circulating immune cell) 및 종양 침투 면역 세포(tumor infiltrating immune cell) 분석(single cell analysis)에서 FMT와 PD-1 억제제는 종양미세환경(microenvironment)에서 myeloid-induced immunosuppression은 감소시키고, CD8+ T세포를 증가시키는 것으로 분석되었다. 또한, 혈액을 이용한 multiomics 분석에서 반응군과 비반응군에서 metabolomic profile이 다른 것으로 분석되었다.
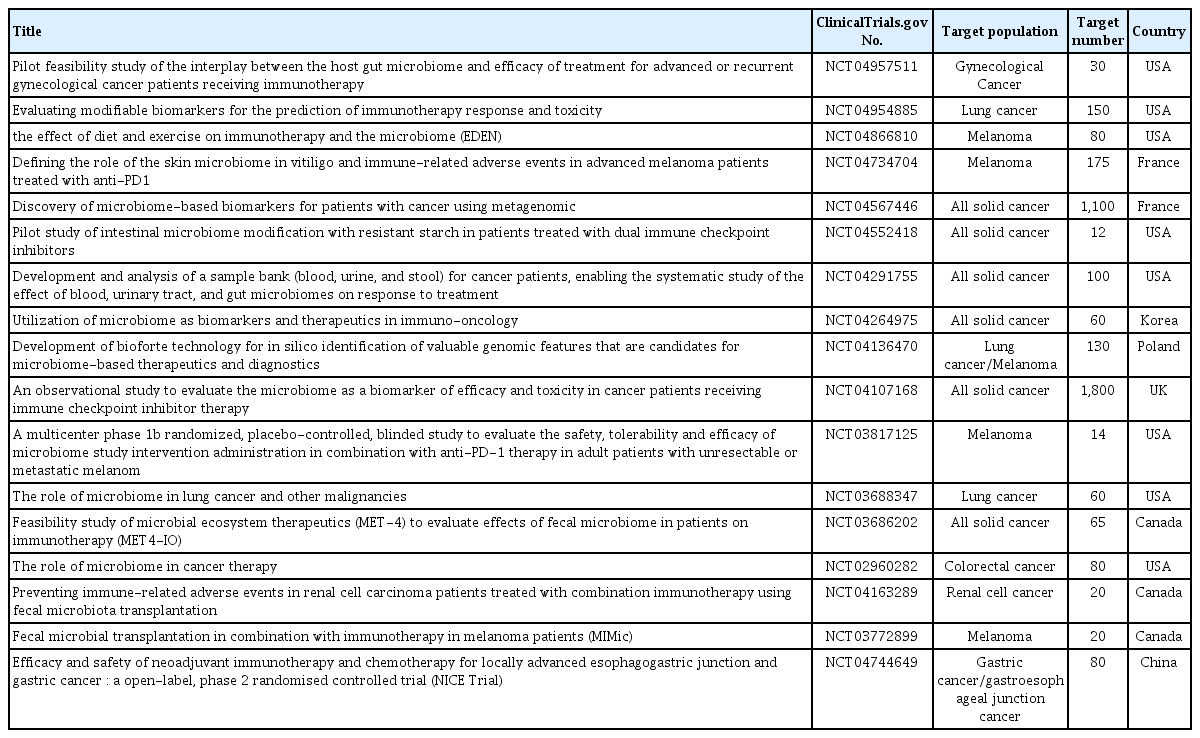
두 개의 소규모 전향적 연구를 통해 이전에 PD-1 억제제에 내성을 보인 흑색종 환자를 대상으로 PD-1 억제제 저항극복방법으로 FMT가 사용될 수 있는 가능성을 제시하였다고 할 수 있으나, 재발성 C. difficile 감염의 치료처럼 FMT가 표준 치료로 사용되기 위해서는 대규모 전향 연구가 필요하다. 현재 진행 중인 마이크로바이옴과 면역관문억제제 효능과 상관관계를 보는 전향적 임상 연구 결과가 축적된다면 면역 치료제의 효능을 극대화시키게 될 것이다(Table 1).
결 론
면역학의 발전으로 면역관문억제제가 개발되어 암 치료의 새로운 시대를 열었다. 하지만, 면역관문억제제에 대한 효과는 일반적으로 30% 미만에서 나타나 면역관문억제제의 치료 효과를 증진하고자 많은 연구가 진행되고 있다. 그중에서 장내미생물이 면연관문억제제 효과와 관계된다는 연구 결과들이 보고되었다. 면역관문억제제에 반응군과 비반응군에서 마이크로바이옴이 달랐으며, 면역관문억제제에 효과있는 환자의 분변을 마우스 및 면역관문억제제에 저항성을 보인 흑색종 환자에게 이식하였을 경우 면역 반응이 증진되면서 면역관문억제제의 저항성이 극복됨이 관찰되었다. 현재 마이크로바이옴과 면역관문억제제를 병용하는 임상 연구들이 진행 중으로, 면역관문억제제의 효능은 극대화하고 부작용을 최소화하는 결과가 기대된다[4].