곤봉지를 동반한 간폐증후군 1예
Hepatopulmonary Syndrome with Finger Clubbing
Article information
Abstract
간폐증후군은 폐내 혈관 확장으로 발생하는 간경변의 합병증 중의 하나로 동맥혈 산소 포화도 저하를 유발한다. 호흡곤란이 환자가 호소하는 가장 흔한 증상이며 입위 시 악화 소견을 보인다. 신체 검사에서 곤봉지와 청색증이 발견되기도 하며 유일하게 간이식이 현재까지는 가장 효과적인 치료법으로 알려져 있다. 본 증례에서는 호흡곤란을 호소하는 간경변 환자에서 곤봉지를 동반한 간폐증후군을 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Hepatopulmonary syndrome is a rare lung complication of liver cirrhosis, caused by pulmonary microvascular vasodilation that induces abnormal arterial oxygenation. Typical findings on physical examination are finger clubbing and cyanosis. Dyspnea is a common symptom and is worse in the upright position. Contrast echocardiography is a useful diagnostic test. Currently, the only effective treatment is liver transplantation. We report the case of a woman with cirrhosis who has hepatopulmonary syndrome with finger clubbing, confirmed by contrast echocardiography. The patient is waiting for a liver transplant.
서 론
간경변증 환자에게서 발생하는 여러 합병증 중 폐기능과 관련하여 호흡곤란을 일으키는 경우는 간성 흉수(hepatic hydrothorax), 문맥성 폐동맥 고혈압(portopulmonary hypertention), 간폐증후군(hepatopulmonary syndrome)이 대표적이다. 이 중 간폐증후군은 만성 간질환으로 인한 폐내 혈관 확장으로 동맥혈 산소 포화도 저하를 보이는 질환으로 간질환의 특별한 병인이나 간기능 저하 정도와는 크게 관계없는 것으로 알려져 있다[1]. 유병률은 만성 바이러스 간염의 경우 10%, 간경변에서는 15-23%, 버드-키아리 증후군에서는 28% 정도로 발병한다[2].
만성 간질환을 앓고 있는 환자에게서 낮지 않은 유병률을 보이고 있으나, 여러 가지 다른 원인으로 인한 호흡곤란 및 동맥혈 산소포화도 저하를 유발하는 경우와 감별하기가 쉽지 않다. 저자들은 위정맥 출혈을 주소로 내원한 간경변 환자에서 성공적인 지혈술 후에도 지속되는 호흡곤란과 저산소 혈증의 원인을 찾던 중 발견한 곤봉지를 동반한 간폐증후군의 증례를 경험하였기에 문헌고찰과 함께 보고하고자 한다.
증 례
55세 여자 환자로 알콜성 간경변 이외에 특이 과거력은 없었으며, 외래 치료 중 내원 2일 전부터 발생한 토혈과 혈변으로 응급실로 내원하였다. 내원 당시 활력징후는 혈압 85/60 mmHg, 맥박 74회/분, 호흡수 18회/분, 체온 36.6℃였다. 소주 1-2병씩 주당 4-5회 정도 10년간 알코올을 섭취하였으며, 내원 시에는 약 6년간 금주 중이었고 흡연은 하지 않았다.
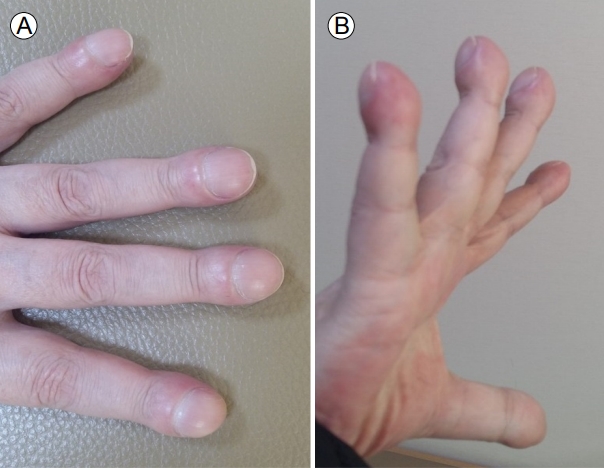
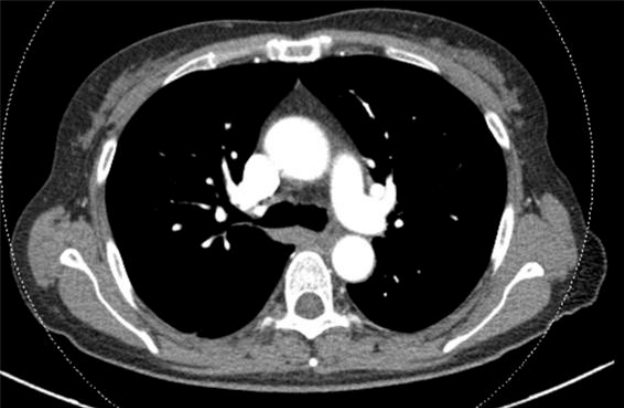
급성 병색을 보였으며 공막황달은 없었으나 결막은 창백하였고 입술에 청색증이 있었다. 흉부 진찰에서 심음 및 호흡음은 정상이었다. 복부 진찰에서 장음은 정상이었으며, 압통, 반동압통이나 복막 자극 증상은 없었고 만져지는 장기는 없었다. 사지 검사에서 곤봉지(Fig. 1)와 청색증 소견이 있었다. 혈액 검사는 Hb 9.7 g/dL, WBC 5,310/mm3, Platelet 133,000/mm3였고, AST 18 IU/L, ALT 13 IU/L, 총빌리루빈 1.14 mg/dL, 알부민 3.1 g/dL, ALP 77 IU/L, GGT 17 IU/L, 프로트롬빈 시간 14.5초, 혈액요소질소 50.1 mg/dL, 크레아티닌 0.81 mg/dL, Na 137 mEq/L였다. 바이러스 표지자는 HBsAg 음성, HBsAb 양성, anti-HCV 음성이었다. 응급 내시경을 시행하여 위 분문부 정맥류 출혈 진단 하에 지혈술(endoscopic variceal obturation)을 시행하였다. 지혈술 후 시행한 가슴 방사선촬영상 특이 소견은 없었으며 히스토아크릴(B.Braun, Rubi, Spain)과 혼합한 리피오돌이 출혈한 위정맥류에 잘 침착되어 있었다. 경과 관찰 중 추가 출혈은 확인되지 않았지만 호흡곤란을 호소하고 대기 중 맥박 산소 측정법에서 산소 포화도가 83%로 저하되어 있었다. 이어 시행한 동맥혈액가스 검사는 pH 7.43, 동맥혈산소분압(PaO2) 44.8 mmHg, 탄산가스분압(PCO2) 19.3 mmHg였으며, 폐포동맥간 산소 분압차(alveolar-arterial oxygen gradient: P[A-a]O2)는 75.35 mmHg로 증가되어 있었다. 호흡곤란과 저산소증의 원인을 찾기 위해 컴퓨터 단층 폐동맥 조영술을 시행하였으며 폐동맥 색전증은 없었고(Fig. 2), 흉수를 비롯한 저산소혈증을 유발할 만한 폐병변도 없었다. 폐기능 검사에서도 FEV1/FVC 78%, FVC (3.10 L) 98%, FEV1 (2.43 L) 95%로 제한성 또는 폐쇄성 환기 장애는 없었으나, 일산화탄소 확산능은 43%로 감소되어 있어 폐관류 이상을 보이는 환기-혈류 불일치(V/Q mismatch) 또는 단락(shunt)을 의심할 수 있었다. 심장 질환으로 인한 호흡곤란을 감별할 필요가 있어 심초음파를 시행하였으나 좌심실 구혈률 65%, 좌심실 이완기능 장애(E/E') 8로 심부전은 없었다. 복부 컴퓨터단층촬영에서는 간경변과 비장종대 소견이 보이나 측부 순환혈관, 복수 등은 관찰되지 않았다.
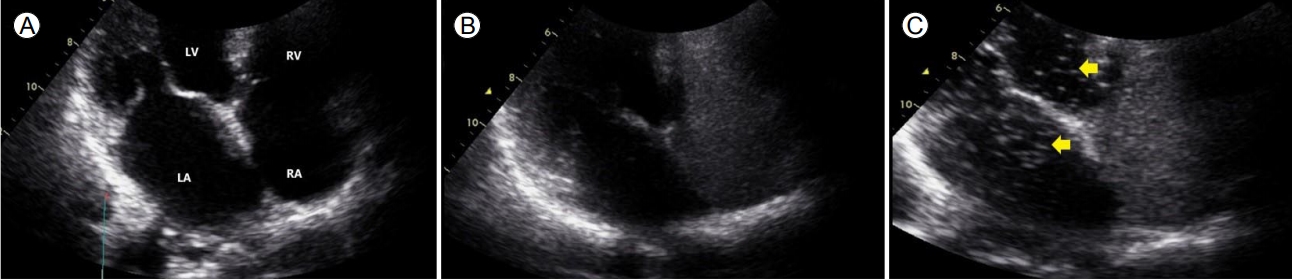
흉부 촬영상 폐는 정상이고 심장초음파 검사상 심장 기능은 정상이나 낮은 동맥 산소분압으로 간폐증후군 감별이 필요하였다. 맥박 산소 측정법을 이용하여 비강 캐뉼라(nasal prong)로 산소 4 L/min 주입 시에 산소포화도는 94-95%, 일어서서 1분 경과 후 86-87%까지 떨어졌고, 다시 누워서 1분 경과 후 92% 이상으로 회복하여 편평호흡(platypnea)과 직립성 저산소혈증(orthodeoxia)을 보였다. Technetium-99m-labeled macro-aggregated albumin (99mTc-MAA)을 주사한 폐관류 영상 검사에서 신장과 비장으로 방사선 추적자가 검출되어 간폐증후군으로 인한 우-좌 단락 의심 소견이 보였다(Fig. 3). 확진을 위해 시행한 조영증강 심초음파(contrast echocardiography)에서 조영증강제 주입 후 우심방에 보였던 조영제가 4번의 심전도 주기가 지나서 좌심방에서 관찰되어 간폐증후군으로 확진하였다(Fig. 4). 환자는 산소 치료 유지가 필요하여 이동형 산소 발생기를 처방하여 외래 추적 관찰을 시작하였고 아울러 근본적인 치료를 위해 간이식을 권유하였다.
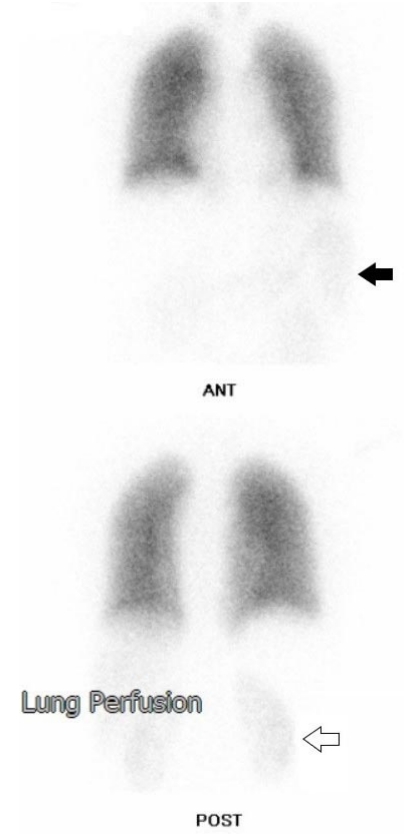
Lung perfusion scan with technetium-99m-labeled macro-aggregated albumin. The scan shows radiotracer activity in the spleen (black arrow) and kidney (hollow arrow).
고 찰
간폐증후군은 폐내혈관 확장으로 인한 우좌단락의 형성으로, 동맥혈 산소포화도 저하를 특징으로 하며 간질환을 가진 환자에서 문맥고혈압 또는 선천적 문맥단락을 보이는 경우 발현할 수 있다[3]. 만성 간질환 환자에서 유병률은 진단 기준과 방법에 따라 연구 결과마다 차이가 있으나 4-47% 정도로 알려져 있다[4].
임상적인 증상으로는 호흡곤란이 가장 흔한데, 특징적으로 편평호흡을 보인다. 따라서 간폐증후군을 진단받은 환자들은 누워 있을 시에 더 편안함을 느끼고 앉거나 서있을 경우 호흡곤란을 호소하는 경우가 많다. 이는 폐내 혈관들이 폐의 기저부에 우세하게 분포하여 입위 시에 중력에 의해 아래로 집중되었던 혈액이 앙와위 시 폐기저부부터 폐첨부까지 재분배가 됨으로써 혈액 내 산소 교환의 효율성이 높아지기 때문이다[4]. 그러나 모든 간폐증후군 환자에서 발견되는 것은 아니며, 운동 시 나타날 확률이 높고 서서히 진행하는 특징을 보인다. 이밖에 간질환을 가진 환자가 곤봉지나 청색증 등이 확인된다면 간폐증후군을 의심해 볼 수 있다[5]. 본 증례에서도 입술에 청색증과 양쪽 손에 저명한 곤봉지 소견을 보였다.
간폐증후군의 병태생리학적 원인으로는 폐동맥 순환에 있어 발생하는 폐내 혈관확장을 꼽을 수 있다. 정상적인 폐내 모세혈관의 직경 크기는 8-15 μm 정도이나 간폐증후군으로 진단받은 환자들은 15-100 μm의 확장을 보이기도 한다[6]. 폐모세혈관 확장으로 인해 산소교환의 저하로 혈액 내 산소포화도가 유지되지 않는 단락과 환기-혈류 불일치가 보인다. 직립 자세에서는 이러한 단락과 환기-혈류 불균형이 심해지며 결과적으로 호흡곤란이 심화되고, 누운 자세에서는 단락과 환기-혈류 불균형이 완화되어 호흡곤란이 호전된다.
폐내 혈관의 확장은 산화질소(NO) 증가로 인한 혈관 확장이 주 원인으로 알려져 있다. 간질환과 문맥압 항진으로 인해 endothelin (ET)-1의 분비가 증가하게 되고, 이로 인해 endothelial nitric oxide synthase와 inducible nitric oxide synthase (iNOS)의 분비 또한 촉진되어 NO가 증가하게 된다[7]. 이외에도 세균 전위와 내독소혈증이 발생하여 혈관내 대식세포와 단핵구의 활동이 증가되며, tumor necorsis factor-alpha (TNF-ɑ)를 포함하는 염증 사이토카인의 분비가 늘어나 iNOS 활성이 증가하여 NO가 증가하게 된다[8]. 한편, TNF-ɑ는 vascular endothelial growth factor 생성을 증가시키는데, 이는 혈관내피세포의 분화를 촉진하여 혈관신생이 발생하게 된다. 최근에는 이 혈관신생이 간폐증후군의 중요한 병인으로 여겨지고 있다[9].
진단으로는 산소투여에도 저산소증을 보이거나, 곤봉지와 청색증 등의 증상이 관찰되면 간폐증후군을 의심할 수 있다. 본 증례의 환자도 직립 자세에서 산소 4 L의 투여에도 산소포화도 86-87%의 저산소증을 보였으며, 곤봉지와 입술에 청색증을 확인할 수 있었다. 대기상에서 산소포화도가 96% 이하일 경우 동맥혈액가스 검사를 시행하고 동맥혈 산소 분압(PaO2)이 80 mmHg보다 낮거나 폐포동맥간 산소분압차가 15 mmHg 이상(65세 이상에서는 20 mmHg)일 경우 추가 검사를 고려한다[10]. 우선, 저산소증을 유발할 수 있는 폐동맥 색전증 및 폐와 심장 질환 등을 감별해야 하며, 흉부 컴퓨터단층촬영, 심초음파 그리고 폐기능 검사 등이 감별에 도움이 된다. 본 증례에서도 폐포동맥간 산소분압차가 75.35 mmHg로 상승되어 있어 이와 같은 검사를 통해 다른 원인의 저산소증을 감별할 수 있었다.
동맥혈액가스 검사에서 확인된 PaO2 수치에 따라서 중증도를 구분하기도 하는데 경증은 PaO2 ≥ 80 mmHg, 중등증은 PaO2 60-79 mmHg, 중증은 PaO2 50-59 mmHg, 고도중증은 PaO2 < 50 mmHg로 분류한다[5]. 맥박 산소 측정법을 통해 앙와위에서 직립 자세보다 4% 이상 산소포화도 차이가 난 경우 폐내혈관 확장의 가능성을 의심할 수 있으나 간폐증후군의 진단의 근거로 삼기에는 무리가 있다[11]. 본 증례 환자의 경우 자세에 따라 약 10% 정도 산소포화도 차이를 보였으며 PaO2 44.8 mmHg로 고도중증군에 속하였다.
저산소증을 유발할 다른 질환이 배제된 경우 미세기포를 사용하는 심초음파 검사를 시행하는데, 미세기포가 우심방에 투약하고 난 뒤 4-6번의 심전도 주기 후 좌심방에서 확인된다면 간폐증후군을 확진할 수 있다[12]. 정상적인 폐내모세혈관은 기포가 통과하지 못하기 때문에 좌심방에서 기포를 관찰할 수 없다[13]. 미세기포를 이용한 심초음파 이외에도 99mTc-MAA를 정맥에 투여하여 폐환기관류스캔을 하는 진단법이 있다[12]. 20-50 μm 크기의 MAA 입자를 정맥투여하면 정상적인 경우에는 폐내모세혈관을 통과하지 못하나 간폐증후군의 경우 비정상적으로 확장된 폐내모세혈관을 통해 그대로 동맥을 통해 체순환하게 되고 뇌, 신장, 비장 등에서 스캔됨으로써 단락의 존재를 확인할 수 있다[10]. 그러나 침습적이고 초기 간폐증후군에서 민감도가 떨어진다는 단점이 있다. 본 증례 환자에서는 조영증강 심초음파와 폐환기관류스캔을 모두 시행하였고, 두 검사에서 모두 좌우단락에 의한 양성 소견을 보여 간폐증후군으로 진단할 수 있었다.
간폐증후군은 간이식을 제외하고는 뚜렷한 치료법이 밝혀져 있지 않다. 진단받은 환자 수가 많지 않아 약물적 효과를 입증할 만한 대규모 무작위 시험은 이루어지지 않았으며 다양한 약물들의 효과에 대한 소규모 연구들이 있었으나 유의한 결과를 보여주지는 못하였다[14]. 증상 조절을 위해 장기간 산소 치료가 가장 추천되고 있지만 비용, 순응도, 효용성 등을 종합적으로 판단하여 치료할 필요가 있다[10]. 간이식 후 85% 이상의 환자에서 증상 호전을 보인다는 연구가 있다. 그러나 PaO2 ≤ 44 mmHg 경우에는 간이식 후 사망률이 증가한다고 알려져 있어[15], 간이식 전 정기적인 동맥혈액 가스 검사 추적이 필요하고, 환자 상태를 고려하여 간이식 여부를 결정할 필요가 있다. 본 증례에서는 간이식을 권유하기는 하였으나 PaO2가 44 mmHg로 간이식 후에도 예후가 나쁠 가능성이 있다.
본 증례는 저산소증과 곤봉지, 청색증 등으로 간폐증후군을 의심해서 여러 감별 진단법을 통해 확진한 사례를 소개하였다. 국내에서 간폐증후군을 확진한 사례가 많지 않지만 만성 간질환을 가진 환자에서 높은 유병률을 보이는 바 호흡곤란을 호소하고 낮은 산소포화를 보이는 환자에서 적극적인 진단이 필요할 것으로 생각된다. 간폐증후군은 산소포화도를 고려하여 model for end-stage liver disease score 예외 규정으로 간이식 대기 순위를 결정하는 외국과는 달리, 국내에는 이에 대한 기준이 없다. 간폐증후군 질환자 중 응급 이식이 필요하나 간질환의 중증도 평가 점수가 낮아 우선순위가 밀려나는 경우가 많으므로 간이식 응급도 평가에서 이러한 부분을 보완할 필요가 있다.