불명열의 진단적 접근
Fever of Unknown Origin: An Overview of the Diagnostic Approach
Article information
Trans Abstract
Although fever of unknown origin (FUO) was first defined in 1961, it remains a diagnostic challenge. The revised 1991 definition categorized FUO into classic FUO, nosocomial FUO, neutropenic FUO, and human immunodeficiency virus-related FUO, each requiring at least three outpatient visits or 3 days of in-hospital stay. The causes of classic FUO differ greatly geographically and temporally, and are divided into infections, noninfectious inflammatory diseases, neoplasms, and miscellaneous diseases. A systematic, comprehensive and rational approach is required for appropriate diagnosis. A medical history and physical examination are very important; they may reveal diagnostic clues. Here, we review the literature on the causes and diagnostic approaches of classical FUO.
서 론
1961년 불명열(fever of unknown origin, FUO)이 처음 정의된 이후, 60년간 의학과 진단기술의 발전에도 불구하고 여전히 진단에 있어 도전적인 과제 중 하나이다. 1991년 재정립된 정의는 고전적 불명열(classic FUO), 입원 환자(nosocomial FUO)의 불명열, 호중구 감소성 불명열(neuropenic FUO) 그리고 인간면역 결핍 바이러스 관련 불명열(human immunodeficiency virus [HIV]-related FUO)로 유형이 분류되었으며, 최소 3회 이상의 외래 방문 또는 3일 동안의 입원 기간이 제시되었다. 고전적 불명열의 원인 질환은 200가지 이상이라고 알려져 있으며, 지역 또는 시대에 따라 매우 다양하여 감염성 또는 비감염성 원인에 대해 체계적이고 포괄적이며 합리적인 접근이 필요하다. 이에 최근 연구 결과들을 바탕으로 문헌고찰을 통해 고전적 불명열에 대한 원인 및 진단적 접근에 대해 논하고자 한다.
본 론
증례
기저 질환 없이 평소 건강하였던 41세 남자가 내원 2주 전부터 발열, 오한, 근육통이 있어 다른 병원에 입원하여 2주간 검사하였으나, 특이 소견을 보이지 않고 증상이 지속되어 전원되었다. 직업은 사무직이고 경기도 수원에 살고 있었으며, 특별한 여행력이나 동물 접촉력은 없었다. 전원 후에도 발열, 오한, 전신 근육통이 지속되었으며, 식욕부진과 소화장애를 호소하였다. 신체 검사에서 우상복부 압통과 간비장 종대가 관찰되었으며, 혈액 검사에서 혈청 간세포 효소의 경한 증가가 관찰되었다. 타 병원에서 시행한 복부 컴퓨터단층촬영(computed tomography, CT)에서 간비장 종대 이외 특이 소견은 없었으며, 두통을 호소하여 시행한 뇌척수액 검사 상 정상이었다. 내원 8일에 시행한 18fluorodeoxyglucose-positron emission tomography/CT (18FDG-PET/CT) 검사에서 간의 섭취 증가가 확인되어 간조직 검사를 시행하였다. 조직 검사에서 도넛 모양의 육아종(doughnut granuloma)이 관찰되었으며, 국립보건 연구원에 의뢰한 Coxiella burnetii phase II 항원에 대한 미세간접면역형광항체법(indirect micro-immunofluorescence assay)에서 immunoglobulin G (IgG) 항체가 1:16 미만, immunoglobulin M (IgM) 항체가 1:512로 보고되어 급성 큐열로 진단하여 doxycycline (200 mg/일)을 2주간 경구투여 후 증상이 호전되어 퇴원하였다. 이후 회복기 혈청 추적 검사에서 IgG 항체가 1:512, IgM 항체가 1:512로 보고되었으며, 외래 추적 4주 후 환자는 증상이 소실되었고 혈청 추적 검사 예정이다.
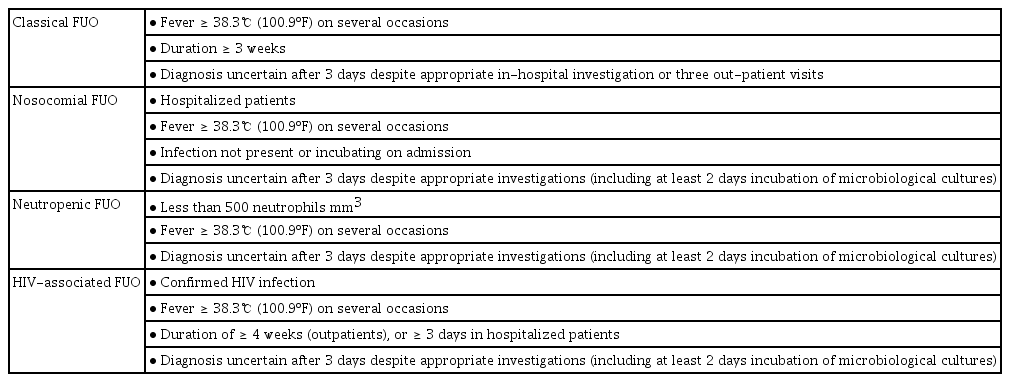
불명열의 정의와 분류
발열(fever)은 체온조절중추의 발열점(thermoregulatory set point)의 상승으로 인하여 중심 체온이 증가하는 것을 말한다. 따라서 체온조절중추의 발열점이 상승하여 건강한 성인의 구강체온이 오전 6시에 37.2℃를, 오후 4-6시에 37.7℃를 초과하는 경우를 발열이라고 한다. 직장을 통한 체온 측정의 경우 0.4℃ 더 높게 정의하며, 정상적인 체온의 일주기 변화의 폭은 0.5-1.0℃로 간주된다[1]. 발열은 임상의사가 외래 및 입원 환자에서 경험하는 가장 흔한 임상 소견 중의 하나로, 감염 질환, 악성종양, 결체조직 질환, 기타 질환 등의 다양한 원인에 의해 발생할 수 있다. 1961년 Petersdorf와 Beeson [2]이 100개 증례 보고를 통해 불명열을 조사하였으며, 반복되는 38.3℃ 이상 체온상승과 3주 이상 지속되는 발열, 1주간 입원 검사에도 진단을 내릴 수 없는 경우로 정의하였다. 이 정의에는 저절로 호전되는 바이러스 질환을 배제하고, 적절한 초기 평가를 할 수 있는 시간을 충분히 고려하려는 의도가 반영되었다. 이후 1991년 의학과 진단기법의 발전에 따라 불명열을 1) 고전적 불명열(classic FUO), 2) 입원 환자의 불명열(nosocomial FUO), 3) 호중구 감소성 불명열(neuropenic FUO), 4) 인간면역 결핍 바이러스 관련 불명열(HIV-related FUO)로 세분하여 접근하게 되었다. 또한 최소 3회 이상의 외래 방문 또는 3일 동안의 입원 기간으로 재정의 되었다(Table 1) [3]. 이후 1997년에 기간(quantitative criteria)보다는 진단(qualitative measure)에 중점을 두고 “적절한 최소한의 질적인 진단평가(minimal standard diagnostic studies to qualify)”에도 불구하고 진단되지 않은 여러 차례의 발열에 대해 불명열로 정의할 수 있다는 제안이 등장하였다[4-6]. 그러나 대부분의 연구에서는 1991년 Durack 등[3]이 정의한 고전적 불명열의 정의를 사용하고 있으며, 적절한 진단평가의 범위에 대해서는 논란의 여지가 많다. 또한 진단기법의 발전으로 새로운 진단기법의 적용에 대한 논의가 필요하다.
고전적 불명열의 원인
고전적 불명열의 원인은 주로 1) 감염 질환(16-55%), 2) 종양(7-35%), 3) 비감염성 교원성 질환(9-34%), 4) 기타 질환(4-28%) 및 5) 미진단 질환(5-51%)으로 분류할 수 있다[7,8]. 이러한 5가지 범주는 시대별, 지역별, 연령별 및 의료제도에 따라 다른 빈도를 보인다. 2000년대 이후에는 감염 질환과 기타 질환의 빈도는 감소하고, 비감염성 교원성 질환 및 미진단 질환의 빈도가 증가하는 경향을 보이는 것으로 보고되었다[9-11]. 특히 유럽이나 선진국에서 비감염성 교원성 질환의 빈도가 높았으며, 개발도상국이나 아시아의 경우 감염 질환의 빈도가 높은 경향을 보였다. 65세 이상의 노령 인구에서의 불명열의 원인은 감염 질환은 25%로 낮은 비율을 차지하는 반면, 비감염성 교원성 질환은 약 31%로 높은 비율을 보였으며, 미진단 비율은 8%로 낮은 경향을 보였다[12-15].
감염 질환은 고전적 불명열 중 가장 흔하고 중요한 위치를 차지하며, 농양, 심내막염, 결핵, 복잡성 요로감염이 다빈도를 차지한다. 개발도상국에서는 이와 더불어 브루셀라증(brucellosis)과 장티푸스를 고려해야 하며, 선진국의 경우에는 골수염과 바르토넬라증(bartonellosis)을 간과해서는 안된다. 비감염성 교원성 질환은 최근 지속적으로 진단율이 증가하고 있으며, 성인형 스틸병(adult-onset Still’s disease, AOSD)과 류마티스 관절염, 전신성 홍반성 낭창이 주로 차지하나, 노령 인구에서는 측두 동맥염과 류마티스 다발근통을 우선 감별해야 한다. 종양에 의한 발열 역시 중요한 원인 중 하나로, 림프종, 백혈병 및 신장암 등을 고려해야 한다. 기타 질환에서 임상의는 약열, 폐색전증, 갑상선염에 대해 꼭 감별하도록 한다. 5가지 범주에서의 흔한 진단에 대해 표 2에 정리하였다.
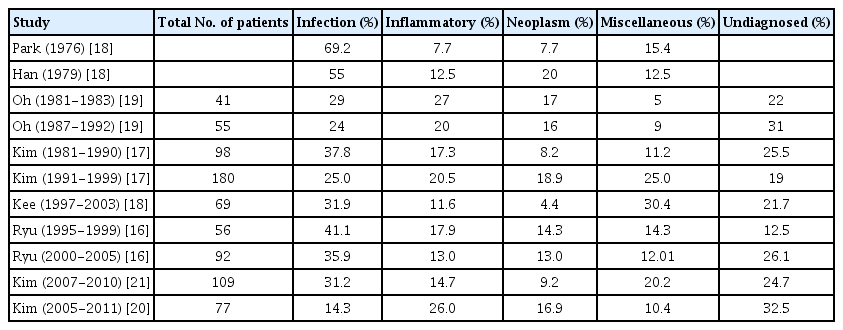
국내 보고에서는 감염 질환(14.3-69.2%)이 가장 흔하며, 시대의 흐름에 따른 빈도의 감소 경향을 보이고 있었다. 그 중 결핵이 가장 많은 부분을 차지하였다. 증가 경향으로 보고되는 비감염성 교원성 질환이 7.7-27%를 차지하였으며, AOSD의 진단 증가가 두드러졌다. 종양은 4.4-20%를 차지하고 있었으며 대부분 악성 림프종(특히 비호치킨 림프종)으로 보고되었다. 다른 나라와 같이 미진단 질환의 비율이 1990년대 12.5-21.7%에서 2000년대 26.1-32.5%로 증가 경향을 보였다(Table 3) [16-21].
불명열의 초기 평가 및 진단
불명열의 원인이 될 수 있는 질환은 매우 광범위하고, 비감염적 원인까지 포괄적인 접근이 필요하기 때문에 진단평가의 표준화는 쉽지 않다. 불명열이 정의된 후 60년이 지났음에도 적절한 진단법에 대한 지침이나 증거 기반 하에 공통적으로 표준화된 형식이 없으며, 전향적인 진단법 연구가 쉽지 않은 실정이다. 그러나 의사의 경험과 지식 범위에 따라 체계적인 접근이 없이 부적절한 검사 남용 및 과도한 항생제 투여를 유발할 수 있기 때문에 유력한 진단적 근거(potential diagnostic clues, PDCs)의 확보를 위한 적절한 접근 방법에 대해 최소한의 알고리즘과 각 상황에 따른 과정의 통일은 필요하다[22]. 특히 적절하고 수준 높은 병력 청취와 신체검진은 핵심 단서의 확인과 원인질환 범주 추정에 매우 중요하므로 절대 간과해서는 안된다. 또한 새로운 진단기법에 대한 민감도와 진단기여도에 따라 검사의 적용에 대한 의학적 합의가 필요한 시점이다.
초기 평가
진단의 첫 걸음은 실제 발열의 확인이다. 또한 체온의 변화와 동반되는 신체 징후(맥박, 혈압, 호흡수, 피부 상태)의 변화를 면밀히 관찰하여 진단의 단서(PDCs)를 최대한 찾아야 한다. 외래에서는 환자의 자발적인 발열일기를 통해 환자의 발열의 확인과 발열 양상을 파악하도록 한다. 발열형태나 상대적 서맥은 질병특이적(pathognomonic)인 단서는 아니나, 진단의 근거를 제공할 수 있다[23].
두 번째, 발열 환자에서의 병력 청취와 신체 진찰은 충분한 시간을 들여 자세히 하는 것이 진단에 매우 중요하다. 실제 침습적 진단기법보다 자세한 병력 청취와 꼼꼼한 신체 진찰만으로도 진단의 중요한 단서(PDCs)를 얻을 수 있는 경우가 많다고 보고하고 있으며, 국소 증상 여부와 감염성 응급 질환의 유무에 대한 판단에 필수적이다[4,10,16,18,24]. 병력 청취에서 기본적인 과거병력 및 가족력뿐만 아니라 여행력과 직업, 동물 접촉력, 생식 여부 및 위험한 성생활에 대한 조사가 포함되어야 한다. 최근의 입원 기왕력, 약물 노출력에 대한 조사 역시 필수적이다. 약열에 대한 고려 시 3일 이상 노출일이 지났다면 약물 배출이 충분히 이뤄진 것으로 간주할 수 있어 약열을 배제할 수 있다. 또한, 계절적 유행과 지역적 유행 질환에 대한 정보도 도움이 될 수 있다. 신체 진찰 시에는 국소 증상 유무와 상관없이 전신 진찰을 꼼꼼히 시행하는 것이 필요하다. 경부 강직 및 림프절 종대의 유무와 심음 및 호흡음의 이상 소견 유무, 복부의 장기비대 및 늑골척추각압통 유무를 파악함과 동시에 체간의 발진 유무를 꼭 확인해야 한다. 근육 및 관절의 압통 및 하지부종과 발적 여부도 관찰해야 한다[17,22,25].
세 번째, “적절한 최소한의 질적인 진단평가(minimal diagnostic studies to qualify)”에 포함되어 있는 실험실적 검사는 불명열의 25%에서 진단을 제공할 수 있는 비침습적이고 중요한 단계이다. 혈청학적 검사에 미생물학적 접근과 류마티스 질환에 대한 검사가 포함되며, 특히 결핵과 HIV에 대해서도 확인하는 것이 권장된다[8,23,26,27]. 일반혈액 검사 적혈구 침강속도, C 반응성 단백과 페리틴 검사는 비특이적 급성기 반응 검사이나, 비감염성 질환과의 구분에 도움을 줄 수 있어 초기평가에 포함한다[20,23]. 프로칼시토닌 역시 세균성 감염 질환에서의 특이도가 높아(70-98%), 진단을 추정하는 데 사용될 수 있다[28]. 그러나 불명열에 있어서 이러한 급성기 반응물질들의 유용성에 대해서는 보고된 바가 없어 추가 연구가 필요하며, 불명열의 넓은 진단범위로 인해 특이도가 높은 검사조차도 높은 위양성률을 보일 수 있어 해석에 주의가 필요하다. Modified Duke Criteria의 경우 불명열 환자에서 사용 시 민감도(82%)와 특이도(99%)가 높은 것으로 알려져 있어 심내막염이 의심되는 환자에서 적극적인 적용이 필요하겠다[29,30]. 국내에서는 큐열의 경우 노출 위험도에 따라 혈청학적 검사를 권장하였으나, 최근 2013년 이후 항체 조사에서 고위험군(도축업자, 낙농업자, 육류가공 종사자, 수의사)에서 혈청유병률의 지속적인 증가가 확인되었을 뿐만 아니라, 2015년 이후 발생건수가 증가하고 있으며, 최근 보고에서 진단된 환자의 91.7%에서 동물 접촉력이 없는 것으로 확인되고 있어 국내에서도 불명열에서 큐열에 대한 적극적인 혈청 검사가 필요할 것으로 보인다(Table 2) [31,32].
영상 검사
불명열에서 영상 검사의 적용 목적은 원인 질환의 국소화를 통해 최대한 합리적으로 진단에 접근하기 위함이다. 또한 감염 질환과 종양의 감별에 도움이 된다. “적절한 최소한의 질적인 진단평가”에 포함된 흉부방사선을 포함하여 흉복부 CT가 흔히 적용되고 있으며, 최근 18FDG-PET/CT의 유용성에 대한 연구가 활발히 이루어지고 있다. 불명열에서 흉부방사선은 60%의 민감도를 보이나, 흉부/복부 CT는 82%, 92%의 민감도로 보고되었다[10,24]. 흉부와 복부 CT 모두 특이도 60-70%, 진단 기여도는 20%로 보고되었다. CT는 되도록 적절한 기초평가 후에 유력한 진단 근거를 최대한 추정한 뒤 필요한 경우에만 시행하는 것을 권유하고 있다[4,33]. 최근 각광받고 있는 18FDG-PET/CT는 민감도 86-92%로 보고되고 있으며, 진단기여도는 16-89%로 다양하게 보고되고 있다. 높은 민감도와 진단기여도를 보임으로써 불명열 진단에 조기 적용이 도움이 된다는 보고가 많으며, 특히 진단적 단서(PDCs)가 없는 경우에 더 유용한 것으로 보인다[34-36]. 18FDG-PET/CT는 전신의 해부학적 구조뿐만 아니라 체내 대사의 반영을 통해 염증에 대한 국소적 위치 추정이 용이한 장점이 있다. 또한 CT에 비해 적은 방사선 노출(15 mSv vs. 20-25 mSv)과 신독성 위험이 적다는 장점이 있다. 최근의 체계분석 연구에서 18FDG-PET/CT의 진단기여도는 56% (95% 신뢰구간 50-61%; I2 = 61%)였으며, CT를 시행한 경우 진단 기여도(32%, 95% 신뢰구간 22-44%; I2 = 66%)는 더욱 낮아졌다. 따라서 지금까지의 연구를 통한 양전자단층촬영 시행의 근거는 패러다임을 전환할 만큼 충분하지는 않았으나 검사 시기가 빠른 것이 더 도움이 될 수 있다는 점을 제시하였다[37]. 이는 양전자단층촬영에 대한 대부분의 연구가 후향적 연구이며, 이질성이 높아 근거 수준에 있어서 한계가 있으므로 전향적 연구를 통한 입증이 필요할 것으로 보인다. 또한, 빠른 진단을 통해 적절한 치료를 조기에 시작할 수 있고 불필요한 검사를 줄임으로써 오히려 비용효과 측면에서 이득이라는 연구도 있다[36,38]. 2016년 오스트리아에서 불명열 환자 중 초기 집중 진단평가를 시행 후 진단되지 않고 유력한 진단 단서가 없는 환자들에게 2차 검사로 18FDG-PET/CT를 적용하는 전향적 연구(FEBRIX study)를 시작하였으나 아직 결과가 보고되지는 않은 상태이다(Fig. 1) [7]. 국내에서도 불명열에서 18FDG-PET/CT의 진단 효용성에 대한 긍정적인 보고들이 있으며, 타카야수 동맥염, 유육종증, 큐열의 진단에 도움이 되었다. 특히 외국 보고와 같이 초기 진단평가에도 진단이 되지 않은 환자군에서의 효용성이 보고되었다[21,35,39]. 그러나 국내 보고 역시 단일기관에서의 후향적 보고이며, 보험급여가 되지 않는 한계가 있어 현재 진행되고 있는 전향적 연구 결과와 함께 잘 설계된 비용효과 연구를 통해 국내 실정에 맞는 알고리즘 개발이 필요하겠다.
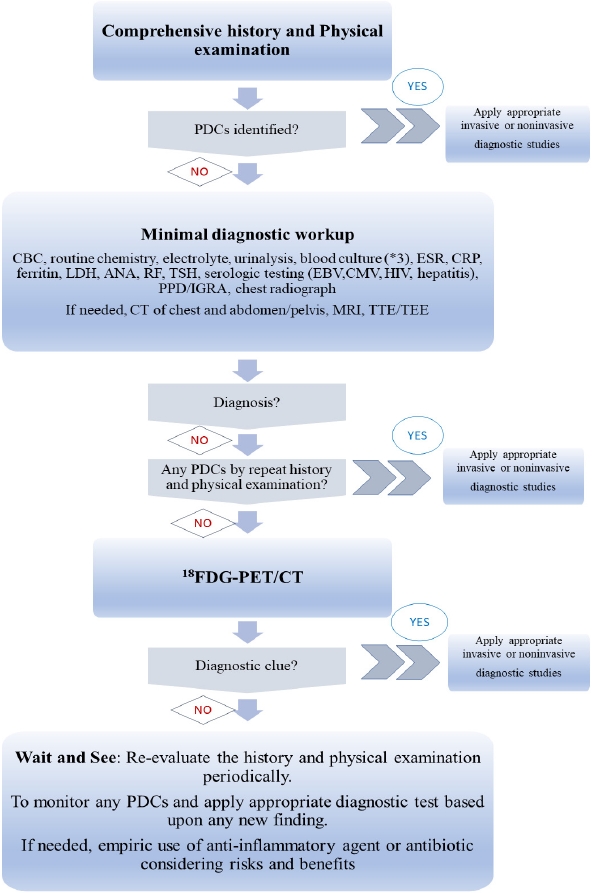
The diagnostic algorithm for classic FUO. Suggested structured approach to investigating classic FUO. This FUO algorithm is based upon limited data [6,10,22,24] and FEBRIX study [7]. FUO, fever of unknown origin; PDCs, potential diagnosis clues; CBC, complete blood count; CRP, C-reactive protein; ESR, erythrocyte sedimentation rate; LDH, lactate dehydrogenase; ANA, antinuclear antibodies; RF, rheumatoid factor; TSH, thyroid-stimulating hormone; EBV, Epstein-Barr virus; HIV, human immunodeficiency virus; CMV, cytomegalovirus; PPD, purified protein derivative; IGRA, interferon-γ releasing assay; CT, computed tomography; MRI, magnetic resonance imaging; TTE, transthoracic echocardiogram; TEE, transesophageal echocardiogram; 18FDG-PET, 18fluorodeoxyglucose-positron emission tomography.
침습적 검사
간조직 검사 및 골수 검사, 진단적 개복술 등을 포함한 침습적 검사는 확정적 진단을 유도하기 위한 경우가 많으며, 이러한 침습적 검사의 진단기여도는 35-42%로 보고되고 있다. 림프절 생검의 경우 흡인 생검보다 절제 생검이 진단기여도가 높으며, 결핵이나 림프종에 대한 감별이 필요하다[40]. 간 조직 검사의 진단기여도는 14-17%로 보고되며, 육아종성 간염으로 보고되는 경우가 흔하다 [12,24]. 골수 검사는 혈액 질환의 감별이 필요한 경우 시행하게 되나, 진단 기여도가 0-2%로 매우 낮게 보고되고 있어 꼭 필요한 경우에만 시행하는 것을 권유한다[28,41]. 진단적 개복술은 영상 검사의 발달 이후 영상 검사로 대체되는 경향이며, 복막암이나 파종성 결핵의 진단에 도움이 될 수 있다[33].
새로운 분자생물학적 기법
아직은 불명열에서의 분자생물학적 기법의 적용에 대한 것은 잘 알려져 있지 않다. 다만 흔하지 않은 질환의 진단에 중합효소 연쇄반응(polymerase chain reaction, PCR)을 이용하거나, 16s 리보좀 RNA 유전자 염기서열 분석와 같은 기법을 이용해 배양이 어려운 세균을 확인한 증례 보고들이 있으며, 폐외 결핵에서의 PCR의 이용 시 진단기여도가 22.3-41.6%임이 보고된 바가 있다[42,43]. 또한 차세대 염기서열 분석을 이용한 증례 보고도 이루어지고 있어[43,44], 기존의 미생물 배양의 한계를 극복하고 이전에 진단되지 못하였던 질환에 대해서도 새로운 시야를 열어줄 것으로 기대된다. 다만 결과에서의 위양성 해석과 항생제 감수성에 대한 한계점을 충분히 이해하고 적용해야 하며, 불명열에서의 진단기여도와 비용효과에 대해서도 좀 더 연구가 필요하다. 분명한 것은 이러한 진단기법의 발전이 불명열에서의 감염 질환과 미진단 질환의 비율을 감소시킬 수 있으며, 양적인 접근보다는 질적인 진단으로 패러다임이 전환하는 데 기여할 것이다[10,42,45].
결 론
의학의 발전과 새로운 진단기법의 도입에도 불구하고 여전히 불명열은 가장 도전적인 과제 중 하나이다. 광범위한 원인 질환 가능성과 표준화되지 않은 다양한 진단기법으로 인하여 오히려 과도한 검사의 남용과 부적절한 항생제 사용의 원인이 되기도 한다. 따라서 적절한 병력 청취와 신체검진과 같은 비침습적인 초기 평가 단계에서 핵심 단서의 확보를 위한 노력이 가장 중요하겠으며, 최소한의 적절한 진단평가에 대한 충분한 검토가 필요하겠다. 이후 2차 평가에서 충분한 근거를 가지고 적절한 추가 진단기법의 사용을 고려해 볼 수 있겠다. 이와 관련하여 18FDG-PET/CT나 분자생물학적 진단기법의 도입에 대한 근거 확보를 위한 추가 연구와 논의가 필요하겠으며, 불명열의 원활한 진단에 도움이 될 것으로 기대한다.