한국인 급성 심근경색증 환자에서 좌심실 비대의 형태학적 분류에 따른 임상경과의 차이
Difference of Clinical Outcomes According to Left Ventricular Hypertrophy and Its Subtype in Korean Patients with Acute Myocardial Infarction
Article information
Abstract
목적
좌심실의 구조적 변화는 심혈관계 이환율과 사망률 의 위험 증가와 관련이 있다고 알려져 있다. 본 연구에서는 급성 심근경색증 환자에서 좌심실 비대와 그 형태적 분류에 따라 임상경과의 차이와 주요심장사건(major adverse cardiacevents, MACE)에 미치는 영향을 파악하고자 하였다.
방법
2014년 1월부터 2015년 10월까지 Korea Acute Myocardial Infarction Registry-National Institute of Health (KAMIR-NIH)에 등록된 환자 중 급성 심근경색증으로 전남 대학교병원에 입원한 환자 중에서 관상동맥 중재술을 시술 받고 2년 동안 임상 추적 관찰이 되어 분석 가능한 환자 852명 (남:여 = 603:249)을 대상으로 하였다. 좌심실의 형태적 구조에 따라 정상군 470명(62.4 ± 12.8세, 남자 389명)과 좌심실 비대군 382명(67.1 ± 12.1세, 남자 214명)으로 분류하여, 양군 간의 임상적 특성, 혈액 검사 특성, 심장초음파 및 관상동 맥 조영술 소견 및 MACE를 비교·분석하였다. 좌심실 비대군은 좌심실 벽의 상대적 두께(relative wall thickness, RWT)와 좌심실 질량지수(left ventricular mass index, LVMI)에 따라 동심성 재형성군(concentric remodeling; RWT ≥ 0.42, LVMI≤ 115 g/m2 in male, ≤ 95 g/m2 in female), 동심성 비대군(concentric hypertrophy; RWT ≥ 0.42, LVMI > 115 g/m2 in male, > 95 g/m2 in female) 및 편심성 비대군(eccentric hypertrophy; RWT < 0.42, LVMI > 115 g/m2 in male, > 95 g/m2 in female)으로 세분하여 평가하였다.
결과
대상 환자를 21 ± 7.8개월간의 임상적 경과 관찰 중에 MACE는 173명(사망 55명, 재발성 심근경색증 26명, 재입원 34명)에서 발생하였다. MACE의 발생은 좌심실 비대군에서 정상군에 비하여 유의하게 높았으며(16.0% vs. 25.5%, p = 0.001), Kaplan-Meier 생존곡선을 이용한 사망률 분석 결과에서 좌심실 비대군이 정상군에 비하여 유의하게 생존율이 낮았다(p = 0.008). 좌심실 비대군의 형태적 분류에 따른 MACE의 분석 결과에서는 편심성 비대에서 MACE의 발생이 유의하게 많았다(동심성 재형성 vs. 동심성 비대 vs. 편심성 비대; 11.2% vs. 15.5% vs. 22.1%, p = 0.046).
결론
급성 심근경색증 환자에서 좌심실 비대는 불량한 예후와 관련이 있었으며, 좌심실 비대 중 편심성 비대를 동반한 경우에 예후가 가장 불량하였다. 따라서, 한국인 급성 심근경색증 환자에서 좌심실 비대를 보이는 경우, 특히 편심성 비대를 동반한 경우에 적극적인 치료가 필요할 것으로 사료되었다.
Trans Abstract
Background/Aims
Left ventricular hypertrophy (LVH) on clinical outcomes in patients with acute myocardial infarction (AMI) is not clear. This study was performed to investigate the effect of abnormal left ventricular geometry on clinical outcomes in Korean patients with AMI.
Methods
A total of 852 consecutive patients with AMI were divided into two groups: normal left ventricular geometry (n = 470; 389 males) and LVH (n = 382; 214 males) groups. Major adverse cardiac events (MACEs) were defined as cardiac death, recurrent myocardial infarction, and rehospitalization.
Results
During the clinical follow-up period of 21 ± 7.8 months, MACEs developed in 173 patients (20.0%), and the rate was higher in the LVH than normal left ventricular geometry groups (25.5% vs. 16.0%, respectively, p = 0.001). According to Kaplan-Meier survival curves, the MACE-free survival rate was significantly lower in the LVH group than in the left ventricular geometry group (p = 0.008). The rates of MACEs and all-cause mortality differed among the AMI with concentric remodeling, concentric hypertrophy, and eccentric hypertrophy subgroups (11.2% vs. 15.5% vs. 22.1%, respectively, p = 0.046). Eccentric hypertrophy was a predictive factor of MACE according to Cox proportional hazards analysis (hazard ratio 1.804, confidence interval 1.034-3.148, p = 0.038).
Conclusions
LVH is a predictor of poor outcomes in patients with AMI, and eccentric hypertrophy is associated with a worse prognosis compared with concentric remodeling and concentric hypertrophy. Therefore, Korean patients with AMI and LVH, especially eccentric hypertrophy, require more careful observation and intensive treatment.
서 론
최근 서구화된 식습관과 스트레스, 급속도로 진행하는 노령화 사회로 진입하면서 고혈압의 유병률이 증가하고 있고, 초기 증상이 없어 치료하지 않고 방치되었던 고혈압 환자에서 혈관의 과부하가 지속되면서 표적장기손상 중의 하나인 좌심실 비대의 유병률도 증가하고 있다[1,2]. 좌심실 비대는 대부분 고혈압이나 비만 환자에서 비정상적인 심부하에 대한 심근의 한 반응 형태로 만성적 압력 부하에 대한 보상기전으로 나타나며, 심혈관 질환 발생 및 합병증의 독립적인 위험인자이며 사망 위험인자로 알려져 있다[3-7]. 최근까지 연구들에 의하면 좌심실 비대는 심근경색증 환자에서 경색의 크기와 연관되어 있고[8], 심근경색증 발생 후에 미세혈관 질환 및 좌심실 재형성에도 영향을 준다고 보고되고 있다[9]. 또한, 고혈압 환자에서 좌심실 비대는 관상동맥 질환, 급사, 심부전 및 뇌경색증의 독립적인 위험인자로 알려져 있으며[10], 고혈압이 없는 환자에서도 단독으로 관상동맥 질환의 위험인자로 작용할 뿐 아니라 관상동맥 질환에서 예후를 결정하는 중요한 인자로 알려져 있다[11,12]. 하지만 대부분의 연구는 고혈압 환자를 대상으로 시행한 연구이고 급성 심근경색증 환자에서 좌심실 비대가 임상 경과에 미치는 영향에 대한 연구는 거의 없는 편이다.
이 연구의 목적은 한국인 급성 심근경색증 환자에서 입원 당시에 시행한 심장초음파를 통해 좌심실 중격 및 후벽의 두께 그리고 좌심실 내강의 크기 등을 측정하였고, 2년간 임상적 추적을 통하여 좌심실 비대와 좌심실 비대의 형태적 분류에 따른 임상경과의 차이와 심장 사망, 심근경색증 재발 및 재입원 등을 포함한 주요심장사건(major adverse cardiac events, MACE) 발생에 대해 알아보고자 하였다.
대상 및 방법
연구대상
2014년 1월부터 2015년 10월까지 Korea Acute Myocardial Infarction Registry-National Institute of Health (KAMIR-NIH)에 등록된 환자 중 급성 심근경색증으로 전남대학교병원에 입원한 환자 1,317명 중 입원 당시 첫 48시간 이내 심장초음파 검사가 시행되었고 경피적 관상동맥 중재술(percutaneous coronary intervention, PCI)을 시술 받고 2년 동안 추적 관찰이 되어 분석 가능한 852명(남:여 = 603:249)을 대상으로 하였다. 좌심실 구조가 정상인 군 470명(62.4±12.8세, 남자 389명)과 좌심실 비대군 382명(67.1 ± 12.1세, 남자 214명)으로 분류하였다. 중등도 이상의 대동맥판막 협착, 비후성 심근증, 만성 폐쇄성 병변, 심장초음파 영상분석이 되지 않았던 환자는 연구대상에서 제외하였다.
연구 방법
KAMIR-NIH 연구는 전남대학교병원 생명윤리위원회의 심의(CNUH 05-49)를 통과하여 모든 환자의 동의서를 취득한 후에 이루어졌다. KAMIR-NIH 연구는 급성 심근경색증 환자의 예후 및 관리지표 개발을 위한 전향적, 다기관, 웹기반 코호트 연구로 국립보건연구원의 후원을 받아 2011년 11월부터 2015년 10월까지 한국의 20개 센터에서 환자가 등록되었다[13].
모든 환자는 급성 심근경색증으로 입원한 첫 48시간 이내에 General Electronics Vivid 7과 Vivid E9을 이용하여 심장초음파 검사를 시행하였다. 심장초음파 검사를 통해 이완기말 좌심실내경(left ventricular internal diameter in diastole), 이완기 심실 중격 두께(interventricular septal thickness in diastole)와 이완기 좌심실 후벽 두께(posterior wall thickness in diastole) 등을 미국심초음파학회(American Society of Echocardiography, ASE)의 권유 방법으로 M-mode를 이용하여 측정하였고[6], 좌심실 구조는 미국 심장초음파학회의 가이드라인에 따라서 분류하였다[14]. 심장의 구조와 체격은 큰 관련을 가지고 있기 때문에, 이를 보정하기 위하여 좌심실 질량은 cube formula를 이용한 corrected ASE method로 계산하였고, 이를 체표면적으로 나누어 좌심실 질량지수 값(LV mass index)을 구하였다[15]. 좌심실 구조를 정상군과 비대군으로 나누어 MACE를 분석하였으며, 좌심실 구조의 형태적 분류에 따라서 MACE를 분석하였다. 좌심실 비대군의 정의는 좌심실 질량지수 값이 남자는 115 g/m2보다 증가되어 있는 경우, 여자는 95 g/m2보다 증가되어 있는 경우 또는 좌심실 벽의 상대적 두께가 0.42 이상으로 하였다[14]. 그리고 좌심실 구조는 형태적 분류에 따라 좌심실 질량은 정상이나 좌심실 벽의 상대적 두께가 증가한 동심성 재형성군(concentric remodeling), 좌심실 질량과 좌심실 벽의 상대적 두께가 모두 증가한 동심성 비대군(concentric hypertrophy) 그리고 좌심실 질량은 증가하였으나 좌심실 벽의 상대적 두께는 정상인 편심성 비대군(eccentric hypertrophy)으로 분류하였다(Supplementary Fig. 1) [2,14].
급성 심근경색증의 정의는 troponin-I, T 혹은 creatine kinase-MB (CK-MB)와 같은 심근 효소의 상승과 더불어 다음과 같은 소견을 적어도 하나 이상 동반한 경우로 하였다. 허혈의 증상, 심전도에서 ST 분절의 변화나 새로 발생한 좌각차단, T파 역위의 변화, 병적인 Q파가 관찰될 때 그리고 영상학적으로 생존 심근의 감소가 새롭게 발견되거나 국소 벽 운동의 감소가 관찰되는 경우로 하였다[16]. 관상동맥 조영술에서 병변의 형태는 American College of Cardiology/American Heart Association (ACC/AHA) 분류법을 사용하였으며[17], 관상동맥 조영술에서 혈류의 흐름은 thrombolysis in myocardial infarction (TIMI) flow를 이용하였다[18]. 2년간 임상적 추적 관찰에서 MACE는 심장 사망, 심근경색증의 재발, 재입원으로 정의하였다. 2년간의 추적 관찰은 의무기록을 이용하여 수집하였고, 모든 대상 환자에서 임상적 특징, 혈액학적 검사, 심장초음파 및 관상동맥 조영술의 특징을 각각 분석하고 비교하였다.
통계 분석 방법
통계처리는 SPSS for Windows 20.0 (Statistical Package for the Social Science, SPSS Inc., Chicago, USA)를 이용하였다. 연속형 변수는 평균 ± 표준편차로 표시하였고, 범주형 변수는 빈도 및 율(%)로 기술하였다. 대상비교는 t-test, Chi-square test를 시행하였다. 2년간 MACE와 관련된 예측인자는 단변량 Cox regression 분석을 통해서 p-value가 0.05 미만인 인자들을 다변량 Cox regression에 포함하여 분석하고 hazard ratio (HR)와 95% confidence interval (CI)을 함께 계산하였다. 생존 분석은 Kaplan-Meier 방법을 이용하였으며, 모든 자료는 p값이 0.05 미만일 때 통계적으로 유의한 것으로 판단하였다.
결 과
임상적 특성
좌심실 비대군은 정상군에 비해 평균 연령이 높았고(67.1 ± 12.1세 vs. 62.4 ± 12.8세, p < 0.001), 여성의 빈도가 좌심실 비대군에서 높았다(56.0% vs. 82.8%, p < 0.001). 심혈관 질환의 위험인자인 고혈압(p < 0.001)과 흡연력(p < 0.001)은 좌심실 비대군에서 정상군에 비해 높았고(p < 0.001), 심장박동수(p = 0.007), ST 분절 상승 심근경색증(p = 0.017), 내원 당시 높은 Killip class (p = 0.001)도 좌심실 비대군에서 높은 빈도를 보였다. 그러나 당뇨병, 이상지질혈증, 관상동맥 질환에 대한 가족력, 체질량 지수는 양 군 간에 유의한 차이를 보이지 않았다. 좌심실 비대군에서는 내원 당시 흉통과 호흡곤란 증상을 정상군보다 더 많이 경험하였다.
좌심실 비대를 형태적 분류에 따라 동심성 재형성군, 동심성 비대군 및 편심성 비대군을 비교하였을 때 편심성 비대군에서 평균 연령이 가장 높았고(61.3 ± 12.7세 vs. 68.7 ± 11.4세 vs. 70.0 ± 10.8세, p < 0.001), 고혈압(22.8% vs. 23.7% vs. 53.5%, p < 0.001)과 당뇨병(17.5% vs. 20.8% vs. 61.7%, p < 0.001)의 빈도도 편심성 비대군에서 가장 많았다(Table 1).
진단검사의학 소견 및 심장초음파 소견
내원 시에 시행한 혈액 검사에서는 좌심실 비대군과 정상군이 총 콜레스테롤(p = 0.001), 저밀도 지단백 콜레스테롤(p < 0.001), creatinine (p = 0.002) 수치는 유의한 차이를 보였지만, 당화혈색소(hemoglobin A1c)는 두 군 사이에서 유의한 차이를 보이지 않았다(p = 0.863). 심장효소 중 CK-MB, Troponin-I는 양 군 간의 차이를 보이지 않았으나, N-terminal pro-B-type natriuretic peptide는 좌심실 비대군이 유의하게 높은 수치를 보였다(p < 0.001).
좌심실 구조를 비대 유형에 따라 분류하였을 때 정상군은 470명, 동심성 재형성군 116명, 동심성 비대군 72명, 편심성 비대군 195명이었다. 좌심실 구혈률(p < 0.001)과 좌심실 수축기말 용적(p = 0.001), 좌심방 용적(p < 0.001)은 유의한 차이를 보였고, 좌심실 벽 두께는 중격, 후벽 두께 모두 좌심실 비대군이 정상군에 비해 의미 있게 증가하였으며(p < 0.001), 좌심실 벽의 상대적 두께(p < 0.001)와 좌심실 질량지수 값(p < 0.001) 또한 유의한 차이를 보이며 증가하였다(Table 2).
관상동맥 조영술에서 병변의 특성
관상동맥 조영술에서 표적 혈관의 병변 위치, 병변 혈관수는 양 군 간의 유의한 차이가 없었다. ACC/AHA 분류에 의한 혈관 병변의 특징 그리고 PCI 이후 TIMI flow에서도 유의한 차이는 없었다.
좌심실 비대의 형태적 분류에 따른 비교에서는 병변 혈관수에 따라서 세 군 간의 유의한 차이가 있었으며, 편심성 비대군에서 다혈관 질환이 유의하게 많았다(p < 0.012) (Table 3).
처방 약물
두 군 간에 사용된 약제는 아스피린, 클로피도그렐, 베타차단제, 칼슘길항제, 안지오텐신 전환효소 억제제, 안지오텐신 수용제 차단제, 스타틴에 대해 비교하였고, 양 군 간에 사용 빈도의 차이는 없었다. 좌심실 비대의 형태적 분류에 따라서도 약제 사용에 따른 차이는 없었다(Supplementary Table 1).
병원 내 임상경과 및 추적 관찰 결과
모든 환자를 2년간 임상적으로 추적 관찰한 결과 심장 사망, 심근경색증의 재발 및 재입원에서 양 군에 유의한 차이가 있었다. 좌심실 비대군에서 정상군에 비하여 MACE (16.0% vs. 25.5%, p = 0.001)와 모든 요인의 사망(8.5% vs. 52%, p = 0.020)의 발생비율이 많았다. 좌심실 비대의 형태적 분류에 따라 MACE를 비교한 결과, MACE (19.4% vs. 11.0% vs. 43.0%, p = 0.046)와 모든 요인의 사망(11.8% vs. 27.5% vs. 60.8%, p = 0.006)에서 편심성 비대군이 유의하게 높았다(Table 4).
MACE에 대한 독립적 요인 예측인자
2년 추적 관찰 기간 동안 중 단변량 Cox regression 결과에서 MACE에 영향을 주는 독립적인 인자는 연령 60세 이상, ST 분절 상승 심근경색증, Killip class Ⅱ 이상, Glucose ≥ 200 mg/dL, 좌심실 구혈률 50% 미만, E/e’ ratio 15 이상, 베타차단제 사용, 편심성 비대였다. 다변량 Cox regression 결과 MACE 발생의 독립적인 인자는 연령 60세 이상(HR 2.667, CI 1.324-5.376, p = 0.006), E/e’ ratio 15 이상(HR 2.366, CI 1.384-4.044, p = 0.002), 편심성 비대(HR 1.751, CI 1.010-3.034, p = 0.046)로 파악되었다(Table 5).
사망률 비교
Kaplan-Meier 생존곡선을 이용하여 분석한 결과, 좌심실 비대군, 즉 좌심실 질량이 남자는 115 g/m2보다 증가되어 있는 경우, 여자는 95 g/m2보다 증가되어 있는 경우 또는 좌심실 벽의 상대적 두께가 0.42 이상인 환자에서 유의하게 생존율이 낮았다(Fig. 1). 형태적 분류에 따른 사망률은 편심성 비대군이 생존율이 가장 낮게 나타났다(Fig. 2).

Kaplan-Meier curves for MACEs and all-cause mortality according to left ventricular geometry. (A) The rates of MACE-free survival and (B) all-cause mortality were significantly lower in the LVH group than in the normal left ventricular geometry group (p = 0.01 and p = 0.020, respectively). MACEs, major adverse cardiac events; LVH, left ventricular hypertrophy.
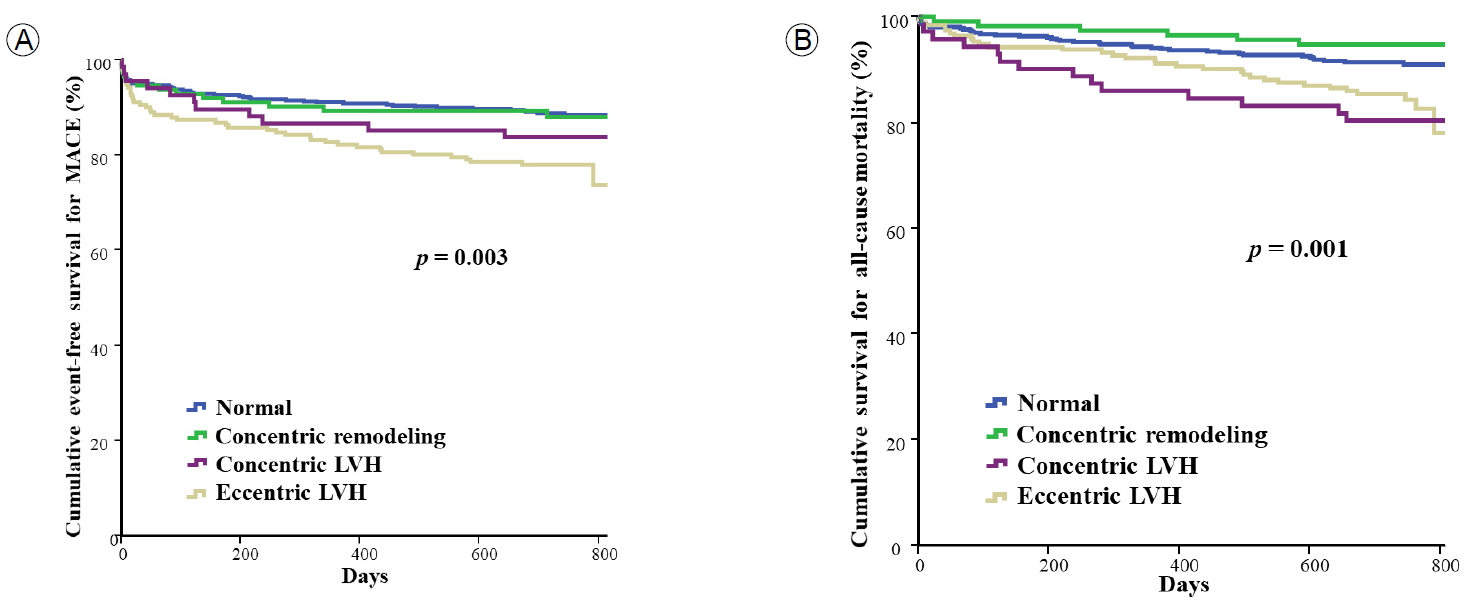
Kaplan-Meier curves for MACEs and all-cause mortality according to LVH subtype. (A) The rates of MACE-free survival and (B) all-cause mortality were significantly lower in the eccentric hypertrophy subgroup than in the other subgroups of LVH (p = 0.003 and p = 0.001, respectively). MACEs, major adverse cardiac events; LVH, left ventricular hypertrophy.
고 찰
이 연구는 급성 심근경색증으로 입원한 환자를 대상으로 입원 당시 심장초음파 검사를 통하여 측정한 좌심실 질량지수 값과 좌심실 벽의 상대적 두께로 분류한 좌심실 비대군과 형태적 분류에 따라 사망을 포함한 MACE 발생과 임상경과의 차이를 알아보고자 하였다. 그 결과 좌심실 비대는 환자의 예후에 많은 영향을 미치고 있음을 확인할 수 있었고, 심장 사망을 포함한 재입원, 심근경색증의 재발 등 MACE 발생과도 유의하게 관련되어 있음을 알 수 있었다. 또한 형태적 분류에 따른 편심성 비대군은 환자의 사망을 포함한 MACE에 대한 독립적인 예측인자임을 파악할 수 있었다.
고혈압, 비만, 당뇨병과 대사이상 등은 각각 독립적으로 동맥경화를 주요 기전으로 심혈관 질환의 발생에 기여하며 좌심실 비대의 주요한 위험요인으로 주목받고 있다[19,20]. 고혈압은 심장의 압력 과부하를 야기하여 좌심실 질량의 증가에 기여하는 주요한 혈역학적 원인이 되며, 비만과 당뇨병과 같은 대사이상은 이러한 고혈압을 야기함으로써 좌심실 비대를 유발한다[21]. 좌심실 비대는 심장에 가해지는 과부하에 대한 심실의 적응과정에 의해 야기된 좌심실 질량의 비정상적인 증가와 구조변화로 정의될 수 있으며, 비정상적인 심부하에 대한 반응의 한 형태로서 심근 산소 소모량을 증가시킨다[22]. 또한, 관상동맥 혈류의 예비력을 감소시켜 심근에 산소의 요구와 공급에 불균형을 초래하여 협심증, 심근경색증 및 부정맥, 급사를 일으킬 수 있어서 좌심실 비대의 유무는 환자의 심혈관 질환의 유병률과 예후 판정에 중요한 위험인자로 꼽히고 있다[23]. Park 등[24]은 좌심실 비대는 성공적인 PCI를 받은 급성 심근경색증 환자의 모든 원인의 사망률과 관련이 있고, 좌심실 비대의 형태적 분류에 따라 다른 위험 요소를 조절한 후에도 모든 원인의 사망률에 영향을 준다고 보고하였다. 본 연구에서도 좌심실 비대가 2년간의 MACE와 사망률에 큰 영향을 줄 수 있음을 확인하였다. 또한, 좌심실 비대는 심근경색증의 기왕력, 판막 질환, 고혈압 등이 있는 경우와 운동선수에서 더 잘 나타나고[25], 그 외에도 성별에 따라, 비만도가 높을수록, 나이가 들수록 증가하는 것으로 알려져 있다[26,27].
순환기계의 독립적인 위험인자인 좌심실 비대는 좌심실 질량의 증가로 확인할 수 있고, 이로 인하여 심기능 저하와 동맥경화증의 촉진, 심근허혈이나 섬유화를 통한 부정맥의 발생을 증가시켜 사망률을 높인다고 보고된 바 있다[28]. 본 연구에서도 좌심실 질량과 좌심실 질량지수 값의 증가가 환자의 예후에 유의한 영향이 있음을 확인하였다.
급성 심근경색증으로부터 생존한 환자의 예후를 결정하는 인자로는 환자의 연령, 관상동맥 병변의 정도, 심실성 부정맥의 발생 등과 함께 좌심실 부전증인 것으로 알려져 있다[29,30]. 본 연구에서 좌심실 비대군은 정상군에 비해 평균 연령이 높았는데, 고령에서 나타나는 심장 질환은 좌심실 기능이 저하되어 있고 동반 질환을 갖는 경우가 많다는 보고가 있다[31]. 관상동맥 병변의 정도에서는 좌심실 구조를 정상군과 좌심실 비대군으로 비교해 보았을 때에 두 군 간에는 유의한 차이를 보이지 않았지만, 좌심실 비대의 형태적 분류에 따른 비교에서는 병변 혈관수에 따라 세 군 간의 유의한 차이가 있음을 확인하였다. 비정상 좌심실 비대는 심부전의 위험 증가와 관련이 있고, 특히 편심성 비대는 약 90% 정도의 높은 심부전의 위험이 있다는 보고가 있다[32]. 심부전은 여러 가지 원인에 의해 발생할 수 있지만 심근경색증 후에 발생하는 경우가 많으며[33], 비교적 나쁜 예후를 예측할 수 있었다.
본 연구의 제한점으로는 첫째, 여러 검사자들에 의해 심장 초음파 검사가 시행되었으므로 좌심실 두께 측정에 약간의 오차가 존재할 수 있다. 둘째, 이 연구에서 환자의 임상 추적관찰은 PCI 후 지속적으로 내원한 환자만을 대상으로 하였으므로 이로 인하여 중재술 후 타 병원으로 통원하거나 입원한 환자 등은 누락될 수 있었다. 셋째, 선행 연구들을 통하여 환자의 예후와 관련이 있는 것으로 보고된 좌심실 수축기능 지표인 구혈률도 양 군 사이에 유의한 차이를 보여 적절한 임계값을 이용하여 보정이 필요할 것으로 보인다. 넷째, 심근경색의 위치에 따른 좌심실 비대의 형태의 차이에 대해 추적 관찰 연구가 필요할 것으로 생각된다. 다섯째, 좌심실 비대군을 형태적 분류로 나누었을 때 환자 수가 적어 해석에 한계가 있을 수 있다.
결론적으로 좌심실 구조를 좌심실 질량지수 값과 좌심실 벽의 상대적 두께에 따라 정상군과 좌심실 비대군으로 분류하여 분석해 보았을 때, 좌심실 비대군에서 MACE 발생이 유의하게 높았다. 좌심실 구조를 좌심실 질량지수 값과 좌심실 벽의 상대적 두께를 기준에 따른 형태적 분류에 따라 비교해 보았을 때에도, 편심성 비대인 경우에 MACE 발생과 사망률에도 관련이 있음을 확인할 수 있었다.
급성 심근경색증 환자에서 심장초음파를 시행한 852명의 환자를 2년간 추적 관찰하여 분석한 결과, 좌심실 비대군은 정상인 환자보다 예후가 좋지 못하였고, 좌심실 구조의 형태적 분류에 따라서는 편심성 비대인 환자에서 사망률이 유의하게 높았다. 좌심실 비대는 급성 심근경색증 환자에서 국소벽 운동 이상 및 벽 두께의 얇아짐이 있을 경우 수치에 영향을 받을 수 있다. 특히 편심성 비대와 동심성 비대를 구분하는 지표인 좌심실 벽의 상대적 벽 두께는 좌심실 후벽 두께가 허혈성 손상이 있어 벽 두께가 얇아지거나 좌심실 재형성이 진행하여 좌심실 이완기말 내경이 증가된 경우 좌심실 벽의 상대적 벽 두께가 감소하여 편심성 비대로 진단할 수 있다. 따라서 본 연구의 결과에서 좌심실 비대와 형태적 분류가 급성 심근경색증 환자의 진행된 허혈성 심장 질환을 반영하는 지표임을 알 수 있었고, 내원 시 좌심실 비대군인 환자, 특히 편심성 비대를 동반한 환자에서는 주의 깊은 관찰과 적극적인 치료가 필요할 것으로 사료된다.
Supplementary Materials
Acknowledgements
This study was supported by grants of The Korean Health Technology R & D Project, Ministry of Health & Welfare (HI13C1527) and the Research of Korea Centers for Disease Control and Prevention (2016-ER6304-01), Republic of Korea.




